黑木耳中含有丰富的人体所必需的铁元素。某研究小组测定黑木耳中铁元素含量,实验方案如下。回答下列问题:
I.实验需用 溶液
溶液
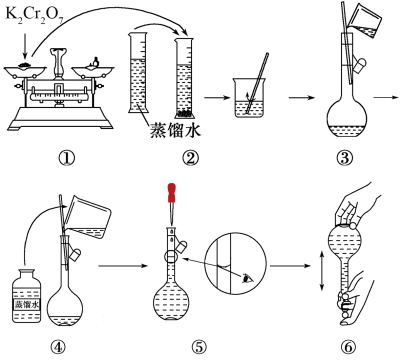
(1)观察图示判断其中不正确的操作有_______ 。(填序号)
(2)实验需称量 固体
固体_______ g。
(3)为了增强 溶液的氧化性,还需用
溶液的氧化性,还需用 (密度为
(密度为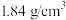 )的浓硫酸配制
)的浓硫酸配制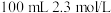 的稀硫酸用于实验。
的稀硫酸用于实验。
①该浓硫酸的物质的量浓度为_______  ,需用浓硫酸的体积为
,需用浓硫酸的体积为_______  。
。
②若所配制的稀硫酸浓度偏小,则下列可能的原因中分析正确的是_______ 。
A.量筒用蒸馏水洗净后立即用来量取浓硫酸
B.硫酸稀释后没有冷却至室温就立即完成后面的配制操作
C.定容时俯视容量瓶刻度线
D.定容摇匀后静止,发现液面低于刻度线,再加蒸馏水至刻度线
II.测定黑木耳中铁元素含量(已知黑木耳提取液中铁元素以 和
和 的形式存在)
的形式存在)
(4)“步骤一中加入过量铜粉的目的是_______ 。
(5)已知步骤二中发生反应的化学方程式: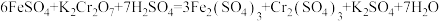 ;实验测得黑木耳中铁元素的质量分数为
;实验测得黑木耳中铁元素的质量分数为_______ 。
I.实验需用
 溶液
溶液
(1)观察图示判断其中不正确的操作有
(2)实验需称量
 固体
固体(3)为了增强
 溶液的氧化性,还需用
溶液的氧化性,还需用 (密度为
(密度为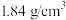 )的浓硫酸配制
)的浓硫酸配制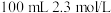 的稀硫酸用于实验。
的稀硫酸用于实验。①该浓硫酸的物质的量浓度为
 ,需用浓硫酸的体积为
,需用浓硫酸的体积为 。
。②若所配制的稀硫酸浓度偏小,则下列可能的原因中分析正确的是
A.量筒用蒸馏水洗净后立即用来量取浓硫酸
B.硫酸稀释后没有冷却至室温就立即完成后面的配制操作
C.定容时俯视容量瓶刻度线
D.定容摇匀后静止,发现液面低于刻度线,再加蒸馏水至刻度线
II.测定黑木耳中铁元素含量(已知黑木耳提取液中铁元素以
 和
和 的形式存在)
的形式存在)| 步骤一 | 取 黑木耳,经灼烧、硫酸浸制得提取液,加入过量的铜粉 黑木耳,经灼烧、硫酸浸制得提取液,加入过量的铜粉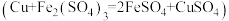 |
| 步骤二 | 过滤,向滤液中加入 酸性 酸性 溶液 溶液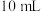 时,恰好完全反应 时,恰好完全反应 |
(5)已知步骤二中发生反应的化学方程式:
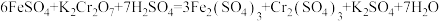 ;实验测得黑木耳中铁元素的质量分数为
;实验测得黑木耳中铁元素的质量分数为
更新时间:2022/11/13 21:50:44
|
相似题推荐
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐1】“84消毒液”能有效杀灭甲型H1N1病毒,某同学购买了一瓶“威露士”牌“84消毒液”,该消毒液通常稀释100倍(体积比)使用。查阅相关资料和消毒液包装说明得到如下信息:
(1)该“84消毒液”的物质的量浓度约为___________  。(保留一位小数)
。(保留一位小数)
(2)某同学取100 mL该“84消毒液”,稀释后用于消毒,稀释后的溶液中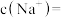
___________  。
。
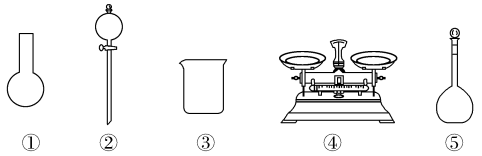
(3)该同学参阅该“84消毒液”的配方,欲用NaClO固体配制480 mL含NaClO质量分数为25%的消毒液。下列说法正确的是___________(填字母)。
(4)取用任意体积的该盐溶液时,下列物理量中会随所取体积的多少而变化的是___________(填字母)。
(5)“84消毒液”与稀硫酸混合使用可增强消毒能力,某消毒小组人员用98%(密度为1.8  )的浓硫酸配制100mL物质的量浓度为0.8
)的浓硫酸配制100mL物质的量浓度为0.8  的稀硫酸用于增强“84消毒液”的消毒能力。
的稀硫酸用于增强“84消毒液”的消毒能力。
①所配制的稀硫酸中, 的物质的量浓度为
的物质的量浓度为___________ mol/L
②需要用量筒量取___________ mL上述浓硫酸进行配制。(保留一位小数)
③为配制上述稀硫酸,除了量筒、烧杯、玻璃棒外,还缺少的玻璃仪器是___________ 、___________ 。
④在配制过程中,下列实验操作可能导致配制的硫酸溶液浓度偏高的是___________ (填序号)。
a.定容时俯视观察
b.定容后经振荡、摇匀、静置后,发现液面下降,再加适量的蒸馏水
c.浓硫酸在烧杯中加水稀释后,未冷却就向容量瓶中转移
d.容量瓶未干燥即用来配制溶液
e.往容量瓶转移时,有少量液体溅出
f.未洗涤稀释浓硫酸的烧杯
| 84消毒液 有效成分NaClO 规格1000 mL 质量分数25% 密度1.19  |
 。(保留一位小数)
。(保留一位小数)(2)某同学取100 mL该“84消毒液”,稀释后用于消毒,稀释后的溶液中
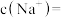
 。
。(3)该同学参阅该“84消毒液”的配方,欲用NaClO固体配制480 mL含NaClO质量分数为25%的消毒液。下列说法正确的是___________(填字母)。

| A.如图所示的仪器中,有三种是不需要的,还需要一种玻璃仪器 |
| B.容量瓶用蒸馏水洗净后,应烘干后才能用于溶液配制 |
| C.利用购买的商品NaClO来配制可能导致结果偏低 |
| D.需要称量NaClO固体的质量为142.8 g |
| A.溶液中NaClO的摩尔质量 |
| B.溶液的浓度 |
| C.溶液中NaClO的物质的量 |
| D.溶液的密度 |
 )的浓硫酸配制100mL物质的量浓度为0.8
)的浓硫酸配制100mL物质的量浓度为0.8  的稀硫酸用于增强“84消毒液”的消毒能力。
的稀硫酸用于增强“84消毒液”的消毒能力。①所配制的稀硫酸中,
 的物质的量浓度为
的物质的量浓度为②需要用量筒量取
③为配制上述稀硫酸,除了量筒、烧杯、玻璃棒外,还缺少的玻璃仪器是
④在配制过程中,下列实验操作可能导致配制的硫酸溶液浓度偏高的是
a.定容时俯视观察
b.定容后经振荡、摇匀、静置后,发现液面下降,再加适量的蒸馏水
c.浓硫酸在烧杯中加水稀释后,未冷却就向容量瓶中转移
d.容量瓶未干燥即用来配制溶液
e.往容量瓶转移时,有少量液体溅出
f.未洗涤稀释浓硫酸的烧杯
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐2】 可用作营养增补剂,溶于水会放出热量,在潮湿的空气中易被氧化成棕黄色碱式硫酸铁。甲同学欲用
可用作营养增补剂,溶于水会放出热量,在潮湿的空气中易被氧化成棕黄色碱式硫酸铁。甲同学欲用 固体配制
固体配制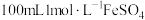 溶液,回答下列问题:
溶液,回答下列问题:
(1) 中Fe的化合价为
中Fe的化合价为_______ ,容量瓶使用前需要进行的操作为_______ 。
(2)配制溶液时正确的操作顺序是计算→称量→_______ (填标号,下同)→转移→_______ →_______ →摇匀→装瓶贴标签。
a.洗涤 b.定容 c.溶解
(3)配制溶液时,下列实验操作会使所配溶液浓度偏低的是_______(填标号)。
(4)配制好的硫酸亚铁溶液中会加入少量铁粉,原因可能是_______ 。
(5)乙同学将铝片用砂纸打磨干净后放入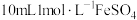 溶液中,用于探究铝与硫酸亚铁溶液的反应。
溶液中,用于探究铝与硫酸亚铁溶液的反应。
①将铝片用砂纸打磨的目的是_______ ,
②铝片放入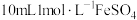 溶液中发生反应的化学方程式为
溶液中发生反应的化学方程式为_______ 。
 可用作营养增补剂,溶于水会放出热量,在潮湿的空气中易被氧化成棕黄色碱式硫酸铁。甲同学欲用
可用作营养增补剂,溶于水会放出热量,在潮湿的空气中易被氧化成棕黄色碱式硫酸铁。甲同学欲用 固体配制
固体配制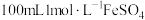 溶液,回答下列问题:
溶液,回答下列问题:(1)
 中Fe的化合价为
中Fe的化合价为(2)配制溶液时正确的操作顺序是计算→称量→
a.洗涤 b.定容 c.溶解
(3)配制溶液时,下列实验操作会使所配溶液浓度偏低的是_______(填标号)。
| A.容量瓶洗干净后底部残留少量水分 |
B.称量时, 固体中含有少量 固体中含有少量 |
| C.转移时部分液体溅出容量瓶 |
| D.摇匀后装瓶贴标签,容量瓶内残留少量溶液 |
(5)乙同学将铝片用砂纸打磨干净后放入
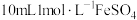 溶液中,用于探究铝与硫酸亚铁溶液的反应。
溶液中,用于探究铝与硫酸亚铁溶液的反应。①将铝片用砂纸打磨的目的是
②铝片放入
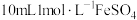 溶液中发生反应的化学方程式为
溶液中发生反应的化学方程式为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐3】某同学在实验室欲配制物质的量浓度均为1.0mol·L-1的NaOH溶液、稀硫酸各450mL。提供的试剂是NaOH固体、98%的浓硫酸(密度为1.84g·cm-3)和蒸馏水。
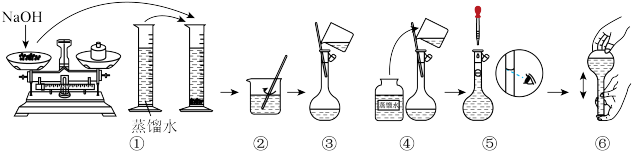
(1)请你观察图示,判断其中不正确的操作有___________ (填序号)。
(2)应用托盘天平称量NaOH固体___________ g,应用量筒量取浓硫酸_________ mL。
(3)浓硫酸用于配制稀硫酸时,需先进行稀释,稀释浓硫酸的方法是________________ 。
(4)在配制上述溶液的实验中,下列操作引起结果偏低的有_________ (填字母)。
A.该学生在量取浓硫酸时,俯视刻度线
B.称量NaOH固体时,将砝码和药品的位置颠倒
C.稀释浓硫酸后没有冷却至室温就立即完成后面的配制操作
D.在烧杯中溶解搅拌时,溅出少量溶液
E.没有用蒸馏水洗涤烧杯2~3次
F.将量取浓硫酸的量筒洗涤2~3次,并全部转移至容量瓶中

(1)请你观察图示,判断其中不正确的操作有
(2)应用托盘天平称量NaOH固体
(3)浓硫酸用于配制稀硫酸时,需先进行稀释,稀释浓硫酸的方法是
(4)在配制上述溶液的实验中,下列操作引起结果偏低的有
A.该学生在量取浓硫酸时,俯视刻度线
B.称量NaOH固体时,将砝码和药品的位置颠倒
C.稀释浓硫酸后没有冷却至室温就立即完成后面的配制操作
D.在烧杯中溶解搅拌时,溅出少量溶液
E.没有用蒸馏水洗涤烧杯2~3次
F.将量取浓硫酸的量筒洗涤2~3次,并全部转移至容量瓶中
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐1】现用质量分数为98%(密度为1.84 g·cm-3)浓H2SO4来配制450 mL、0.2 mol·L-1稀H2SO4。可供选择的仪器有:①玻璃棒;②烧瓶;③烧杯;④胶头滴管;⑤量筒;⑥容量瓶;⑦托盘天平;⑧药匙。请回答下列问题:
(1)上述仪器中,在配制稀H2SO4时用不到的有___________________ (填代号)。
(2)经计算,需浓H2SO4的体积为_______________ 。现有:①5 mL、②10 mL、③20 mL、④50 mL三种规格量筒,你选用的量筒是_______________ 。
(3)在配制过程中,其他操作都准确,下列操作中:错误的是_________________ ,能引起浓度偏高的有___________ (填代号)。
①将浓H2SO4直接倒入烧杯,再向烧杯中注入蒸馏水来稀释浓H2SO4
②未等稀释后的H2SO4溶液冷却至室温就转移到容量瓶中
③洗涤溶解用的烧杯与玻璃棒,并将洗涤液转移到容量瓶中
④转移前,容量瓶中含有少量蒸馏水
⑤定容时,俯视标线
⑥定容摇匀后,发现液面低于标线,又用胶头滴管加蒸馏水至标线
(4)所得溶液中氢离子和硫酸根离子个数比是____________________ 。
(1)上述仪器中,在配制稀H2SO4时用不到的有
(2)经计算,需浓H2SO4的体积为
(3)在配制过程中,其他操作都准确,下列操作中:错误的是
①将浓H2SO4直接倒入烧杯,再向烧杯中注入蒸馏水来稀释浓H2SO4
②未等稀释后的H2SO4溶液冷却至室温就转移到容量瓶中
③洗涤溶解用的烧杯与玻璃棒,并将洗涤液转移到容量瓶中
④转移前,容量瓶中含有少量蒸馏水
⑤定容时,俯视标线
⑥定容摇匀后,发现液面低于标线,又用胶头滴管加蒸馏水至标线
(4)所得溶液中氢离子和硫酸根离子个数比是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐2】某品牌糖衣片补血剂,除去糖衣后显淡蓝绿色,主要成分是硫酸亚铁,不含其它铁的化合物。某研究性学习小组为测定该补血剂中硫酸亚铁的含量进行了以下探究:
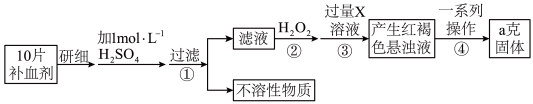
请回答下列问题:
Ⅰ、
(1)实验时用 的浓硫酸,配制100mL
的浓硫酸,配制100mL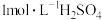 溶液,所需浓硫酸的体积为
溶液,所需浓硫酸的体积为___________ mL(计算结果精确到小数点后一位)。
(2)下列操作中,容量瓶所具备的功能有___________(填序号)。
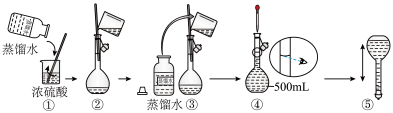
(3)在下列配制过程示意图中,有错误的是(填写序号)___________ 。
(4)下列说法正确的___________。
Ⅱ、
(5)步骤②加入过量 的目的:
的目的:___________ 。发生反应的离子方程式为:___________ 。
(6)从红褐色的悬浊液到最后的称量,其过程中所需的基本操作为:
a、___________ ,b、洗涤,c、灼烧,d、冷却
(7)若称得固体的质量为ag,则每片补血剂中含硫酸亚铁的质量为___________ g。

请回答下列问题:
Ⅰ、
(1)实验时用
 的浓硫酸,配制100mL
的浓硫酸,配制100mL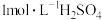 溶液,所需浓硫酸的体积为
溶液,所需浓硫酸的体积为(2)下列操作中,容量瓶所具备的功能有___________(填序号)。
| A.配制一定体积准确浓度的标准溶液 | B.长期贮存溶液 |
| C.用来溶解固体溶质 | D.常用来代替量筒量取一定体积的液体 |

(4)下列说法正确的___________。
| A.洗涤烧杯2~3次,并将洗涤液移入容量瓶以减少误差 |
| B.某同学将浓硫酸稀释后未冷却至室温便将溶液转移至容量瓶,所配溶液浓度会偏低 |
| C.定容时仰视观察,所配溶液浓度会偏低 |
| D.容量瓶使用前先要检查是否漏液,具体操作是向容量瓶中加蒸馏水,倒置不漏液即可 |
Ⅱ、
(5)步骤②加入过量
 的目的:
的目的:(6)从红褐色的悬浊液到最后的称量,其过程中所需的基本操作为:
a、
(7)若称得固体的质量为ag,则每片补血剂中含硫酸亚铁的质量为
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
【推荐3】元素的“价-类”二维图是同学们认识物质性质及其转化关系的重要思维工具,从物质类别、化合价角度认识含氯元素的物质的性质及其转化关系,图中甲~辛均为含氯元素的物质。回答下列问题:

(1)己的化学式为_______ 。
(2)甲、乙、丙中,属于非电解质的是_______ (填化学式)。
(3)检验溶液丁中含 的方法:向少量丁溶液中滴加
的方法:向少量丁溶液中滴加 溶液,然后再加入适量酸
溶液,然后再加入适量酸 ,酸
,酸 为
为_______ (填名称),加入酸Y的目的是_______ 。
(4)庚为漂白粉的有效成分,写出由乙制备漂白粉的化学方程式_______ 。
(5)庚是“84消毒液”的有效成分,能有效灭菌。某化学社团模拟生产厂家配制了 “84消毒液”,并在瓶体贴上标签,如图所示。回答下列问题:
“84消毒液”,并在瓶体贴上标签,如图所示。回答下列问题:
①该“84消毒液”有效成分的物质的量浓度为_______  。
。
②“84消毒液”与稀硫酸混合使用可增强消毒能力,请用化学方程式解释其原因_______ 。某消毒小组人员用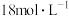 的浓硫酸配制
的浓硫酸配制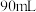
 的稀硫酸用于增强“84消毒液”的消毒能力,配制该稀硫酸的过程中,除用到量筒、烧杯、玻璃棒及胶体滴管外,还需要的玻璃仪器有
的稀硫酸用于增强“84消毒液”的消毒能力,配制该稀硫酸的过程中,除用到量筒、烧杯、玻璃棒及胶体滴管外,还需要的玻璃仪器有_______ 。若所配制的稀硫酸浓度偏高,则可能的原因是_______ (填字母)。
A.配制前,容量瓶中有少量蒸馏水 B.量取浓硫酸时,仰视液体的凹液面
C.未冷却,立即转移至容量瓶定容 D.未洗涤烧杯和玻璃棒

(1)己的化学式为
(2)甲、乙、丙中,属于非电解质的是
(3)检验溶液丁中含
 的方法:向少量丁溶液中滴加
的方法:向少量丁溶液中滴加 溶液,然后再加入适量酸
溶液,然后再加入适量酸 ,酸
,酸 为
为(4)庚为漂白粉的有效成分,写出由乙制备漂白粉的化学方程式
(5)庚是“84消毒液”的有效成分,能有效灭菌。某化学社团模拟生产厂家配制了
 “84消毒液”,并在瓶体贴上标签,如图所示。回答下列问题:
“84消毒液”,并在瓶体贴上标签,如图所示。回答下列问题: | 84消毒液 |
| (有效成分)NaClO (规格)500mL |
| (质量分数)14.9% (密度)1.1g·cm-3 |
 。
。②“84消毒液”与稀硫酸混合使用可增强消毒能力,请用化学方程式解释其原因
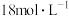 的浓硫酸配制
的浓硫酸配制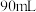
 的稀硫酸用于增强“84消毒液”的消毒能力,配制该稀硫酸的过程中,除用到量筒、烧杯、玻璃棒及胶体滴管外,还需要的玻璃仪器有
的稀硫酸用于增强“84消毒液”的消毒能力,配制该稀硫酸的过程中,除用到量筒、烧杯、玻璃棒及胶体滴管外,还需要的玻璃仪器有A.配制前,容量瓶中有少量蒸馏水 B.量取浓硫酸时,仰视液体的凹液面
C.未冷却,立即转移至容量瓶定容 D.未洗涤烧杯和玻璃棒
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
解题方法
【推荐1】现有一瓶无色澄清的溶液,仅由 、
、 、
、 、
、 、
、 、
、 、
、 、
、 、
、 、
、 中的若干种离子组成(每种离子的物质的量均为0.3mol),现将该溶液均分成三等份,进行如下实验:
中的若干种离子组成(每种离子的物质的量均为0.3mol),现将该溶液均分成三等份,进行如下实验:
①取第一份溶液进行焰色试验,呈黄色。透过蓝色钴玻璃观察,未见紫色;
②向第二份中滴加足量稀硝酸,有气体X产生,再加入足量 溶液,得到白色沉淀,过滤后,在滤液中加入足量稀硝酸酸化的
溶液,得到白色沉淀,过滤后,在滤液中加入足量稀硝酸酸化的 溶液,又有白色沉淀生成。
溶液,又有白色沉淀生成。
③向第三份中加入足量NaOH溶液,加热,生成有刺激性气味的气体和白色沉淀;
根据以上实验,请回答下列问题:
(1)不做任何实验,即可确定一定不含有的离子为_______ ,实验①确定一定含有的离子为_______ 。
(2)实验②气体X的化学式是_______ ,该实验中得到的沉淀的总质量为_______ g。
(3)实验③生成白色沉淀的离子方程式为_______ 。该实验中消耗的NaOH的总物质的量为_______ mol。
(4)通过以上实验确定_______  (填“一定有”、“可能有”或“一定无”),理由是
(填“一定有”、“可能有”或“一定无”),理由是_______ 。
(5)若向第三份中加入足量 溶液,充分反应后生成沉淀物质的量为
溶液,充分反应后生成沉淀物质的量为_______ mol。
 、
、 、
、 、
、 、
、 、
、 、
、 、
、 、
、 、
、 中的若干种离子组成(每种离子的物质的量均为0.3mol),现将该溶液均分成三等份,进行如下实验:
中的若干种离子组成(每种离子的物质的量均为0.3mol),现将该溶液均分成三等份,进行如下实验:①取第一份溶液进行焰色试验,呈黄色。透过蓝色钴玻璃观察,未见紫色;
②向第二份中滴加足量稀硝酸,有气体X产生,再加入足量
 溶液,得到白色沉淀,过滤后,在滤液中加入足量稀硝酸酸化的
溶液,得到白色沉淀,过滤后,在滤液中加入足量稀硝酸酸化的 溶液,又有白色沉淀生成。
溶液,又有白色沉淀生成。③向第三份中加入足量NaOH溶液,加热,生成有刺激性气味的气体和白色沉淀;
根据以上实验,请回答下列问题:
(1)不做任何实验,即可确定一定不含有的离子为
(2)实验②气体X的化学式是
(3)实验③生成白色沉淀的离子方程式为
(4)通过以上实验确定
 (填“一定有”、“可能有”或“一定无”),理由是
(填“一定有”、“可能有”或“一定无”),理由是(5)若向第三份中加入足量
 溶液,充分反应后生成沉淀物质的量为
溶液,充分反应后生成沉淀物质的量为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐2】过氧化钙是重要的工业原料,350℃时能迅速分解,生成氧化钙,并放出氧气。工业上将碳酸钙溶于适量的盐酸中,在低温和碱性条件下,与过氧化氢反应制得:CaCO3+2HCl=CaCl2+CO2↑+H2O,CaCl2+H2O2+2NH3+8H2O=CaO2•8H2O↓+2NH4Cl。如图是实验室测定产品中过氧化钙含量的装置。试回答下列问题:
(1)上述制备工艺中,分离出主产品的操作方法是_______ 、烘干,分离出副产品的操作方法是_______ 。
(2)如图装置,检查系统是否漏气的方法是_______ 。

(3)正确读取量气管内液面的初、终读数前都需进行的操作是_______ 。
(4)已知:样品质量mg,量气管初读数amL,终读数bmL,该实验条件下气体摩尔体积Vm=cL•mol-1,样品中过氧化钙的含量表达式w%=_______ 。
(1)上述制备工艺中,分离出主产品的操作方法是
(2)如图装置,检查系统是否漏气的方法是

(3)正确读取量气管内液面的初、终读数前都需进行的操作是
(4)已知:样品质量mg,量气管初读数amL,终读数bmL,该实验条件下气体摩尔体积Vm=cL•mol-1,样品中过氧化钙的含量表达式w%=
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐3】以锂云母矿粉(主要成分为 ,还有少量
,还有少量 、
、 、
、 )为原料制备
)为原料制备 ,
, 可用于制备锂电池的正极材料
可用于制备锂电池的正极材料 。
。
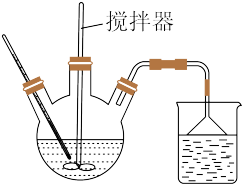
(1)浸取。向锂云母矿粉中加入30%硫酸,加热至90℃,实验装置如图所示。烧杯中盛装的试剂是_______ ,作用是_______ 。
(2)除杂。向酸浸后的溶液中加入NaOH溶液,调节溶液的pH约为6,过滤。再向滤液中继续滴加NaOH溶液至溶液的 ,过滤,所得滤液中溶质的主要成分是
,过滤,所得滤液中溶质的主要成分是_______ [已知完全沉淀时的pH: 为5.2,
为5.2, 为3.2,
为3.2, 为11.1]。
为11.1]。
(3)制备 。将所得滤液蒸发浓缩,向浓缩后的滤液中加入稍过量饱和
。将所得滤液蒸发浓缩,向浓缩后的滤液中加入稍过量饱和 溶液,减压加热煮沸,趁热过滤,将滤渣洗涤烘干,得到
溶液,减压加热煮沸,趁热过滤,将滤渣洗涤烘干,得到 固体。检验
固体。检验 是否洗涤干净的实验方法是
是否洗涤干净的实验方法是_______ 。
(4)制备 。
。
① 和
和 混合后,在空气中高温加热可以制备锂电池的正极材料
混合后,在空气中高温加热可以制备锂电池的正极材料 ,写出反应的化学方程式:
,写出反应的化学方程式:_______ 。
② 可通过加热
可通过加热 制得。
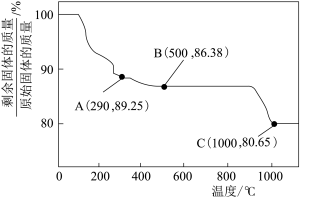
制得。 在空气中受热时,固体残留率随温度的变化如图所示,试通过计算确定最适宜的加热温度
在空气中受热时,固体残留率随温度的变化如图所示,试通过计算确定最适宜的加热温度_______ 。(写出计算过程)
 ,还有少量
,还有少量 、
、 、
、 )为原料制备
)为原料制备 ,
, 可用于制备锂电池的正极材料
可用于制备锂电池的正极材料 。
。(1)浸取。向锂云母矿粉中加入30%硫酸,加热至90℃,实验装置如图所示。烧杯中盛装的试剂是

(2)除杂。向酸浸后的溶液中加入NaOH溶液,调节溶液的pH约为6,过滤。再向滤液中继续滴加NaOH溶液至溶液的
 ,过滤,所得滤液中溶质的主要成分是
,过滤,所得滤液中溶质的主要成分是 为5.2,
为5.2, 为3.2,
为3.2, 为11.1]。
为11.1]。(3)制备
 。将所得滤液蒸发浓缩,向浓缩后的滤液中加入稍过量饱和
。将所得滤液蒸发浓缩,向浓缩后的滤液中加入稍过量饱和 溶液,减压加热煮沸,趁热过滤,将滤渣洗涤烘干,得到
溶液,减压加热煮沸,趁热过滤,将滤渣洗涤烘干,得到 固体。检验
固体。检验 是否洗涤干净的实验方法是
是否洗涤干净的实验方法是(4)制备
 。
。①
 和
和 混合后,在空气中高温加热可以制备锂电池的正极材料
混合后,在空气中高温加热可以制备锂电池的正极材料 ,写出反应的化学方程式:
,写出反应的化学方程式:②
 可通过加热
可通过加热 制得。
制得。 在空气中受热时,固体残留率随温度的变化如图所示,试通过计算确定最适宜的加热温度
在空气中受热时,固体残留率随温度的变化如图所示,试通过计算确定最适宜的加热温度
您最近一年使用:0次



