NH3具有易液化、含氢密度高、应用广泛等优点,NH3的合成及应用一直是科学研究的重要课题。
(1)以H2、N2合成NH3,Fe是常用的催化剂。
①基态Fe原子的电子排布式为_______ 。
②实际生产中采用铁的氧化物Fe2O3、FeO,使用前用H2和N2的混合气体将它们还原为具有活性的金属铁。铁的两种晶胞(所示图形为正方体)结构示意如下:
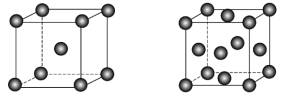
i.两种晶胞所含铁原子个数比为_______ 。
ii.图1晶胞的棱长为apm(1pm=1×10-10cm),则其密度ρ=_______ g·cm-3。
③我国科学家开发出Fe-LiH等双中心催化剂,在合成NH3中显示出高催化活性。第一电离能(I1):I1(H)>I1(Li)>I1(Na),原因是_______ 。
(2)化学工业科学家侯德榜利用下列反应最终制得了高质量的纯碱:NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl
①1体积水可溶解1体积CO2,1体积水可溶解约700体积NH3,NH3极易溶于水的原因是_______ 。
②NaHCO3分解得Na2CO3, 空间结构为
空间结构为_______ 。
(3)NH3、NH3BH3(氨硼烷)储氢量高,是具有广泛应用前景的储氢材料。
①NH3BH3存在配位键,提供空轨道的是_______ 。
②比较熔点:NH3BH3_______ CH3CH3(填“>”或“<”)。
(1)以H2、N2合成NH3,Fe是常用的催化剂。
①基态Fe原子的电子排布式为
②实际生产中采用铁的氧化物Fe2O3、FeO,使用前用H2和N2的混合气体将它们还原为具有活性的金属铁。铁的两种晶胞(所示图形为正方体)结构示意如下:

i.两种晶胞所含铁原子个数比为
ii.图1晶胞的棱长为apm(1pm=1×10-10cm),则其密度ρ=
③我国科学家开发出Fe-LiH等双中心催化剂,在合成NH3中显示出高催化活性。第一电离能(I1):I1(H)>I1(Li)>I1(Na),原因是
(2)化学工业科学家侯德榜利用下列反应最终制得了高质量的纯碱:NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl
①1体积水可溶解1体积CO2,1体积水可溶解约700体积NH3,NH3极易溶于水的原因是
②NaHCO3分解得Na2CO3,
 空间结构为
空间结构为(3)NH3、NH3BH3(氨硼烷)储氢量高,是具有广泛应用前景的储氢材料。
| 元素 | H | B | N |
| 电负性 | 2.1 | 2.0 | 3.0 |
①NH3BH3存在配位键,提供空轨道的是
②比较熔点:NH3BH3
更新时间:2022-11-21 23:54:30
|
相似题推荐
解答题-结构与性质
|
适中
(0.65)
名校
【推荐1】I.离子液体是一种由离子构成的很有研究价值的溶剂,研究显示最常见的离子液体主要由如图1所示正离子和负离子构成,图1中正离子有令人惊奇的稳定性。
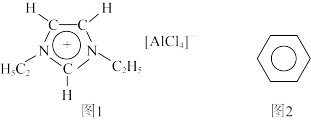
(1)下列关于离子液体的说法正确的是_______ 。
A.该化合物中不存在非极性键和氢键
B.图中负离子的空间结构为正四面体形
C.图中正离子中碳原子的杂化方式为sp2、sp3
(2)分子中的大π键可用符号 表示,其中m代表形成大π键的原子数,n代表形成大π键的电子数(图2为苯分子的结构简式,苯分子中的大π键可表示为
表示,其中m代表形成大π键的原子数,n代表形成大π键的电子数(图2为苯分子的结构简式,苯分子中的大π键可表示为 ),则图1正离子中的大π键表示为
),则图1正离子中的大π键表示为_______ 。
II.研究元素周期表右上角区域元素,有利于研发新型绿色农药,如:
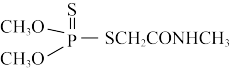
(3)基态S原子核外电子排布式为_______ 。
(4)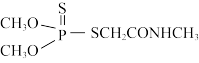 中所含元素H、O、P、S的电负性从大到小的顺序为
中所含元素H、O、P、S的电负性从大到小的顺序为_______ ; 的沸点是
的沸点是 ,
, 的沸点是
的沸点是 ,
, 的沸点远高于
的沸点远高于 的沸点的原因是
的沸点的原因是_______ 。
(5)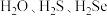 中最稳定的是
中最稳定的是_______ (填化学式,下同),还原性最强的是_______ 。
(6)已知酸性: .推测酸性:
.推测酸性:
_______ (填“>”或“<”) 。3-氯-2-丁氨酸的结构简式为
。3-氯-2-丁氨酸的结构简式为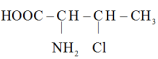 ,该有机物1个分子中含有
,该有机物1个分子中含有_______ 个手性碳原子。

(1)下列关于离子液体的说法正确的是
A.该化合物中不存在非极性键和氢键
B.图中负离子的空间结构为正四面体形
C.图中正离子中碳原子的杂化方式为sp2、sp3
(2)分子中的大π键可用符号
 表示,其中m代表形成大π键的原子数,n代表形成大π键的电子数(图2为苯分子的结构简式,苯分子中的大π键可表示为
表示,其中m代表形成大π键的原子数,n代表形成大π键的电子数(图2为苯分子的结构简式,苯分子中的大π键可表示为 ),则图1正离子中的大π键表示为
),则图1正离子中的大π键表示为II.研究元素周期表右上角区域元素,有利于研发新型绿色农药,如:
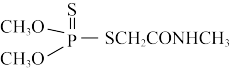
(3)基态S原子核外电子排布式为
(4)
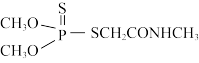 中所含元素H、O、P、S的电负性从大到小的顺序为
中所含元素H、O、P、S的电负性从大到小的顺序为 的沸点是
的沸点是 ,
, 的沸点是
的沸点是 ,
, 的沸点远高于
的沸点远高于 的沸点的原因是
的沸点的原因是(5)
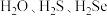 中最稳定的是
中最稳定的是(6)已知酸性:
 .推测酸性:
.推测酸性:
 。3-氯-2-丁氨酸的结构简式为
。3-氯-2-丁氨酸的结构简式为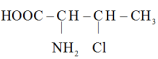 ,该有机物1个分子中含有
,该有机物1个分子中含有
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐2】氮、磷、砷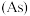 、锑
、锑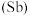 、铋
、铋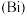 、镆
、镆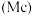 为元素周期表中原子序数依次增大的同族元素。回答下列问题:
为元素周期表中原子序数依次增大的同族元素。回答下列问题:
(1)砷在元素周期表中的位置_______ ;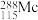 的中子数为
的中子数为_______ 。
(2)已知:
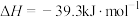

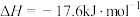
由此推知,其中最稳定的磷单质是_______ 。
(3)氮、磷、砷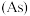 、锑
、锑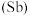 、铋
、铋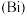 、镆
、镆 电负性依次
电负性依次_______ (增大或减小)。
(4) 和
和 与卤化氢的反应相似,产物的结构和性质也相似。下列对
与卤化氢的反应相似,产物的结构和性质也相似。下列对 与
与 反应产物的推断正确的是
反应产物的推断正确的是_______ (填序号)。
a.不能与 反应 b.含离子键、共价键 c.能与水反应
反应 b.含离子键、共价键 c.能与水反应
(5) 中配体分子
中配体分子 、
、 以及分子
以及分子 的空间结构和相应的键角如图所示。
的空间结构和相应的键角如图所示。
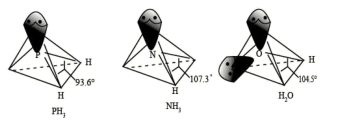
 中P的杂化类型是
中P的杂化类型是_______ ; 的键角小于
的键角小于 的,分析原因
的,分析原因_______ 。
(6)在1L真空密闭容器中加入amol 固体,t℃时发生如下反应:
固体,t℃时发生如下反应:
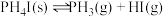 ①
①
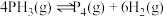 ②
②
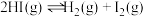 ③
③
达平衡时,体系中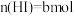 ,
, ,
,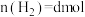 ,则t℃时反应①的平衡常数K值为
,则t℃时反应①的平衡常数K值为_______ (用字母表示)。
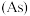 、锑
、锑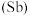 、铋
、铋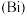 、镆
、镆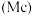 为元素周期表中原子序数依次增大的同族元素。回答下列问题:
为元素周期表中原子序数依次增大的同族元素。回答下列问题:(1)砷在元素周期表中的位置
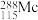 的中子数为
的中子数为(2)已知:

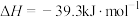

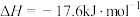
由此推知,其中最稳定的磷单质是
(3)氮、磷、砷
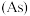 、锑
、锑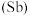 、铋
、铋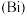 、镆
、镆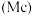 电负性依次
电负性依次(4)
 和
和 与卤化氢的反应相似,产物的结构和性质也相似。下列对
与卤化氢的反应相似,产物的结构和性质也相似。下列对 与
与 反应产物的推断正确的是
反应产物的推断正确的是a.不能与
 反应 b.含离子键、共价键 c.能与水反应
反应 b.含离子键、共价键 c.能与水反应(5)
 中配体分子
中配体分子 、
、 以及分子
以及分子 的空间结构和相应的键角如图所示。
的空间结构和相应的键角如图所示。
 中P的杂化类型是
中P的杂化类型是 的键角小于
的键角小于 的,分析原因
的,分析原因(6)在1L真空密闭容器中加入amol
 固体,t℃时发生如下反应:
固体,t℃时发生如下反应: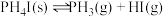 ①
①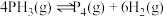 ②
②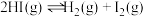 ③
③达平衡时,体系中
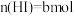 ,
, ,
,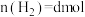 ,则t℃时反应①的平衡常数K值为
,则t℃时反应①的平衡常数K值为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐3】铁、钴、镍、铬、钼 、钨
、钨 都是重要的过渡元素,它们的单质和化合物在生活、生产中有广泛应用。
都是重要的过渡元素,它们的单质和化合物在生活、生产中有广泛应用。
(1)基态铬原子核外价电子排布图为________ ;铬元素最高化合价为_______ ,已知一种铬的氧化物的化学式为CrO5,其中Cr的化合价为最高价,该氧化物的结构式为____________ ,1mol该氧化物中所含过氧键的数目__________ 。
(2)铬离子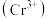 能形成多种配合物,例
能形成多种配合物,例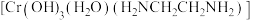 。
。
①该配合物中 的配位数为
的配位数为________ 。
②上述配合物中的非金属元素按电负性由小到大的顺序排列为________ 。
(3)FeCO3是菱铁矿的主要成分,其中C原子的杂化方式为________ ;分子中的大π键可用符号 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为 ),则
),则 中的大π键应表示为
中的大π键应表示为________ 。
(4)Co(NH3)5Cl3是钴的一种配合物,向含0.01 mol该配合物的溶液中加入足量AgNO3溶液,生成白色沉淀2.87 g,则该配合物的化学式为________________ 。
(5)镍与CO形成的一种配合物Ni(CO)x ,中心原子的价电子数和配体提供的孤电子数目之和为18,则X=________ ,1mol该配合物所含配位键的数目为_____ 。
 、钨
、钨 都是重要的过渡元素,它们的单质和化合物在生活、生产中有广泛应用。
都是重要的过渡元素,它们的单质和化合物在生活、生产中有广泛应用。(1)基态铬原子核外价电子排布图为
(2)铬离子
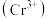 能形成多种配合物,例
能形成多种配合物,例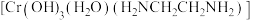 。
。①该配合物中
 的配位数为
的配位数为②上述配合物中的非金属元素按电负性由小到大的顺序排列为
(3)FeCO3是菱铁矿的主要成分,其中C原子的杂化方式为
 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为 ),则
),则 中的大π键应表示为
中的大π键应表示为(4)Co(NH3)5Cl3是钴的一种配合物,向含0.01 mol该配合物的溶液中加入足量AgNO3溶液,生成白色沉淀2.87 g,则该配合物的化学式为
(5)镍与CO形成的一种配合物Ni(CO)x ,中心原子的价电子数和配体提供的孤电子数目之和为18,则X=
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
【推荐1】储氢材料是一类能可逆地吸收和释放氢气的材料,回答下列问题。
(1) 是一种储氢材料,由
是一种储氢材料,由 和
和 反应制得。基态
反应制得。基态 原子的价电子排布式为
原子的价电子排布式为____ , 的空间结构是
的空间结构是______ 。
(2)氨硼烷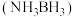 含氢量高,热稳定性好,是一种具有潜力的固体储氢材料。在四氢呋喃(
含氢量高,热稳定性好,是一种具有潜力的固体储氢材料。在四氢呋喃( )作溶剂的条件下可合成氨硼烷:
)作溶剂的条件下可合成氨硼烷: 。
。
① 分子中存在配位键,提供空轨道的原子是
分子中存在配位键,提供空轨道的原子是____ 。分子中与 原子相连的
原子相连的 呈正电性
呈正电性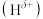 ,与
,与 相连的
相连的 呈负电性
呈负电性 。在
。在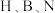 三种元素中,电负性由大到小的顺序是
三种元素中,电负性由大到小的顺序是_____ 。
②常温下,四氢呋喃易溶于水,环戊烷难溶于水,其原因可能是__________ 。
③氨硼烷在催化剂作用下水解并释放氢气: 的结构如图所示,该反应中
的结构如图所示,该反应中 原子的杂化轨道类型由
原子的杂化轨道类型由_________ 变为__________ 。

(3)过渡金属 与镧形成的合金是一种储氢材料,其中基态
与镧形成的合金是一种储氢材料,其中基态 原子的价电子排布式为
原子的价电子排布式为 ,该合金的晶胞结构和
,该合金的晶胞结构和 轴方向的投影图如图所示:
轴方向的投影图如图所示:

①若阿伏加德罗常数的值为 ,则该合金的密度为
,则该合金的密度为__________  (用含
(用含 的代数式表示,列出计算式即可)。
的代数式表示,列出计算式即可)。
②储氢原理:该合金吸附 ,
, 解离为原子,
解离为原子, 原子储存在其中形成化合物。若储氢后,氢原子占据晶胞上下底面的棱心和面心,则形成的储氢化合物的化学式为
原子储存在其中形成化合物。若储氢后,氢原子占据晶胞上下底面的棱心和面心,则形成的储氢化合物的化学式为_________________ 。
(1)
 是一种储氢材料,由
是一种储氢材料,由 和
和 反应制得。基态
反应制得。基态 原子的价电子排布式为
原子的价电子排布式为 的空间结构是
的空间结构是(2)氨硼烷
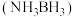 含氢量高,热稳定性好,是一种具有潜力的固体储氢材料。在四氢呋喃(
含氢量高,热稳定性好,是一种具有潜力的固体储氢材料。在四氢呋喃( )作溶剂的条件下可合成氨硼烷:
)作溶剂的条件下可合成氨硼烷: 。
。①
 分子中存在配位键,提供空轨道的原子是
分子中存在配位键,提供空轨道的原子是 原子相连的
原子相连的 呈正电性
呈正电性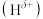 ,与
,与 相连的
相连的 呈负电性
呈负电性 。在
。在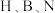 三种元素中,电负性由大到小的顺序是
三种元素中,电负性由大到小的顺序是②常温下,四氢呋喃易溶于水,环戊烷难溶于水,其原因可能是
③氨硼烷在催化剂作用下水解并释放氢气:
 的结构如图所示,该反应中
的结构如图所示,该反应中 原子的杂化轨道类型由
原子的杂化轨道类型由
(3)过渡金属
 与镧形成的合金是一种储氢材料,其中基态
与镧形成的合金是一种储氢材料,其中基态 原子的价电子排布式为
原子的价电子排布式为 ,该合金的晶胞结构和
,该合金的晶胞结构和 轴方向的投影图如图所示:
轴方向的投影图如图所示:
①若阿伏加德罗常数的值为
 ,则该合金的密度为
,则该合金的密度为 (用含
(用含 的代数式表示,列出计算式即可)。
的代数式表示,列出计算式即可)。②储氢原理:该合金吸附
 ,
, 解离为原子,
解离为原子, 原子储存在其中形成化合物。若储氢后,氢原子占据晶胞上下底面的棱心和面心,则形成的储氢化合物的化学式为
原子储存在其中形成化合物。若储氢后,氢原子占据晶胞上下底面的棱心和面心,则形成的储氢化合物的化学式为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐2】铁及其化合物在生活中用途广泛,绿矾(FeSO4·7H2O)是一种常见的中草药成分,失水后可转为FeSO4·H2O,与FeS2可联合制备铁粉精(FexOy)和H2SO4。
i.FeSO4·H2O结构如图所示:

(1)Fe2+价层电子排布式为_______ 。
(2)比较 和
和 分子中的键角大小并给出相应解释:
分子中的键角大小并给出相应解释:_______ 。
(3) 与
与 和
和 的作用分别为
的作用分别为_______ 。
ii.实验室以 FeCl2溶液为原料制备高密度磁记录材料 Fe/Fe3O4复合物。
(4)在氩气气氛下,向装有50mL1mol•L−1FeCl2溶液的三颈烧瓶(装置如图)中逐滴加入 100mL14 mol∙L−1KOH溶液,用磁力搅拌器持续搅拌,在100℃下回流3h,得到成分为Fe和Fe3O4的黑色沉淀。

①三颈烧瓶发生反应的离子方程式为_______ 。
②检验反应是否进行完全的操作是_______ 。
(5)待三颈烧瓶中的混合物冷却后,过滤,再依次用沸水和乙醇洗涤,在40℃干燥后焙烧3h,得到Fe/Fe3O4复合物产品 3.24g。
①焙烧需在隔绝空气条件下进行,原因是_______ 。
②计算实验所得产品的产率_______ (写出计算过程)。
(6)以FeCl2溶液为原料还可制备软磁性材料α−Fe2O3。已知:Fe(OH)2开始沉淀的pH=6.5。请补充完整实验方案:在搅拌下_______ ,将固体干燥,得到纯净的 FeCO3,将其放入管式炉内煅烧 2h,获得产品α−Fe2O3 (可选用的试剂:氨水−NH4HCO3混合溶液、2mol•L−1盐酸、2mol•L−1硝酸、AgNO3溶液、蒸馏水)。
i.FeSO4·H2O结构如图所示:

(1)Fe2+价层电子排布式为
(2)比较
 和
和 分子中的键角大小并给出相应解释:
分子中的键角大小并给出相应解释:(3)
 与
与 和
和 的作用分别为
的作用分别为ii.实验室以 FeCl2溶液为原料制备高密度磁记录材料 Fe/Fe3O4复合物。
(4)在氩气气氛下,向装有50mL1mol•L−1FeCl2溶液的三颈烧瓶(装置如图)中逐滴加入 100mL14 mol∙L−1KOH溶液,用磁力搅拌器持续搅拌,在100℃下回流3h,得到成分为Fe和Fe3O4的黑色沉淀。

①三颈烧瓶发生反应的离子方程式为
②检验反应是否进行完全的操作是
(5)待三颈烧瓶中的混合物冷却后,过滤,再依次用沸水和乙醇洗涤,在40℃干燥后焙烧3h,得到Fe/Fe3O4复合物产品 3.24g。
①焙烧需在隔绝空气条件下进行,原因是
②计算实验所得产品的产率
(6)以FeCl2溶液为原料还可制备软磁性材料α−Fe2O3。已知:Fe(OH)2开始沉淀的pH=6.5。请补充完整实验方案:在搅拌下
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
【推荐3】卤素钙钛矿已经被广泛应用于太阳能电池、发光二极体等领域,其中合成二维/三维(2D/3D)的钙钛矿异质结是提升器件稳定性和转换效率的一个策略,近期化学工作者在气相合成的单晶三维钙钛矿CsPbBr3上合成外延生长的水平和垂直的二维钙钛矿(PEA)2PbBr4(PEA+代表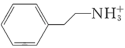 )异质结。回答下列问题:
)异质结。回答下列问题:
(1)已知铅卤化合物中存在正四面体构型的[PbCl4]2-、[PbBr4]2-、[PbI4]2-,已知[Pb2I6]2-中每个Pb均采用四配位模式,则[Pb2I6]2-的结构式为_______ 。
(2)Br2和碱金属单质形成的MBr熔点如表:
等量NaBr、KBr、RbBr、CsBr同时开始加热优先导电的是_______ (填化学式),熔点呈现表中趋势的原因是_______ 。
(3)已知三维立方钙钛矿CsPbBr3中三种离子在晶胞(a)中占据正方体顶点、面心、体心位置,图(b)显示的是三种离子在xz面、yz面、xy面上的位置:
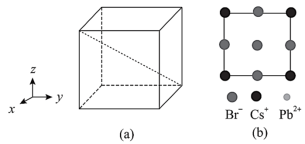
①若晶胞边长为apm,阿伏加德罗常数的值为NA,晶体的密度为_______ g·cm-3 (写出表达式)。
②上述晶胞沿体对角线方向的投影图为_______ (填标号)。
A B.
B.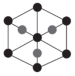 C.
C.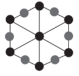 D.
D.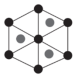
 )异质结。回答下列问题:
)异质结。回答下列问题:(1)已知铅卤化合物中存在正四面体构型的[PbCl4]2-、[PbBr4]2-、[PbI4]2-,已知[Pb2I6]2-中每个Pb均采用四配位模式,则[Pb2I6]2-的结构式为
(2)Br2和碱金属单质形成的MBr熔点如表:
| MBr | NaBr | KBr | RbBr | CsBr |
| 熔点/℃ | 747 | 734 | 693 | 636 |
(3)已知三维立方钙钛矿CsPbBr3中三种离子在晶胞(a)中占据正方体顶点、面心、体心位置,图(b)显示的是三种离子在xz面、yz面、xy面上的位置:

①若晶胞边长为apm,阿伏加德罗常数的值为NA,晶体的密度为
②上述晶胞沿体对角线方向的投影图为
A
 B.
B. C.
C. D.
D.
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐1】我国科学家研发的全球首套千吨级太阳能燃料合成项目,为实现“碳中和”目标作出了重大贡献。该项目通过太阳能发电电解水制氢,再采用高选择性催化剂将二氧化碳加氢合成甲醇。
(1)钙钛矿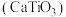 型化合物是一类可用于生产太阳能电池的功能材料,
型化合物是一类可用于生产太阳能电池的功能材料, 的晶胞如图所示。
的晶胞如图所示。

①基态 原子的核外电子排布式为
原子的核外电子排布式为_______ 。
② 组成元素的电负性大小顺序是
组成元素的电负性大小顺序是_______ ; 的配位数是
的配位数是_______ 。
(2)单晶硅是生产太阳能电池板的主要原料, 是生产单晶硅的前驱体,可发生水解反应,机理如图:
是生产单晶硅的前驱体,可发生水解反应,机理如图:

注:含s、p、d轨道的杂化类型有: 、
、 、
、 。
。
在 水解为中间体
水解为中间体 的过程中,
的过程中, 原子的杂化类型由
原子的杂化类型由_______ 变为_______ 。
(3)甲醇的沸点 介于水
介于水 和甲硫醇
和甲硫醇 之间,其原因是
之间,其原因是_______ 。
(4)我国科学家发明了高选择性的二氧化碳加氢合成甲醇的催化剂,其组成为 固溶体。在
固溶体。在 中掺杂少量
中掺杂少量 后形成的催化剂,化学式可表示为
后形成的催化剂,化学式可表示为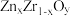 ,则
,则
_______ (用含x的表达式)。
(1)钙钛矿
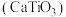 型化合物是一类可用于生产太阳能电池的功能材料,
型化合物是一类可用于生产太阳能电池的功能材料, 的晶胞如图所示。
的晶胞如图所示。
①基态
 原子的核外电子排布式为
原子的核外电子排布式为②
 组成元素的电负性大小顺序是
组成元素的电负性大小顺序是 的配位数是
的配位数是(2)单晶硅是生产太阳能电池板的主要原料,
 是生产单晶硅的前驱体,可发生水解反应,机理如图:
是生产单晶硅的前驱体,可发生水解反应,机理如图:
注:含s、p、d轨道的杂化类型有:
 、
、 、
、 。
。在
 水解为中间体
水解为中间体 的过程中,
的过程中, 原子的杂化类型由
原子的杂化类型由(3)甲醇的沸点
 介于水
介于水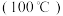 和甲硫醇
和甲硫醇 之间,其原因是
之间,其原因是(4)我国科学家发明了高选择性的二氧化碳加氢合成甲醇的催化剂,其组成为
 固溶体。在
固溶体。在 中掺杂少量
中掺杂少量 后形成的催化剂,化学式可表示为
后形成的催化剂,化学式可表示为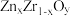 ,则
,则
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
【推荐2】(1) 在水中的溶解度是常见气体中最大的。下列因素与
在水中的溶解度是常见气体中最大的。下列因素与 的水溶性没有关系的是
的水溶性没有关系的是___________ (填序号)。
a. 和
和 都是极性分子
都是极性分子
b. 在水中易形成氢键
在水中易形成氢键
c. 溶于水建立了如下平衡:
溶于水建立了如下平衡: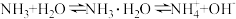
d. 是一种易液化的气体
是一种易液化的气体
(2)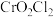 常温下为深红色液体,能与
常温下为深红色液体,能与 、
、 等互溶,据此可判断
等互溶,据此可判断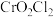 是
是___________ (填“极性”或“非极性”)分子。
(3)在①苯、② 、③HCHO、④
、③HCHO、④ 、⑤
、⑤ 五种有机溶剂中,碳原子采取
五种有机溶剂中,碳原子采取 杂化的分子有
杂化的分子有___________ (填序号), 分子的空间结构是
分子的空间结构是___________ 。 与
与 相比,
相比,___________ 的熔点较高。
(4)甲醛、甲醇和甲酸等碳原子个数较少的醛、醇和羧酸均易溶于水的原因是___________ 。
 在水中的溶解度是常见气体中最大的。下列因素与
在水中的溶解度是常见气体中最大的。下列因素与 的水溶性没有关系的是
的水溶性没有关系的是a.
 和
和 都是极性分子
都是极性分子b.
 在水中易形成氢键
在水中易形成氢键c.
 溶于水建立了如下平衡:
溶于水建立了如下平衡: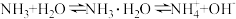
d.
 是一种易液化的气体
是一种易液化的气体(2)
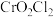 常温下为深红色液体,能与
常温下为深红色液体,能与 、
、 等互溶,据此可判断
等互溶,据此可判断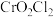 是
是(3)在①苯、②
 、③HCHO、④
、③HCHO、④ 、⑤
、⑤ 五种有机溶剂中,碳原子采取
五种有机溶剂中,碳原子采取 杂化的分子有
杂化的分子有 分子的空间结构是
分子的空间结构是 与
与 相比,
相比,(4)甲醛、甲醇和甲酸等碳原子个数较少的醛、醇和羧酸均易溶于水的原因是
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
【推荐3】现有原子序数依次递增且都小于36的X、Y、Z、Q、W五种元素,其中X是原子半径最小的元素,Y原子在基态时其最外层电子数是其内层电子数的2倍,Q原子在基态时其2p能级上有2个未成对电子,W元素的原子中3d能级上有4个未成对电子。回答下列问题:
(1)化合物 的沸点比化合物
的沸点比化合物 的高,其主要原因是
的高,其主要原因是___________ 。
(2)元素W能形成多种配合物,如: 等。
等。
①基态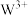 的M层电子排布式为
的M层电子排布式为___________ 。其单质在熔融时要破坏___________ 。
② 在常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断
在常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断 晶体属于
晶体属于___________ (填晶体类型)晶体,该晶体中W的化合价为___________ 。
(3)Q和Na形成的一种只含有离子键的离子化合物的晶胞结构如图所示,与一个阴离子距离最近且相等的所有阳离子为顶点构成的几何体为___________ 。每个阳离子周围距离最近的阳离子个数为___________ 。已知该晶体的密度为ρg/m3,阿伏加德罗常数的值为 ,则晶胞边长为
,则晶胞边长为___________ cm。(用含 的代数式表示)
的代数式表示)
(1)化合物
 的沸点比化合物
的沸点比化合物 的高,其主要原因是
的高,其主要原因是(2)元素W能形成多种配合物,如:
 等。
等。①基态
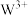 的M层电子排布式为
的M层电子排布式为②
 在常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断
在常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断 晶体属于
晶体属于(3)Q和Na形成的一种只含有离子键的离子化合物的晶胞结构如图所示,与一个阴离子距离最近且相等的所有阳离子为顶点构成的几何体为
 ,则晶胞边长为
,则晶胞边长为 的代数式表示)
的代数式表示)
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
解题方法
【推荐1】A、B、C、D、E代表前四周期原子序数依次增大的五种元素。A、D同主族且有两种常见化合物DA2和DA3;工业上电解熔融C2A3制取单质C;B、E除最外层均只有2个电子外,其余各层全充满,E位于元素周期表的ds区。回答下列问题:
(1)B、C中第一电离能较大的是______ ,基态D原子价电子的轨道表达式为______ 。
(2)DA2分子的VSEPR模型是______ 。H2A比H2D熔、沸点高得多的原因是 ______ 。
(3)实验测得C与氯元素形成化合物的实际组成为C2Cl6,其球棍模型如图所示。已知C2Cl6在加热时易升华,与过量的NaOH溶液反应可生成Na[C(OH)4]。

① C2Cl6属于_____ 晶体(填晶体类型),其中C原子的杂化轨道类型为_____ 杂化。
② [C(OH)4]-中存在的化学键有___________ 。
(4)工业上制备B的单质是电解熔融B的氯化物,而不是电解BA,原因是________ 。
(5)B、C的氟化物晶格能分别是2957 kJ·molˉ1、5492 kJ·molˉ1,二者相差很大的原因是_______
(6)D与E所形成化合物晶体的晶胞如图所示。在该晶胞中,E的配位数为___________ 。

(1)B、C中第一电离能较大的是
(2)DA2分子的VSEPR模型是
(3)实验测得C与氯元素形成化合物的实际组成为C2Cl6,其球棍模型如图所示。已知C2Cl6在加热时易升华,与过量的NaOH溶液反应可生成Na[C(OH)4]。

① C2Cl6属于
② [C(OH)4]-中存在的化学键有
(4)工业上制备B的单质是电解熔融B的氯化物,而不是电解BA,原因是
(5)B、C的氟化物晶格能分别是2957 kJ·molˉ1、5492 kJ·molˉ1,二者相差很大的原因是
(6)D与E所形成化合物晶体的晶胞如图所示。在该晶胞中,E的配位数为

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐2】铁单质及其离子可以形成多种配合物,例如:Fe(CO)5Fe(SCN)3Fe3[Fe(CN)6]2等,回答下列问题:
(1)Fe原子价电子排布式为_______ ,Fe位于元素周期表的_______ 区。
(2)Fe(CO)5为无色至黄色油状液体。易溶于四氯化碳,二硫化碳等大多数有机溶剂,Fe(CO)5是_______ 晶体,Fe与CO之间的化学键称为_______ ,提供孤对电子的成键原子是_______
(3)在Fe(SCN)3中,Fe、N、S第一电离能从大到小的顺序是_______ ,SCN-离子中C原子为_______ 杂化。S、C、N三种元素形成的简单气态氢化物中沸点由大到小的顺序是_______ ,铁离子的稳定性强于亚铁离子的原因是_______ 。
铁存在三种类型的晶胞

(4)①体心立方的空间利用率_______ ;
②计算三种晶体的密度之比为_______ 。
(1)Fe原子价电子排布式为
(2)Fe(CO)5为无色至黄色油状液体。易溶于四氯化碳,二硫化碳等大多数有机溶剂,Fe(CO)5是
(3)在Fe(SCN)3中,Fe、N、S第一电离能从大到小的顺序是
铁存在三种类型的晶胞

(4)①体心立方的空间利用率
②计算三种晶体的密度之比为
您最近一年使用:0次
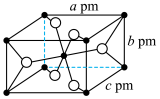
【推荐3】铁及其化合物在生产生活及科研中应用广泛。
(1)聚合硫酸铁的化学式为 ,是常用的水处理剂。基态铁原子的核外电子排布式为
,是常用的水处理剂。基态铁原子的核外电子排布式为_____ ,聚合硫酸铁中铁元素阳离子有_____ 个未成对电子。
(2)Fe3+、Co3+与 、CN-等可形成络合离子。
、CN-等可形成络合离子。
① 可用于检验Fe2+,配体CN-中碳原子杂化轨道类型为
可用于检验Fe2+,配体CN-中碳原子杂化轨道类型为______ ,1mol 中含有σ键的数目为
中含有σ键的数目为________ 。
② 中Co的配位数为
中Co的配位数为______ ,C、N、O的第一电离能最大的为_____ ,其原因是_____ 。
③已知 与CS2为等电子体,则
与CS2为等电子体,则 的空间构型为
的空间构型为______ 。
(3)化合物FeF3熔点高于1000℃,而Fe(CO)5的熔点却低于0℃,FeF3熔点远高于Fe(CO)5的可能原因是_______ 。
(4)氟化亚铁晶胞属于四方晶系,其长方体结构如图所示,根据图中所示数据计算该晶体密度ρ=_____ g·cm-3(列出计算式即可)。
(1)聚合硫酸铁的化学式为
 ,是常用的水处理剂。基态铁原子的核外电子排布式为
,是常用的水处理剂。基态铁原子的核外电子排布式为(2)Fe3+、Co3+与
 、CN-等可形成络合离子。
、CN-等可形成络合离子。①
 可用于检验Fe2+,配体CN-中碳原子杂化轨道类型为
可用于检验Fe2+,配体CN-中碳原子杂化轨道类型为 中含有σ键的数目为
中含有σ键的数目为②
 中Co的配位数为
中Co的配位数为③已知
 与CS2为等电子体,则
与CS2为等电子体,则 的空间构型为
的空间构型为(3)化合物FeF3熔点高于1000℃,而Fe(CO)5的熔点却低于0℃,FeF3熔点远高于Fe(CO)5的可能原因是
(4)氟化亚铁晶胞属于四方晶系,其长方体结构如图所示,根据图中所示数据计算该晶体密度ρ=

您最近一年使用:0次



