把0.4molX气体的0.3molY气体混合于2L容器中,使它们发生如下反应:3X(g)+Y(g) nZ(g)+2W(g)。5min后达平衡生成0.2molW,若测知
nZ(g)+2W(g)。5min后达平衡生成0.2molW,若测知 ,则
,则
(1)上述反应中Z气体的化学计量数n的值是_________ 。
(2)X的转化率为_________ ?
(3)平衡时Y的体积分数为_________ ?
(4)反应的平衡常数K=_________ ?
 nZ(g)+2W(g)。5min后达平衡生成0.2molW,若测知
nZ(g)+2W(g)。5min后达平衡生成0.2molW,若测知 ,则
,则(1)上述反应中Z气体的化学计量数n的值是
(2)X的转化率为
(3)平衡时Y的体积分数为
(4)反应的平衡常数K=
21-22高二上·陕西西安·期中 查看更多[3]
更新时间:2022-12-05 08:52:06
|
相似题推荐
填空题
|
较易
(0.85)
解题方法
【推荐1】t℃时,将3molA和1molB气体通入体积为2L的密闭容器中(容积不变),发生如下反应:3A(g)+B(g)⇌xC(g),△H<0;在2min时反应达到平衡状态(温度不变)剩余0.8molB,并测得C的浓度为0.4mol·L-1,请填写下列空白:
(1)从开始反应至达到平衡状态,B的平均反应速率为_______ ,A的平衡浓度为_______ mol/L。
(2)x=_______ ,平衡常数K=_______ 。(列出计算式不用计算出结果)
(3)若继续向原平衡混合物的容器中通入少量氦气(假设氦气和A、B、C都不反应)后,化学平衡(填字母)_______ 。
A.向正反应方向移动 B.向逆反应方向移动 C.不移动
(1)从开始反应至达到平衡状态,B的平均反应速率为
(2)x=
(3)若继续向原平衡混合物的容器中通入少量氦气(假设氦气和A、B、C都不反应)后,化学平衡(填字母)
A.向正反应方向移动 B.向逆反应方向移动 C.不移动
您最近一年使用:0次
填空题
|
较易
(0.85)
名校
【推荐2】CO、CO2、CH3OH等一碳物质是重要的基础化工原料。回答下列问题:
(1)CH3OH(l)气化时吸收的热量为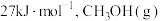 的燃烧热为
的燃烧热为 ,写出CH3OH(l)完全燃烧的热化学方程式:
,写出CH3OH(l)完全燃烧的热化学方程式:___________ 。
(2)甲醇水蒸气重整的热化学方程式为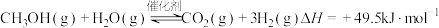 。已知不同温度下相关反应的
。已知不同温度下相关反应的 (用平衡分压代替平衡浓度计算得到的平衡常数)如下表所示。
(用平衡分压代替平衡浓度计算得到的平衡常数)如下表所示。
根据表计算398K时,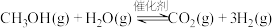 的
的
___________ 。利用该反应产生的H2可设计以H2为燃料、熔融Li2CO3与K2CO3混合物为电解质的高温型燃料电池,写出该电池负极的电极反应式:___________ 。
(3)利用CO、CH3OH等原料可合成草酸二甲酯( ),其加氢可转化为乙二醇(HOCH2CH2OH),制备草酸二甲酯的总反应为4CO+4CH3OH+O2
),其加氢可转化为乙二醇(HOCH2CH2OH),制备草酸二甲酯的总反应为4CO+4CH3OH+O2
 +2H2O
+2H2O
,其反应机理的一部分如图所示。
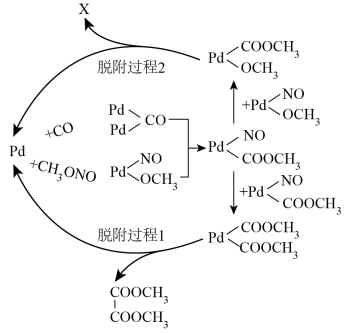
①由机理图可推知,化合物X的结构简式为___________ 。
②若CO中混有少量H2,H2在Pd表面易形成Pd—H中间体,结合机理图,推测因H2导致生成的有机副产物是___________ (任写一种)。
(4)草酸二甲酯催化加氢制乙二醇的反应体系中,发生的主要反应如下:
反应Ⅰ: ;
;
反应Ⅱ: ;
;
一定压强下,将(COOCH3)2、H2按一定比例、流速通过装有催化剂的反应管,测得(COOCH3)2的转化率及CH3OOCCH2OH、HOCH2CH2OH的选择性{ }与温度的关系如图所示。
}与温度的关系如图所示。
①表示HOCH2CH2OH的选择性随温度变化的曲线是___________ ,理由为___________ 。
②194℃时,其他条件一定,若加快气体的流速,则(COOCH3)2的转化率降低,其原因是___________ 。

(1)CH3OH(l)气化时吸收的热量为
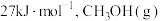 的燃烧热为
的燃烧热为 ,写出CH3OH(l)完全燃烧的热化学方程式:
,写出CH3OH(l)完全燃烧的热化学方程式:(2)甲醇水蒸气重整的热化学方程式为
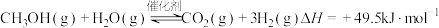 。已知不同温度下相关反应的
。已知不同温度下相关反应的 (用平衡分压代替平衡浓度计算得到的平衡常数)如下表所示。
(用平衡分压代替平衡浓度计算得到的平衡常数)如下表所示。| 相关反应 | 398K | 498K | 598K | 698K |
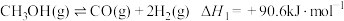 | 5.0 | 185.8 | 9939.5 | 1.8×105 |
 | 157.5 | 137.5 | 28.14 | 9.339 |
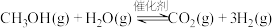 的
的
(3)利用CO、CH3OH等原料可合成草酸二甲酯(
 ),其加氢可转化为乙二醇(HOCH2CH2OH),制备草酸二甲酯的总反应为4CO+4CH3OH+O2
),其加氢可转化为乙二醇(HOCH2CH2OH),制备草酸二甲酯的总反应为4CO+4CH3OH+O2
 +2H2O
+2H2O ,其反应机理的一部分如图所示。

①由机理图可推知,化合物X的结构简式为
②若CO中混有少量H2,H2在Pd表面易形成Pd—H中间体,结合机理图,推测因H2导致生成的有机副产物是
(4)草酸二甲酯催化加氢制乙二醇的反应体系中,发生的主要反应如下:
反应Ⅰ:
 ;
;反应Ⅱ:
 ;
;一定压强下,将(COOCH3)2、H2按一定比例、流速通过装有催化剂的反应管,测得(COOCH3)2的转化率及CH3OOCCH2OH、HOCH2CH2OH的选择性{
 }与温度的关系如图所示。
}与温度的关系如图所示。①表示HOCH2CH2OH的选择性随温度变化的曲线是
②194℃时,其他条件一定,若加快气体的流速,则(COOCH3)2的转化率降低,其原因是

您最近一年使用:0次
填空题
|
较易
(0.85)
名校
解题方法
【推荐3】(1).用合成气生成甲醇的反应:CO(g)+2H2(g)  CH3OH(g) ΔH,在10 L恒容密闭容器中按物质的量之比1∶2充入CO和H2,测得CO的平衡转化率与温度和压强的关系如下图所示,200 ℃时n(H2)随时间的变化如下表所示:
CH3OH(g) ΔH,在10 L恒容密闭容器中按物质的量之比1∶2充入CO和H2,测得CO的平衡转化率与温度和压强的关系如下图所示,200 ℃时n(H2)随时间的变化如下表所示:
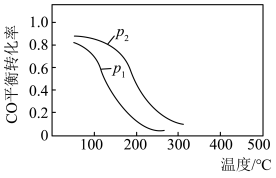
①ΔH________ (填“>”“<”或“= ”)0。
②写出一条可同时提高反应速率和CO转化率的措施:________________________ 。
③下列说法正确的是________ (填字母)。
a.温度越高,该反应的平衡常数越大
b.达平衡后再充入稀有气体,CO的转化率提高
c.容器内气体压强不再变化时,反应达到最大限度
d.图中压强p1<p2
④0~3 min内用CH3OH表示的反应速率v(CH3OH)=__________________ 。
⑤ 200 ℃时,该反应的平衡常数K=________ 。向上述200 ℃达到平衡的恒容密闭容器中再加入2 mol CO、2 mol H2、2 mol CH3OH,保持温度不变,则化学平衡________ (填“正向”“逆向”或“不”)移动。
 CH3OH(g) ΔH,在10 L恒容密闭容器中按物质的量之比1∶2充入CO和H2,测得CO的平衡转化率与温度和压强的关系如下图所示,200 ℃时n(H2)随时间的变化如下表所示:
CH3OH(g) ΔH,在10 L恒容密闭容器中按物质的量之比1∶2充入CO和H2,测得CO的平衡转化率与温度和压强的关系如下图所示,200 ℃时n(H2)随时间的变化如下表所示:
| t/min | 0 | 1 | 3 | 5 |
| n(H2)/mol | 8.0 | 5.4 | 4.0 | 4.0 |
①ΔH
②写出一条可同时提高反应速率和CO转化率的措施:
③下列说法正确的是
a.温度越高,该反应的平衡常数越大
b.达平衡后再充入稀有气体,CO的转化率提高
c.容器内气体压强不再变化时,反应达到最大限度
d.图中压强p1<p2
④0~3 min内用CH3OH表示的反应速率v(CH3OH)=
⑤ 200 ℃时,该反应的平衡常数K=
您最近一年使用:0次
填空题
|
较易
(0.85)
名校
解题方法
【推荐1】CH3OH也可由CO2和H2合成。在体积为1L的密闭容器中,充入lmolCO2和3molH2,一定条件下反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g),测得CO2和CH3OH(g)浓度随时间变化如图所示:
CH3OH(g)+H2O(g),测得CO2和CH3OH(g)浓度随时间变化如图所示:___________ mol/(L·min)。
(2)10min时,CH3OH的物质的量为___________ mol,10min内,以H2表示的化学反应速率是___________ mol/(L·min)。
(3)到达平衡时,CO2的转化率为___________ 。
(4)3min时,v(正)___________ v(逆)(填“大于”、“等于”、“小于”),此时化学反应朝___________ 进行(填“正方向”或“逆方向”)。
 CH3OH(g)+H2O(g),测得CO2和CH3OH(g)浓度随时间变化如图所示:
CH3OH(g)+H2O(g),测得CO2和CH3OH(g)浓度随时间变化如图所示:
(2)10min时,CH3OH的物质的量为
(3)到达平衡时,CO2的转化率为
(4)3min时,v(正)
您最近一年使用:0次
【推荐2】I.将 、
、 和
和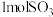 在恒温恒容的密闭容器中发生:
在恒温恒容的密闭容器中发生: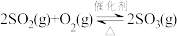 反应。
反应。
(1)下列说明反应达到平衡状态的是_______ (填序号)。
①气体密度不变;
②混合气体的总物质的量不变;
③混合气体的平均相对分子质量不变;
④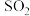 和
和 的物质的量之比不变;
的物质的量之比不变;
⑤消耗的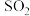 与消耗
与消耗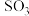 的速率相等;
的速率相等;
⑥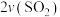 消耗=
消耗=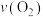 生成;
生成;
(2)达到平衡时,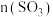 的取值范围
的取值范围_______ 。
II.碘及其化合物在生产生活中有重要作用。将0.4mol氢气和0.2mol碘蒸气放入2L密闭容器中进行反应: ,反应经过5min测得碘化氢的浓度为
,反应经过5min测得碘化氢的浓度为 ,碘蒸气的浓度为
,碘蒸气的浓度为
(3)前5min平均反应速率
_______ 。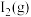 的转化率为
的转化率为_______ 。
(4)生成的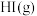 的体积分数为
的体积分数为_______ (保留三位有效数字)。
 、
、 和
和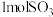 在恒温恒容的密闭容器中发生:
在恒温恒容的密闭容器中发生: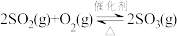 反应。
反应。(1)下列说明反应达到平衡状态的是
①气体密度不变;
②混合气体的总物质的量不变;
③混合气体的平均相对分子质量不变;
④
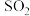 和
和 的物质的量之比不变;
的物质的量之比不变;⑤消耗的
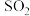 与消耗
与消耗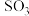 的速率相等;
的速率相等;⑥
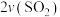 消耗=
消耗=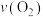 生成;
生成;(2)达到平衡时,
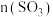 的取值范围
的取值范围II.碘及其化合物在生产生活中有重要作用。将0.4mol氢气和0.2mol碘蒸气放入2L密闭容器中进行反应:
 ,反应经过5min测得碘化氢的浓度为
,反应经过5min测得碘化氢的浓度为 ,碘蒸气的浓度为
,碘蒸气的浓度为
(3)前5min平均反应速率

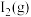 的转化率为
的转化率为(4)生成的
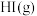 的体积分数为
的体积分数为
您最近一年使用:0次
填空题
|
较易
(0.85)
【推荐3】短周期主族元素X、Y、Z的原子序数依次增大,X的某种同位素不含中子,Y与Z同族,Z的原子序数是Y的两倍,l、m、p分别为元素X、Y、Z对应的单质,r、s、t、u、v为X、Y、Z形成的二元或三元化合物,这些物质有如下图所示转化关系(反应条件及部分产物已略去),回答下列问题:
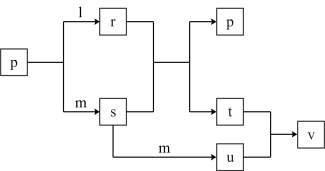
(1)r具有_________ 气味, r与s生成p和t的化学方程式为__________ 。
(2)r______ (填“能”或“不能”)用v的浓溶液干燥,用化学方程式解释其原因_________ 。
(3)用r、空气和KOH溶液可以组成燃料电池,生成Z元素的+4价含氧酸正盐和水。电池工作时负极反应为_________ (用离子方程式表示)。
(4)将10 mol s、5 mol m充入10 L的恒容密闭容器,在500 K条件下生成u气体,平衡时,反应物与生成物的物质的量相等,则s的平衡转化率为_________ ,该反应的平衡常数为___________ 。

(1)r具有
(2)r
(3)用r、空气和KOH溶液可以组成燃料电池,生成Z元素的+4价含氧酸正盐和水。电池工作时负极反应为
(4)将10 mol s、5 mol m充入10 L的恒容密闭容器,在500 K条件下生成u气体,平衡时,反应物与生成物的物质的量相等,则s的平衡转化率为
您最近一年使用:0次



