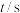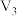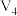Ⅰ.将气体A、B置于固定容积为4L的密闭容器中,发生如下反应:2A(g)+B(g) C(g)+2D(g),反应进行20s后达到平衡,测得平衡时A的物质的量为0.16mol,B的物质的量为0.06mol,C的物质的量为0.04mol,请计算并回答:
C(g)+2D(g),反应进行20s后达到平衡,测得平衡时A的物质的量为0.16mol,B的物质的量为0.06mol,C的物质的量为0.04mol,请计算并回答:
(1)用生成物C表示20s内的平均反应速率为_________________ mol/(L·s)。
(2)反应前A的物质的量浓度是________________ mol/L。
(3)反应达平衡时,B的转化率为________________ 。
(4)若改变下列条件,D的生成速率如何变化(用“增大”或“减小”或“不变”填空)。
Ⅱ.氢能源是绿色燃料,可以减少汽车尾气的排放,利用甲醇与水蒸气反应可以制备氢气:CH3OH(g)+H2O(g)=CO2(g)+3H2(g) ∆H1,如图是该反应的能量变化图:
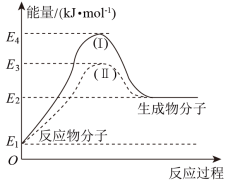
(5)通过图中信息可判断反应CH3OH(g)+H2O(g)=CO2(g)+3H2(g)的∆H1___________ (选填“>”“=”或“<”)0
(6)图中途径(Ⅱ)使用了催化剂。则途径(Ⅱ)的活化能___________ (选填“>”“=”或“<”)途径(Ⅰ)的活化能。
(7)已知下列两个热化学方程式:2CH3OH(g)+3O2(g)=2CO2(g)+4H2O(g) ∆H2
H2(g)+ O2(g)=H2O(g) ∆H3
O2(g)=H2O(g) ∆H3
则∆H2=___________ (用∆H1和∆H3的代数式表达)
 C(g)+2D(g),反应进行20s后达到平衡,测得平衡时A的物质的量为0.16mol,B的物质的量为0.06mol,C的物质的量为0.04mol,请计算并回答:
C(g)+2D(g),反应进行20s后达到平衡,测得平衡时A的物质的量为0.16mol,B的物质的量为0.06mol,C的物质的量为0.04mol,请计算并回答:(1)用生成物C表示20s内的平均反应速率为
(2)反应前A的物质的量浓度是
(3)反应达平衡时,B的转化率为
(4)若改变下列条件,D的生成速率如何变化(用“增大”或“减小”或“不变”填空)。
| 编号 | 改变的条件 | D的生成速率 |
| ① | 降低体系温度 | |
| ② | 恒容下补充A气体 | |
| ③ | 恒容下充入Ne(不参与体系反应) |
Ⅱ.氢能源是绿色燃料,可以减少汽车尾气的排放,利用甲醇与水蒸气反应可以制备氢气:CH3OH(g)+H2O(g)=CO2(g)+3H2(g) ∆H1,如图是该反应的能量变化图:

(5)通过图中信息可判断反应CH3OH(g)+H2O(g)=CO2(g)+3H2(g)的∆H1
(6)图中途径(Ⅱ)使用了催化剂。则途径(Ⅱ)的活化能
(7)已知下列两个热化学方程式:2CH3OH(g)+3O2(g)=2CO2(g)+4H2O(g) ∆H2
H2(g)+
 O2(g)=H2O(g) ∆H3
O2(g)=H2O(g) ∆H3则∆H2=
更新时间:2022-12-21 12:25:02
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
【推荐1】T℃时,在一个体积为2L的容器中,A气体与B气体反应生成C气体,反应过程中A、B、C物质的量变化如图所示。
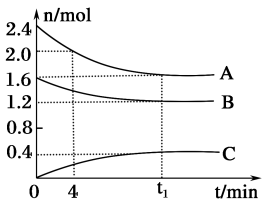
(1)写出该反应的化学方程式_____________ ;
(2)0~4分钟时,A的平均反应速率为___________ ;
(3)到达平衡时B的转化率为________ ;
(4)已知:
该反应正向是________ 热反应;
(5)红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g),反应过程和能量关系如图所示(图中的ΔH表示生成1mol产物的数据)。
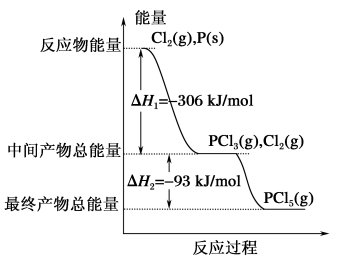
根据上图可知:P和Cl2反应生成PCl5的热化学方程式是_________ 。
(6)1mol气态钠离子和1mol气态氯离子结合生成1mol氯化钠晶体释放出的热能为氯化钠晶体的晶格能。
①下列热化学方程式中,能直接表示出氯化钠晶体晶格能的是______ 。
A.Na+(g)+Cl-(g)→NaCl(s) △Q1 B.Na(s)+ Cl2(g)→NaCl(s) △Q2
Cl2(g)→NaCl(s) △Q2
C.Na(s)→Na(g) △Q3 D.Na(g)-e-→Na+(g) △Q4
E. Cl2(g)→Cl(g) △Q5 F.Cl-(g)-e-→Cl(g) △Q6
Cl2(g)→Cl(g) △Q5 F.Cl-(g)-e-→Cl(g) △Q6
②写出△Q2与△Q1、△Q3、△Q4、△Q5、△Q6之间的关系式__________ 。

(1)写出该反应的化学方程式
(2)0~4分钟时,A的平均反应速率为
(3)到达平衡时B的转化率为
(4)已知:
t/℃ | 700 | 800 | 830 | 1000 | 1200 |
K | 2.6 | 1.7 | 1.0 | 0.9 | 0.6 |
该反应正向是
(5)红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g),反应过程和能量关系如图所示(图中的ΔH表示生成1mol产物的数据)。

根据上图可知:P和Cl2反应生成PCl5的热化学方程式是
(6)1mol气态钠离子和1mol气态氯离子结合生成1mol氯化钠晶体释放出的热能为氯化钠晶体的晶格能。
①下列热化学方程式中,能直接表示出氯化钠晶体晶格能的是
A.Na+(g)+Cl-(g)→NaCl(s) △Q1 B.Na(s)+
 Cl2(g)→NaCl(s) △Q2
Cl2(g)→NaCl(s) △Q2C.Na(s)→Na(g) △Q3 D.Na(g)-e-→Na+(g) △Q4
E.
 Cl2(g)→Cl(g) △Q5 F.Cl-(g)-e-→Cl(g) △Q6
Cl2(g)→Cl(g) △Q5 F.Cl-(g)-e-→Cl(g) △Q6②写出△Q2与△Q1、△Q3、△Q4、△Q5、△Q6之间的关系式
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐2】甲醇(CH3OH)是一种基础有机化工原料,将成为21世纪具有竞争力的清洁燃料之一,下面是利用工业废气CO2为碳源合成甲醇的反应原理。
①
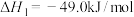
②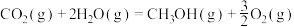
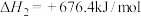
③
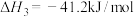
④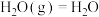 (1)
(1) 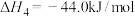
(1)写出表示 燃烧热的热化学反应方程式
燃烧热的热化学反应方程式_______ 。
(2)某实验室控制 和
和 初始投料比为1:2.2,在相同压强下,经过相同反应时间测得如下实验数据:
初始投料比为1:2.2,在相同压强下,经过相同反应时间测得如下实验数据:
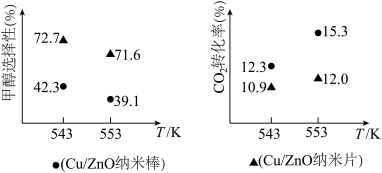
根据上述材料,请你选择合成甲醇的最佳条件_______ 。温度553K,选择催化剂II时,CO2的转化率12.0%是不是该状态下平衡转化率?_______ (填“是”或“不是”),原因是_______ 。
(3)针对反应①,下列说法正确的是_______。
(4)控制温度553K,向一定体积的刚性容器中投入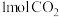 和
和 发生反应①、②、③,达到平衡时,容器内的气体压强为
发生反应①、②、③,达到平衡时,容器内的气体压强为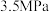 ,平衡时
,平衡时 的转化率为80%,
的转化率为80%, 的选择性为50%,生成
的选择性为50%,生成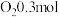 ,则反应①的分压平衡常数
,则反应①的分压平衡常数
_______ 。(已知:分压=组分物质的量分数×总压,甲醇的选择性 )
)
①

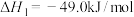
②
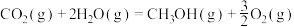
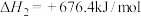
③

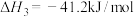
④
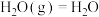 (1)
(1) 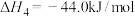
(1)写出表示
 燃烧热的热化学反应方程式
燃烧热的热化学反应方程式(2)某实验室控制
 和
和 初始投料比为1:2.2,在相同压强下,经过相同反应时间测得如下实验数据:
初始投料比为1:2.2,在相同压强下,经过相同反应时间测得如下实验数据:
根据上述材料,请你选择合成甲醇的最佳条件
(3)针对反应①,下列说法正确的是_______。
| A.压缩容器体积,正反应速率和逆反应速率都增大 |
B.升高温度, 的转化率一定增大 的转化率一定增大 |
C.选用合适的催化剂可提高 的生产效率 的生产效率 |
D.增大 和 和 的初始投料比可提高 的初始投料比可提高 的转化率 的转化率 |
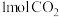 和
和 发生反应①、②、③,达到平衡时,容器内的气体压强为
发生反应①、②、③,达到平衡时,容器内的气体压强为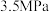 ,平衡时
,平衡时 的转化率为80%,
的转化率为80%, 的选择性为50%,生成
的选择性为50%,生成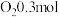 ,则反应①的分压平衡常数
,则反应①的分压平衡常数
 )
)
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐3】汽车尾气是造成雾霾天气的重要原因之一、已知:
①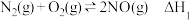
②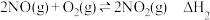
③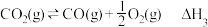
④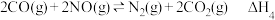
请完成以下问题:
(1)根据图,请写出该反应的热化学方程式___________ 。
(2)图表示反应④的反应物 、
、 的起始物质的量比、温度对平衡时
的起始物质的量比、温度对平衡时 的体积分数的影响。
的体积分数的影响。
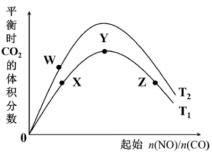
①W、Y、Z三点的平衡常数的大小关系为:___________ (用 、
、 、
、 表示),
表示), 、
、 、
、 三点,
三点, 的转化率由大到小的顺序是
的转化率由大到小的顺序是___________ (用 、
、 、
、 表示)。
表示)。
②T1℃时,在 密闭容器中,
密闭容器中, 和
和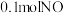 ,达到
,达到 点时,测得
点时,测得 的浓度为
的浓度为 ,则此温度下平衡常数K=
,则此温度下平衡常数K=__________ (算出数值)。若此温度下,某时刻测得 、
、 、
、 、
、 的浓度分别为
的浓度分别为 、
、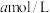 、
、 、
、 ,要使反应向正方向进行,a的取值范围为
,要使反应向正方向进行,a的取值范围为___________ 。
①
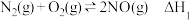
②
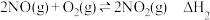
③
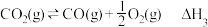
④
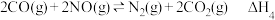
请完成以下问题:
(1)根据图,请写出该反应的热化学方程式

(2)图表示反应④的反应物
 、
、 的起始物质的量比、温度对平衡时
的起始物质的量比、温度对平衡时 的体积分数的影响。
的体积分数的影响。
①W、Y、Z三点的平衡常数的大小关系为:
 、
、 、
、 表示),
表示), 、
、 、
、 三点,
三点, 的转化率由大到小的顺序是
的转化率由大到小的顺序是 、
、 、
、 表示)。
表示)。②T1℃时,在
 密闭容器中,
密闭容器中, 和
和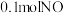 ,达到
,达到 点时,测得
点时,测得 的浓度为
的浓度为 ,则此温度下平衡常数K=
,则此温度下平衡常数K= 、
、 、
、 、
、 的浓度分别为
的浓度分别为 、
、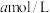 、
、 、
、 ,要使反应向正方向进行,a的取值范围为
,要使反应向正方向进行,a的取值范围为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐1】实验是化学研究的重要手段。
已知:i. 具有强氧化性,能完全电离,
具有强氧化性,能完全电离, 易被还原为
易被还原为 ;
;
ii.淀粉检测 的灵敏度很高,遇低浓度的
的灵敏度很高,遇低浓度的 即可快速变蓝;
即可快速变蓝;
iii.溶液中存在: 。
。
(1)研究 与
与 的平均反应速率,小组同学分别向两支试管中依次加入下列试剂,并记录变色时间,如表。
的平均反应速率,小组同学分别向两支试管中依次加入下列试剂,并记录变色时间,如表。
查阅文献知,实验1—2中的反应分两步进行,反应I:……;反应II: 。
。
①反应I的离子方程式是__________________________ ;
②加入 溶液后溶液变色的时间明显增长的原因
溶液后溶液变色的时间明显增长的原因__________________ 。
③根据实验数据,计算30s内的平均反应速率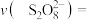
___________  。
。
(2)研究反应速率与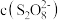 和
和 的关系
的关系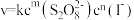 ,k为常数。实验数据如表:(所用试剂除标注外均为0.2
,k为常数。实验数据如表:(所用试剂除标注外均为0.2 )
)
①加入 、
、 溶液的目的是控制实验条件,其中
溶液的目的是控制实验条件,其中
___________ ,
___________
②若实验测得数据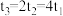 ,则
,则
____________ 。
③此实验的结论为___________ 。
已知:i.
 具有强氧化性,能完全电离,
具有强氧化性,能完全电离, 易被还原为
易被还原为 ;
;ii.淀粉检测
 的灵敏度很高,遇低浓度的
的灵敏度很高,遇低浓度的 即可快速变蓝;
即可快速变蓝;iii.溶液中存在:
 。
。(1)研究
 与
与 的平均反应速率,小组同学分别向两支试管中依次加入下列试剂,并记录变色时间,如表。
的平均反应速率,小组同学分别向两支试管中依次加入下列试剂,并记录变色时间,如表。编号 | 0.2 | 0.01 | 蒸馏水/ | 0.4%的淀粉溶液/ | 0.2 | 变色时间/s |
1—1 | 2 | 0 | 2.7 | 0.1 | 0.2 | 立即 |
1—2 | 2 | 0.8 | 0.1 | 0.1 | 2 | 30 |
 。
。①反应I的离子方程式是
②加入
 溶液后溶液变色的时间明显增长的原因
溶液后溶液变色的时间明显增长的原因③根据实验数据,计算30s内的平均反应速率
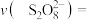
 。
。(2)研究反应速率与
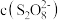 和
和 的关系
的关系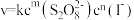 ,k为常数。实验数据如表:(所用试剂除标注外均为0.2
,k为常数。实验数据如表:(所用试剂除标注外均为0.2 )
)实验编号 |
|
| 0.05
|
|
| 0.2%淀粉溶液/ |
|
2—1 | 10 | 10 | 3 | 0 | 0 | 1 |
|
2—2 | 10 | 5 | 3 |
|
| 1 |
|
2—3 | 10 | 2.5 | 3 |
|
| 1 |
|
①加入
 、
、 溶液的目的是控制实验条件,其中
溶液的目的是控制实验条件,其中

②若实验测得数据
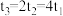 ,则
,则
③此实验的结论为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐2】I.硫代硫酸钠与稀硫酸反应的方程式为:Na2S2O3+H2SO4=Na2SO4+SO2↑+S↓+H2O某学习小组为研究反应物浓度和温度对该反应速率的影响,设计以下3组实验,回答下列问题
(1)该反应所需的仪器有:量筒、烧杯、试管、胶头滴管、秒表、_______
(2)通过记录_______ 可以比较反应的快慢
(3)对比实验Ⅱ、Ⅲ研究温度对该反应速率的影响,则y=_______
(4)对比实验_______ (填实验序号)研究c(H+)对该反应速率的影响,则x=_______
(5)若x、y值为第(3)(4)小题所得数值,则t1、t2、t3由大到小的顺序为_______
Ⅱ.某小组同学欲探究 NH3的催化氧化实验,按如图装置进行实验。
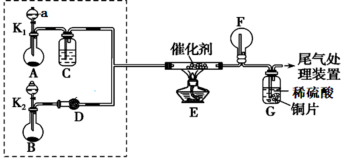
A、B装置可选药品:浓氨水、H2O2、蒸馏水、NaOH 固体、MnO2
(1)制取 NH3 是在哪一装置中_______ 。(填 A 或 B)
(2)装置D中盛放的试剂可以是_______ (填序号)。
A.浓硫酸 B.碱石灰 C.无水氯化钙 D.硫酸铜
(3)装置E中发生反应的化学方程式为_______ 。
(4)某同学按上述装置进行实验,一段时间后。观察到装置F中有红棕色气体,装置G中溶液变成蓝色。用离子方程式解释装置G中溶液变成蓝色的原因:_______ ;
Ⅲ.已部分氧化的亚硫酸钠,为确定其纯度,要进行如下实验:①称取样品W1g;②将样品溶于蒸馏水中;③给溶液加稍过量的经盐酸酸化的BaCl2溶液;④过滤、洗涤、干燥沉淀,称其质量为W2g,试回答:
(1)检查 是否沉淀完全的实验方法:
是否沉淀完全的实验方法:_______ 。
(2)判断沉淀是否洗净的实验方法:_______ 。
(3)Na2SO3纯度的表示式:_______ (用W1、W2表示)。
| 实验序号 | 反应温度 | Na2S2O3溶液 | 稀硫酸 | H2O | 产生沉淀时间 | ||
| V/mL | c/(mol/L) | V/mL | c/(mol/L) | V/mL | |||
| I | 25 | 5 | 0.2 | 10 | 0.1 | x | t1 |
| II | 25 | 10 | 0.1 | 10 | 0.2 | 5 | t2 |
| III | 35 | 10 | 0.1 | 5 | y | 10 | t3 |
(2)通过记录
(3)对比实验Ⅱ、Ⅲ研究温度对该反应速率的影响,则y=
(4)对比实验
(5)若x、y值为第(3)(4)小题所得数值,则t1、t2、t3由大到小的顺序为
Ⅱ.某小组同学欲探究 NH3的催化氧化实验,按如图装置进行实验。

A、B装置可选药品:浓氨水、H2O2、蒸馏水、NaOH 固体、MnO2
(1)制取 NH3 是在哪一装置中
(2)装置D中盛放的试剂可以是
A.浓硫酸 B.碱石灰 C.无水氯化钙 D.硫酸铜
(3)装置E中发生反应的化学方程式为
(4)某同学按上述装置进行实验,一段时间后。观察到装置F中有红棕色气体,装置G中溶液变成蓝色。用离子方程式解释装置G中溶液变成蓝色的原因:
Ⅲ.已部分氧化的亚硫酸钠,为确定其纯度,要进行如下实验:①称取样品W1g;②将样品溶于蒸馏水中;③给溶液加稍过量的经盐酸酸化的BaCl2溶液;④过滤、洗涤、干燥沉淀,称其质量为W2g,试回答:
(1)检查
 是否沉淀完全的实验方法:
是否沉淀完全的实验方法:(2)判断沉淀是否洗净的实验方法:
(3)Na2SO3纯度的表示式:
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐3】研究化学反应速率与限度,有利于人类的生产。
I. 、
、 、CO等都是重要的能源,也是重要的化工原料。
、CO等都是重要的能源,也是重要的化工原料。
(1)为倡导“节能减排”和“低碳经济”,降低大气中CO2的含量,有效地开发利用CO2,工业上可以用CO2来生产甲醇燃料。在体积为2L的密闭容器中,充入 和
和 ,一定条件下发生反应:
,一定条件下发生反应: 。经测得
。经测得 和CO2的物质的量随时间变化如图所示。
和CO2的物质的量随时间变化如图所示。
___________ 。
②达到平衡时, 的转化率为
的转化率为___________ 。
(2)工业上也可以用CO和 为原料制备
为原料制备 ,反应方程式为:
,反应方程式为: ,在一体积固定的密闭容器中投入一定量的CO和
,在一体积固定的密闭容器中投入一定量的CO和 气体进行上述反应。
气体进行上述反应。
①下列叙述中能说明上述反应达到平衡状态的是___________ 。
A.反应中CO与 的物质的量之比为1:1
的物质的量之比为1:1
B.混合气体的压强不随时间的变化而变化
C.单位时间内每消耗1molCO,同时生成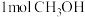
D. 的体积分数在混合气体中保持不变
的体积分数在混合气体中保持不变
②在某一时刻采取下列措施能使该反应速率增大的是___________ (填序号)。
A.选用催化效果更好的催化剂
B.降低温度
C.保持CO量不变,通入更多的
D.充入适量氦气
II.某学生探究加入硫酸铜的量对锌与硫酸反应生成 速率的影响,设计实验如下:
速率的影响,设计实验如下:
将表中所给的混合溶液分别加入到5个盛有过量Zn粒的容器中,收集产生的气体,记录获得相同体积的气体所需时间。(忽略混合时溶液体积变化)
(3)请完成此实验设计,其中:
___________ ,
___________ 。
(4)该同学最后得出的结论为:当加入少量 溶液时,生成氢气的速率会大大提高,请分析氢气生成速率提高的主要原因
溶液时,生成氢气的速率会大大提高,请分析氢气生成速率提高的主要原因___________ 。
I.
 、
、 、CO等都是重要的能源,也是重要的化工原料。
、CO等都是重要的能源,也是重要的化工原料。(1)为倡导“节能减排”和“低碳经济”,降低大气中CO2的含量,有效地开发利用CO2,工业上可以用CO2来生产甲醇燃料。在体积为2L的密闭容器中,充入
 和
和 ,一定条件下发生反应:
,一定条件下发生反应: 。经测得
。经测得 和CO2的物质的量随时间变化如图所示。
和CO2的物质的量随时间变化如图所示。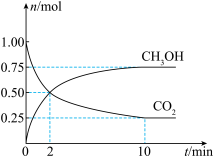

②达到平衡时,
 的转化率为
的转化率为(2)工业上也可以用CO和
 为原料制备
为原料制备 ,反应方程式为:
,反应方程式为: ,在一体积固定的密闭容器中投入一定量的CO和
,在一体积固定的密闭容器中投入一定量的CO和 气体进行上述反应。
气体进行上述反应。①下列叙述中能说明上述反应达到平衡状态的是
A.反应中CO与
 的物质的量之比为1:1
的物质的量之比为1:1B.混合气体的压强不随时间的变化而变化
C.单位时间内每消耗1molCO,同时生成
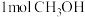
D.
 的体积分数在混合气体中保持不变
的体积分数在混合气体中保持不变②在某一时刻采取下列措施能使该反应速率增大的是
A.选用催化效果更好的催化剂
B.降低温度
C.保持CO量不变,通入更多的

D.充入适量氦气
II.某学生探究加入硫酸铜的量对锌与硫酸反应生成
 速率的影响,设计实验如下:
速率的影响,设计实验如下:将表中所给的混合溶液分别加入到5个盛有过量Zn粒的容器中,收集产生的气体,记录获得相同体积的气体所需时间。(忽略混合时溶液体积变化)
| 实验混合溶液 | A | B | C | D | E |
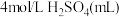 | 40 | V1 | V2 | V3 | V4 |
饱和 溶液(mL) 溶液(mL) | 0 | 1 | 2 | V5 | 10 |
 | V6 | V7 | V8 | 5 | 0 |

(4)该同学最后得出的结论为:当加入少量
 溶液时,生成氢气的速率会大大提高,请分析氢气生成速率提高的主要原因
溶液时,生成氢气的速率会大大提高,请分析氢气生成速率提高的主要原因
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐1】探究甲醛与新制氢氧化铜反应的固体产物组成,以及影响产物的因素,回答下列问题。
已知:①CO常温下能与银氨溶液反应生成黑色Ag,以此可用于CO的检验。
②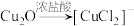
I. 与新制氢氧化铜反应
与新制氢氧化铜反应
II.甲组同学探究固体和气体产物的成分
(1)提出假设:根据反应原理,假设产生的气体中可能含有CO、 、
、 ,假设产生的沉淀为
,假设产生的沉淀为 。
。
III.乙组同学设计如下实验探究影响固体和气体的因素
表1不同条件下的实验方案
表2不同甲醛的量条件下的反应情况
(2)由表2中实验1~4的结果可发现:
①实验1~4反应时间缩短,这是由于___________ 所致。
②实验1~3产生的气体量相差不大,但显著小于实验4产生的气体量,究其原因可能是实验4中,过量甲醛在碱性条件下发生副反应生成甲醇,甲醇再被催化生成 ,根据已学知识推测:该反应的储化剂可能是
,根据已学知识推测:该反应的储化剂可能是___________ 。
③实验1~4产生的固体产物的质量也下降,可能原因是产物 沉淀继续被
沉淀继续被 还原,该反应的化学方程式为
还原,该反应的化学方程式为___________ 。
(3)结论:在强碱性环境中,甲醛与新制氢氧化铜反应,请总结上述条件对气体产物和固体产物的影响:___________ 。
已知:①CO常温下能与银氨溶液反应生成黑色Ag,以此可用于CO的检验。
②
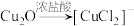
I.
 与新制氢氧化铜反应
与新制氢氧化铜反应| 实验装置 | 实验步骤 | 实验现象 |
 | 圆底烧瓶中依次加入 25%的氢氧化钠溶液和 25%的氢氧化钠溶液和 8%的硫酸铜 8%的硫酸铜 | 大量蓝色沉淀产生,随后沉淀部分溶解 |
再加入37%~40%的甲醛溶液 ,搅拌,90℃恒温水浴反应 ,搅拌,90℃恒温水浴反应 ,记录产生的气体体积 ,记录产生的气体体积 | 蓝色絮状沉淀逐渐变为红色,并伴有大量气体产生;随着反应的进行逐渐有红褐色沉淀生成 |
(1)提出假设:根据反应原理,假设产生的气体中可能含有CO、
 、
、 ,假设产生的沉淀为
,假设产生的沉淀为 。
。| 实验装置 | 实验步骤 | 实验现象 | 结论 |
 | ①将实验生成的气体依次通入A、B装置,在A、B装置中分别加入的试剂A | 产物气体中不含CO、 | |
| ②将所得沉淀洗净后,加入浓盐酸 | 发现只有部分沉淀溶解 | 固态产物为 |
III.乙组同学设计如下实验探究影响固体和气体的因素
表1不同条件下的实验方案
| 实验 | 1 | 2 | 3 | 4 |
| 温度/℃ | 60 | 60 | 60 | 60 |
 溶液浓度/% 溶液浓度/% | 25 | 25 | 25 | 25 |
 溶液体积/mL 溶液体积/mL | 20 | 20 | 20 | 20 |
| 实验序号 | 1 | 2 | 3 | 4 |
| 甲醛的体积/mL | 0.2 | 0.4 | 1.0 | 9.0 |
反应时间/ | 47 | 33 | 24 | 20 |
| 生成气体的体积/mL | 15 | 14 | 16 | 140 |
| 固体产物质量/g | 0.50 | 0.50 | 0.45 | 0.40 |
①实验1~4反应时间缩短,这是由于
②实验1~3产生的气体量相差不大,但显著小于实验4产生的气体量,究其原因可能是实验4中,过量甲醛在碱性条件下发生副反应生成甲醇,甲醇再被催化生成
 ,根据已学知识推测:该反应的储化剂可能是
,根据已学知识推测:该反应的储化剂可能是③实验1~4产生的固体产物的质量也下降,可能原因是产物
 沉淀继续被
沉淀继续被 还原,该反应的化学方程式为
还原,该反应的化学方程式为(3)结论:在强碱性环境中,甲醛与新制氢氧化铜反应,请总结上述条件对气体产物和固体产物的影响:
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐2】甲烷水蒸气重整制合成气是利用甲烷资源的途径之一,该过程的主要反应是反应①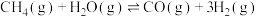

(1)已知: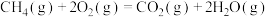
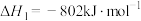

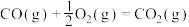
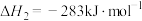
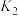
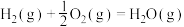
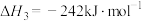

则反应①的
_________ (用 、
、 和
和 表示);该温度下,反应①的
表示);该温度下,反应①的
_________ (用 、
、 、
、 表示)
表示)
(2)其他条件相同,反应①在不同催化剂(Ⅰ、Ⅱ、Ⅲ)作用下反应相同时间后, 的转化率随反应温度的变化如图所示。
的转化率随反应温度的变化如图所示。
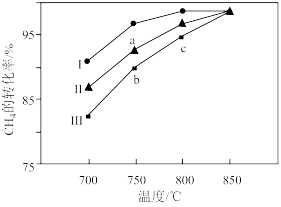
①在相同条件下,三种催化剂Ⅰ、Ⅱ、Ⅲ的催化效率由高到低的顺序是_________ 。
②a点所代表的状态_________ (填“是”或“不是”)平衡状态。
③c点 的转化率高于b点,原因是
的转化率高于b点,原因是_________
(3)反应①在恒容密闭反应器中进行, 和
和 的起始物质的量浓度之比为1:2,10h后
的起始物质的量浓度之比为1:2,10h后 的转化率为80%,并测得
的转化率为80%,并测得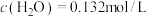 。
。
① 的起始物质的量浓度为
的起始物质的量浓度为_________ ;
②0~10h内消耗 的平均反应速率为
的平均反应速率为_________ 。
(4)在答题卡的坐标图中,画出反应①分别在700℃和850℃下进行时, 的转化率随时间t变化的示意图(进行必要标注)
的转化率随时间t变化的示意图(进行必要标注) _________ 。

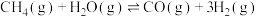

(1)已知:
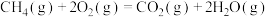
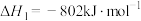

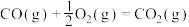
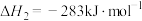
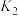
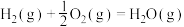
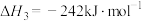

则反应①的

 、
、 和
和 表示);该温度下,反应①的
表示);该温度下,反应①的
 、
、 、
、 表示)
表示)(2)其他条件相同,反应①在不同催化剂(Ⅰ、Ⅱ、Ⅲ)作用下反应相同时间后,
 的转化率随反应温度的变化如图所示。
的转化率随反应温度的变化如图所示。
①在相同条件下,三种催化剂Ⅰ、Ⅱ、Ⅲ的催化效率由高到低的顺序是
②a点所代表的状态
③c点
 的转化率高于b点,原因是
的转化率高于b点,原因是(3)反应①在恒容密闭反应器中进行,
 和
和 的起始物质的量浓度之比为1:2,10h后
的起始物质的量浓度之比为1:2,10h后 的转化率为80%,并测得
的转化率为80%,并测得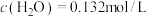 。
。①
 的起始物质的量浓度为
的起始物质的量浓度为②0~10h内消耗
 的平均反应速率为
的平均反应速率为(4)在答题卡的坐标图中,画出反应①分别在700℃和850℃下进行时,
 的转化率随时间t变化的示意图(进行必要标注)
的转化率随时间t变化的示意图(进行必要标注) 
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐3】过氧化氢、次氯酸都具有强氧化性,且不稳定,都可作杀菌消毒剂和漂白剂。
(1)MnO2催化过氧化氢分解反应的机理分为三步:
第一步:MnO2+H2O2=Mn2++2OH-+O2↑
第二步:Mn2++2OH-=Mn(OH)2↓
第三步:___________ 。
(2)溶液pH对过氧化氢分解反应的影响。
在60℃条件下,取6 mL 30%H2O2溶液,用氢氧化钠调节pH,60 min内,过氧化氢的分解率与溶液pH的关系如图1所示。

①该温度下,H2O2分解率最大时溶液pH为___________ 。
②若30%H2O2溶液的密度为1.11 g·cm-3,pH=8,则60 min内用O2表示的平均反应速率v(O2)=___________ mol·min-1保留两位有效数字)。
(3)次氯酸易分解,常将其转化为次氯酸盐形式保存和运输。
①次氯酸钠可以去除废水中的氨氮(氨氮以NH3计),将废水中的氨氮最终氧化为氮气,该反应的离子方程式为___________ 。
②废水中的氨氮去除率与溶液pH、温度及次氯酸钠投入量等因素有关。其他条件一定时,氨氮去除率与温度的关系如图2所示(已知NaClO+H2O NaOH+HClO)。
NaOH+HClO)。
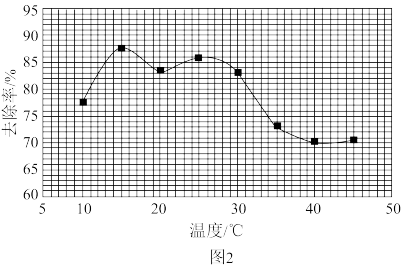
温度为___________ 时氨氮去除率最高。当温度高于30℃时,温度越高,氨氮去除率减小的原因可能是___________ 。
(1)MnO2催化过氧化氢分解反应的机理分为三步:
第一步:MnO2+H2O2=Mn2++2OH-+O2↑
第二步:Mn2++2OH-=Mn(OH)2↓
第三步:
(2)溶液pH对过氧化氢分解反应的影响。
在60℃条件下,取6 mL 30%H2O2溶液,用氢氧化钠调节pH,60 min内,过氧化氢的分解率与溶液pH的关系如图1所示。

①该温度下,H2O2分解率最大时溶液pH为
②若30%H2O2溶液的密度为1.11 g·cm-3,pH=8,则60 min内用O2表示的平均反应速率v(O2)=
(3)次氯酸易分解,常将其转化为次氯酸盐形式保存和运输。
①次氯酸钠可以去除废水中的氨氮(氨氮以NH3计),将废水中的氨氮最终氧化为氮气,该反应的离子方程式为
②废水中的氨氮去除率与溶液pH、温度及次氯酸钠投入量等因素有关。其他条件一定时,氨氮去除率与温度的关系如图2所示(已知NaClO+H2O
 NaOH+HClO)。
NaOH+HClO)。
温度为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐1】回答下列问题。
I.生物脱 的原理为:
的原理为:
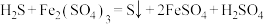
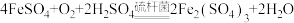
(1)硫杆菌存在时, 被氧化的速率是无菌时的
被氧化的速率是无菌时的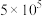 倍,该菌的作用是
倍,该菌的作用是_______ 。
(2)由图1和图2判断使用硫杆菌的最佳条件为_______ 。

II.实验小组对可逆反应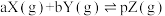 进行探究。回答下列问题:
进行探究。回答下列问题:
(3)T℃时,起始向10L恒容密闭容器中充入X、Y,测得反应过程中X、Y、Z三种气体的物质的量浓度(c)与时间(t)的关系如图所示。
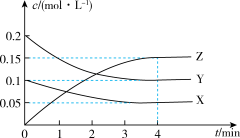
①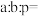
_______
②该反应达最大限度时Y的转化率为_______
③0~4min内的反应速率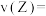
_______
④下列描述能表示该反应达平衡状态的是_______
A.容器中Y与Z的物质的量相等 B.X的体积分数不再改变
C.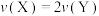 D.容器内气体的密度不再发生变化
D.容器内气体的密度不再发生变化
(4)若改变下列一个条件,推测该反应速率发生的变化(填“增大”“减小”“不变”)
①升高温度,化学反应速率_______ ;
②恒容条件下再充入1mol X,化学反应速率_______ ;
③恒压条件下充入1mol氮气,化学反应速率_______ 。
I.生物脱
 的原理为:
的原理为: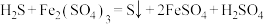
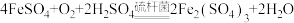
(1)硫杆菌存在时,
 被氧化的速率是无菌时的
被氧化的速率是无菌时的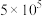 倍,该菌的作用是
倍,该菌的作用是(2)由图1和图2判断使用硫杆菌的最佳条件为

II.实验小组对可逆反应
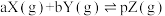 进行探究。回答下列问题:
进行探究。回答下列问题:(3)T℃时,起始向10L恒容密闭容器中充入X、Y,测得反应过程中X、Y、Z三种气体的物质的量浓度(c)与时间(t)的关系如图所示。

①
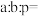
②该反应达最大限度时Y的转化率为
③0~4min内的反应速率
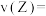
④下列描述能表示该反应达平衡状态的是
A.容器中Y与Z的物质的量相等 B.X的体积分数不再改变
C.
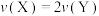 D.容器内气体的密度不再发生变化
D.容器内气体的密度不再发生变化(4)若改变下列一个条件,推测该反应速率发生的变化(填“增大”“减小”“不变”)
①升高温度,化学反应速率
②恒容条件下再充入1mol X,化学反应速率
③恒压条件下充入1mol氮气,化学反应速率
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐2】十氢奈是具有高储氢密度的氢能载体,经历“十氢奈(C10H18 )→四氢奈(C10H12)→奈(C10H8)”的脱氢过程释放氢气。已知:
C10H18(l) C10H12(l)+3H2(g) △H1
C10H12(l)+3H2(g) △H1
C10H12(l) C10H8(l)+2H2(g) △H2
C10H8(l)+2H2(g) △H2
△H1>△H2>0;C10H18→C10H12的活化能为Ea1,C10H12→C10H8的活化能为Ea2,十氢奈的常压沸点为192℃;在192℃,液态十氢奈的脱氢反应的平衡转化率约为9%。请回答:
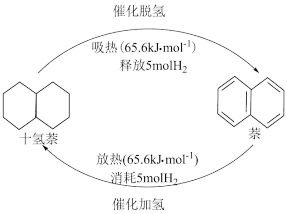
(1)每1mol 十氢萘液体可储存5mol氢气,可运载到使用氢气的场所,在催化剂的作用下释放氢气,生成的液体萘可重复催化加氢来储存氢气,如图所示,则△H1+△H2=__________ 。
(2)有利于提高上述反应平衡转化率的条件是__________ 。
A.高温高压 B.低温低压 C.高温低压 D.低温高压
(3)不同压力和温度下十氢萘的平衡转化率如图所示,结合图示回答问题:
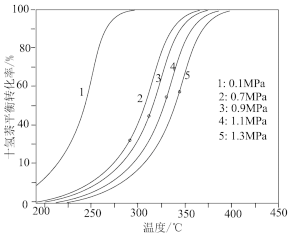
①在相同压强下升高温度,未达新平衡前,v正__________ v逆(填写“大于”“小于”或“等于”)。
②研究表明,将适量的十氢奈置于恒容密闭反应器中,既升高温度又增大压强,十氢萘的转化率也升高,可能理由是______________________________________ 。
(4)温度335℃,在恒容密闭反应器中进行高压液态十氢奈(1.00 mol)催化脱氢实验,测得液态C10H12和液态C10H8的产率x1和x2(以物质的量分数计)随时间变化关系,如图所示。
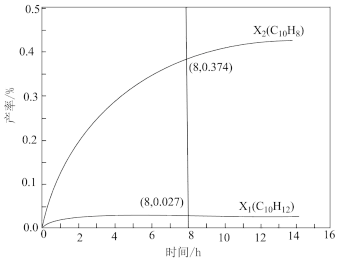
①在8h时,反应体系内氢气的量为_______ mol(忽略其他副反应),液态十氢奈的转化率是____ 。
②x1显著低于x2的原因是_______________________________________________ 。
C10H18(l)
 C10H12(l)+3H2(g) △H1
C10H12(l)+3H2(g) △H1 C10H12(l)
 C10H8(l)+2H2(g) △H2
C10H8(l)+2H2(g) △H2 △H1>△H2>0;C10H18→C10H12的活化能为Ea1,C10H12→C10H8的活化能为Ea2,十氢奈的常压沸点为192℃;在192℃,液态十氢奈的脱氢反应的平衡转化率约为9%。请回答:
(1)每1mol 十氢萘液体可储存5mol氢气,可运载到使用氢气的场所,在催化剂的作用下释放氢气,生成的液体萘可重复催化加氢来储存氢气,如图所示,则△H1+△H2=

(2)有利于提高上述反应平衡转化率的条件是
A.高温高压 B.低温低压 C.高温低压 D.低温高压
(3)不同压力和温度下十氢萘的平衡转化率如图所示,结合图示回答问题:

①在相同压强下升高温度,未达新平衡前,v正
②研究表明,将适量的十氢奈置于恒容密闭反应器中,既升高温度又增大压强,十氢萘的转化率也升高,可能理由是
(4)温度335℃,在恒容密闭反应器中进行高压液态十氢奈(1.00 mol)催化脱氢实验,测得液态C10H12和液态C10H8的产率x1和x2(以物质的量分数计)随时间变化关系,如图所示。

①在8h时,反应体系内氢气的量为
②x1显著低于x2的原因是
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐3】在密闭容器甲中,使1molN2和3molH2混合发生下列反应:N2(g)+3H2(g) 2NH3(g) ΔH<0。
2NH3(g) ΔH<0。
(1)当反应达到平衡时,N2和H2的浓度比是____ ;N2和H2的转化率比是____ 。
(2)升高平衡体系的温度(保持体积不变),混合气体的平均相对分子质量__ ,密度__ (填“变大”、“变小”或“不变”)。
(3)当达到平衡时,充入氩气,并保持压强不变,平衡将___ (填“正向”、“逆向”或“不”)移动。
(4)在相同温度下,相同容积的乙容器中充入2molN2和6molH2。下列叙述中,正确的是___ 。
A.化学反应速率:乙>甲 B.平衡后N2的浓度:乙<甲
C.H2的转化率:乙<甲 D.平衡混合气中H2的体积分数:乙<甲
 2NH3(g) ΔH<0。
2NH3(g) ΔH<0。(1)当反应达到平衡时,N2和H2的浓度比是
(2)升高平衡体系的温度(保持体积不变),混合气体的平均相对分子质量
(3)当达到平衡时,充入氩气,并保持压强不变,平衡将
(4)在相同温度下,相同容积的乙容器中充入2molN2和6molH2。下列叙述中,正确的是
A.化学反应速率:乙>甲 B.平衡后N2的浓度:乙<甲
C.H2的转化率:乙<甲 D.平衡混合气中H2的体积分数:乙<甲
您最近一年使用:0次