如图是部分金属和非金属材料发现和使用的时间简轴。
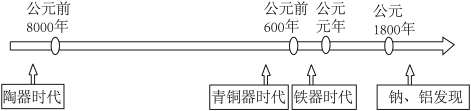
(1)材料的不断发展可以促进社会进步。
①上述金属的常见化合物中,呈淡黄色的是_______ (填化学式)。
②目前应用最多的太阳能电池的光电转化材料是_______ (填化学式)。
③氮化铝(AlN)广泛应用于电子工业、陶瓷工业等领域。在一定条件下,氮化铝可通过反应Al2O3+N2+C→AlN+CO合成,配平并用双线桥法标出该反应中电子转移的方向和数目_______ 。
(2)向充满CO2的铝制易拉罐中注入足量的NaOH溶液,立即用胶布封严罐口,罐壁立即内陷,一段时间后,罐壁又重新鼓起来恢复原样。写出易拉罐重新鼓起来时发生反应的化学方程式_______ 。
(3)某同学用下图实验装置探究铁盐与亚铁盐的性质。
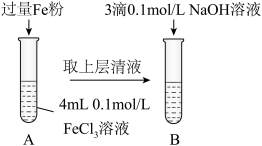
①试管A中发生反应的离子方程式为_______ 。
②试管B中可观察到的现象是_______ 。
(4)“侯氏制碱法”以NaCl、NH3、CO2等为原料先制得NaHCO3,进而生产出纯碱。若制得的纯碱中只含有杂质NaCl,要测定该纯碱的纯度,下列方案可行的是_______ (填字母)。
a.向m g纯碱样品中加入足量CaCl2溶液,沉淀经过滤、洗涤、干燥,称其质量为b g
b.向m g纯碱样品中加入足量稀盐酸,用碱石灰(主要成分是CaO和NaOH)吸收产生的气体,碱石灰增重b g
c.准确称量m g样品,加热至恒重,称量得b g固体

(1)材料的不断发展可以促进社会进步。
①上述金属的常见化合物中,呈淡黄色的是
②目前应用最多的太阳能电池的光电转化材料是
③氮化铝(AlN)广泛应用于电子工业、陶瓷工业等领域。在一定条件下,氮化铝可通过反应Al2O3+N2+C→AlN+CO合成,配平并用双线桥法标出该反应中电子转移的方向和数目
(2)向充满CO2的铝制易拉罐中注入足量的NaOH溶液,立即用胶布封严罐口,罐壁立即内陷,一段时间后,罐壁又重新鼓起来恢复原样。写出易拉罐重新鼓起来时发生反应的化学方程式
(3)某同学用下图实验装置探究铁盐与亚铁盐的性质。

①试管A中发生反应的离子方程式为
②试管B中可观察到的现象是
(4)“侯氏制碱法”以NaCl、NH3、CO2等为原料先制得NaHCO3,进而生产出纯碱。若制得的纯碱中只含有杂质NaCl,要测定该纯碱的纯度,下列方案可行的是
a.向m g纯碱样品中加入足量CaCl2溶液,沉淀经过滤、洗涤、干燥,称其质量为b g
b.向m g纯碱样品中加入足量稀盐酸,用碱石灰(主要成分是CaO和NaOH)吸收产生的气体,碱石灰增重b g
c.准确称量m g样品,加热至恒重,称量得b g固体
更新时间:2022-12-28 17:08:37
|
相似题推荐
解答题-实验探究题
|
适中
(0.65)
名校
【推荐1】某课外活动小组为了研究“干燥的CO2不能与Na2O2反应”和“潮湿的CO2才能与Na2O2反应”,设计了如图实验装置:

(1)写出过氧化钠与CO2反应的方程式,并用双线桥表示该反应的电子转移情况___ 。
(2)打开K1,关闭K2,打开活塞加入稀硫酸,生成CO2,加热铜丝,X是___ 。
(3)若打开K2,关闭K1,硬质玻璃管中出现___ 现象,可证明潮湿的CO2与Na2O2反应产生了O2。某同学提出质疑,认为不一定是CO2与Na2O2反应产生了O2导致该现象的产生,请用化学方程式解释该同学提出质疑的原因:___ 。
(4)通过实验测得反应结束后,球形干燥管中仅有Na2CO3和未反应完的Na2O2固体,为测得固体混合物的组成,某实验小组将1.45g固体混合物溶于水中。然后向溶液中滴加盐酸,产生气体的体积随盐酸的加入量如图所示。

①加入盐酸0~100时间段,溶液中发生的离子反应方程式有:___ 、___ 。
②若在加入盐酸体积为150时,收集到CO2共0.44g,则固体混合物中Na2O2的质量分数为___ 。(保留一位小数)

(1)写出过氧化钠与CO2反应的方程式,并用双线桥表示该反应的电子转移情况
(2)打开K1,关闭K2,打开活塞加入稀硫酸,生成CO2,加热铜丝,X是
(3)若打开K2,关闭K1,硬质玻璃管中出现
(4)通过实验测得反应结束后,球形干燥管中仅有Na2CO3和未反应完的Na2O2固体,为测得固体混合物的组成,某实验小组将1.45g固体混合物溶于水中。然后向溶液中滴加盐酸,产生气体的体积随盐酸的加入量如图所示。

①加入盐酸0~100时间段,溶液中发生的离子反应方程式有:
②若在加入盐酸体积为150时,收集到CO2共0.44g,则固体混合物中Na2O2的质量分数为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐2】 是具有强烈刺激性气味的棕黄色气体,是一种强氧化剂;易溶于水且会与水化合生成次氯酸;热稳定性差,42℃以上可以分解为
是具有强烈刺激性气味的棕黄色气体,是一种强氧化剂;易溶于水且会与水化合生成次氯酸;热稳定性差,42℃以上可以分解为 和
和 并可引起爆炸;与有机物或还原剂接触时会燃烧并爆炸。一种制取
并可引起爆炸;与有机物或还原剂接触时会燃烧并爆炸。一种制取 的装置如图所示。已知:
的装置如图所示。已知: 的熔点为-116℃,沸点为3.8℃;
的熔点为-116℃,沸点为3.8℃; 的沸点为-34.6℃;
的沸点为-34.6℃;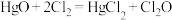 ;液氨可做制冷剂。
;液氨可做制冷剂。
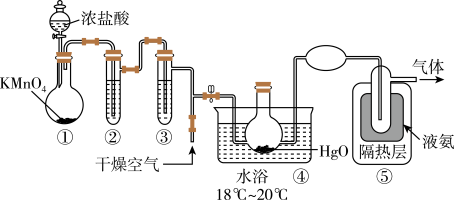
(1)写出装置①中发生反应的离子方程式并用单线桥法标出电子转移的方向和数目:______ (已知 的还原产物为
的还原产物为 )。
)。
(2)装置②中的试剂是______ ,装置③的作用是____________ 。
(3)装置④的温度不宜太高,主要原因是____________ 。
(4)从装置⑤中逸出气体的主要成分是______ ;可通过装有______ (填字母)的装置,以防止污染空气。
A.浓硫酸 B.碱石灰 C.无水氯化钙 D.无水硫酸铜
 是具有强烈刺激性气味的棕黄色气体,是一种强氧化剂;易溶于水且会与水化合生成次氯酸;热稳定性差,42℃以上可以分解为
是具有强烈刺激性气味的棕黄色气体,是一种强氧化剂;易溶于水且会与水化合生成次氯酸;热稳定性差,42℃以上可以分解为 和
和 并可引起爆炸;与有机物或还原剂接触时会燃烧并爆炸。一种制取
并可引起爆炸;与有机物或还原剂接触时会燃烧并爆炸。一种制取 的装置如图所示。已知:
的装置如图所示。已知: 的熔点为-116℃,沸点为3.8℃;
的熔点为-116℃,沸点为3.8℃; 的沸点为-34.6℃;
的沸点为-34.6℃;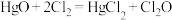 ;液氨可做制冷剂。
;液氨可做制冷剂。
(1)写出装置①中发生反应的离子方程式并用单线桥法标出电子转移的方向和数目:
 的还原产物为
的还原产物为 )。
)。(2)装置②中的试剂是
(3)装置④的温度不宜太高,主要原因是
(4)从装置⑤中逸出气体的主要成分是
A.浓硫酸 B.碱石灰 C.无水氯化钙 D.无水硫酸铜
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐3】某化学兴趣小组为探究SO2的性质,按下图所示装置进行实验。
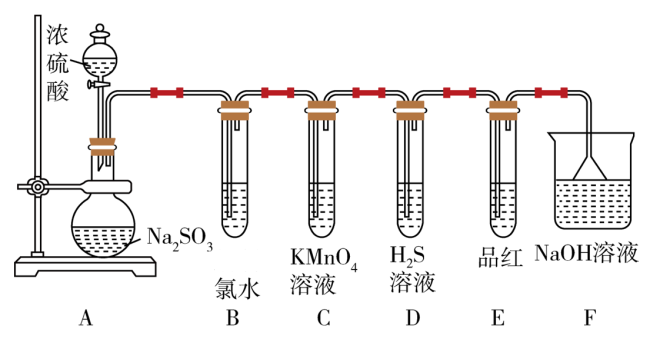
(已知:Na2SO3+H2SO4=Na2SO4+SO2↑+H2O)
(1)装置A中盛放浓硫酸和亚硫酸钠的仪器名称分别是_______ 、_______ ;
(2)反应后,装置B中反应的离子方程式为_______ ;装置C中发生反应的化学方程式为5SO2+2KMnO4+2H2O=K2SO4+2MnSO4+2H2SO4;请用双线桥标出电子转移的方向和数目_______ ;装置D中发生反应的化学方程式为_______ ;
(3)装置E的目的是探究SO2与品红作用的可逆性,请写出实验操作及现象_______ ;
(4)F装置的作用是_______ ,写出发生的化学反应方程式:_______ ,其中漏斗的作用是_______ 。

(已知:Na2SO3+H2SO4=Na2SO4+SO2↑+H2O)
(1)装置A中盛放浓硫酸和亚硫酸钠的仪器名称分别是
(2)反应后,装置B中反应的离子方程式为
(3)装置E的目的是探究SO2与品红作用的可逆性,请写出实验操作及现象
(4)F装置的作用是
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
【推荐1】A、B、C、D、E是五种短周期主族元素,其中A、B、D、E的原子序数依次增大,E的单质及某种氧化物是常用的饮用水消毒剂。它们的单质及某些化合物问存在如下转化关系,其中q是与人类生活密切相关的液态化合物,由A、B两元素所形成,它们之间右如下转化关系(反应条件省略):

(1)E的最高价氧化物对应水化物的化学式为_______ 。 A、B两元素形成如另一种化合物具有较强的氧化性,用相应的离子方程式加以证明:___________ 。
(2)若化合物Ⅳ是含有两种常见金属元素的盐,则化合物Ⅱ的电子式为________ ,生成化合物Ⅳ时反应的离子方程式为_____________ 。
(3)若在常温下化合物Ⅰ、Ⅱ均为气体,且D的单质与化合物Ⅲ浓溶液混合无明显变化但与化合物Ⅲ的稀溶液混合后有无色气体产生,该气体遇空气变为红棕色。
①从物质结构角度解释C的单质在常温下化学性质很稳定的原因是_________ 。
②由D单质、石墨、化合物Ⅲ的稀溶液构成的原电池中,正极上的电极反应式为________ 。

(1)E的最高价氧化物对应水化物的化学式为
(2)若化合物Ⅳ是含有两种常见金属元素的盐,则化合物Ⅱ的电子式为
(3)若在常温下化合物Ⅰ、Ⅱ均为气体,且D的单质与化合物Ⅲ浓溶液混合无明显变化但与化合物Ⅲ的稀溶液混合后有无色气体产生,该气体遇空气变为红棕色。
①从物质结构角度解释C的单质在常温下化学性质很稳定的原因是
②由D单质、石墨、化合物Ⅲ的稀溶液构成的原电池中,正极上的电极反应式为
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
解题方法
【推荐2】现有金属单质A、B、C和气体甲、乙、丙以及物质D、E、F、G、H,它们之间的相互转化关系如图所示(图中有些反应的生成物和反应的条件没有标出)。提示:黄绿色气体乙是氯气。
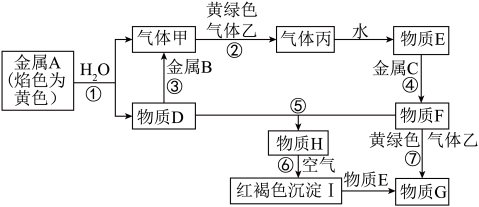
请回答下列问题:
(1)写出下列物质的化学式:B______ ,丙______ ,H______ 。
(2)根据要求回答:
①D溶液和F溶液在空气中混合的现象:_______ ;
②反应③离子方程式________ ;
③反应⑦离子方程式________ ;
④反应⑥化学方程式________ 。

请回答下列问题:
(1)写出下列物质的化学式:B
(2)根据要求回答:
①D溶液和F溶液在空气中混合的现象:
②反应③离子方程式
③反应⑦离子方程式
④反应⑥化学方程式
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
【推荐3】如表列出了①~⑦七种元素在周期表中的位置:
请按要求回答下列问题:
(1)元素③的原子结构示意图是___________ ,以上元素的最高价氧化物形成的水化物酸性最强的是___________ (填分子式)。
(2)②、③、⑥三种元素的原子形成的简单离子半径由大到小的顺序为___________ (用离子符号表示)。
(3)向元素②的单质与水反应后的溶液中加入元素④的单质,发生反应的化学方程式为___________ 。
(4)②和⑦按原子个数比 1:1 形成离子化合物乙的电子式为___________
(5)下列物质中,互为同素异形体的是___________ ,属于同位素的 ___________ 。
①正戊烷②白磷③ ④
④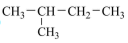 ⑤
⑤ Cl⑥红磷⑦
Cl⑥红磷⑦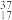 Cl
Cl
| IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 | |
| 二 | ① | ⑦ | ||||||
| 三 | ② | ③ | ④ | ⑤ | ⑥ |
(1)元素③的原子结构示意图是
(2)②、③、⑥三种元素的原子形成的简单离子半径由大到小的顺序为
(3)向元素②的单质与水反应后的溶液中加入元素④的单质,发生反应的化学方程式为
(4)②和⑦按原子个数比 1:1 形成离子化合物乙的电子式为
(5)下列物质中,互为同素异形体的是
①正戊烷②白磷③
 ④
④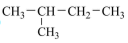 ⑤
⑤ Cl⑥红磷⑦
Cl⑥红磷⑦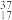 Cl
Cl
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
【推荐1】有关元素X、Y、D、E的信息如表:
请回答下列问题:
(1)D在元素周期表中的位置为___________ 。
(2)X、Y、D形成的简单离子的半径由大到小为___________ 。
(3)X的一种氢化物可用于实验室制取X的单质,其反应的化学方程式为___________ 。
(4)D的单质溶于强碱的离子方程式为___________ 。
(5)X、Y元素形成简单气态氢化物的稳定性:___________ >___________ (填化学式)。
(6)E元素与Y元素可形成EY2和EY3两种化合物,下列说法正确的是___________ (填序号)。
①保存EY2溶液时,需向溶液加入少量E单质
②EY2、EY3均能通过化合反应生成
③向煮沸的NaOH溶液中滴加几滴饱和EY3溶液,可以制得胶体
| 元素 | 有关信息 |
| X | 地壳中含量最高的元素 |
| Y | 第三周期中原子半径最小的主族元素 |
| D | 最高价氧化物既能溶于强酸又能溶于强碱 |
| E | 单质是生活中常见金属,其制品在潮湿空气中易被腐蚀或损坏 |
(1)D在元素周期表中的位置为
(2)X、Y、D形成的简单离子的半径由大到小为
(3)X的一种氢化物可用于实验室制取X的单质,其反应的化学方程式为
(4)D的单质溶于强碱的离子方程式为
(5)X、Y元素形成简单气态氢化物的稳定性:
(6)E元素与Y元素可形成EY2和EY3两种化合物,下列说法正确的是
①保存EY2溶液时,需向溶液加入少量E单质
②EY2、EY3均能通过化合反应生成
③向煮沸的NaOH溶液中滴加几滴饱和EY3溶液,可以制得胶体
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
解题方法
【推荐2】已知A为常见的金属单质,根据下图所示的关系回答下列问题。
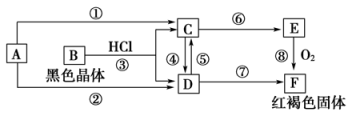
(1)确定B、D、E的化学式,B为________ ,D为________ ,E为________ 。
(2)写出⑧的化学方程式及④⑤的离子方程式:_________________________ ,___________________ , ________________________ 。

(1)确定B、D、E的化学式,B为
(2)写出⑧的化学方程式及④⑤的离子方程式:
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
解题方法
【推荐3】A、B、C为中学常见单质,其中一种为金属,通常情况下,A为固体,B为黄绿色气体,C为无色气体。D、E、F、G、H、X均为化合物,其中X常温下是无色气体,其水溶液是一种强酸,E为黑色固体,H在常温下为液体。它们之间的转化关系如图所示(其中某些反应条件和部分反应物已略去)。
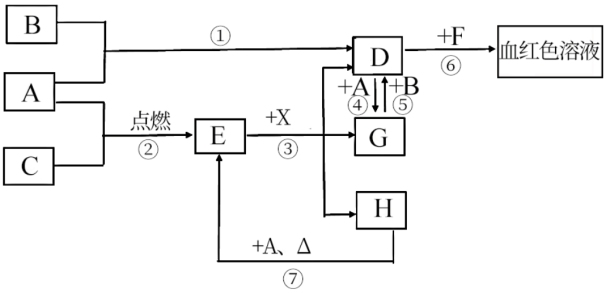
请回答下列问题:
(1)写出下列物质的化学式:D_______ 、X_______ 。
(2)在反应①~⑦中,不属于氧化还原反应的是_______ 。
(3)反应④的离子方程式是_______ ;
(4)反应⑦的化学方程式是:_______ ;该反应中每消耗0.3mol的A,可转移电子_______ mol。
(5)除去D溶液中混有的少量G的方法是_______ 。
(6)检验G溶液中阳离子的方法是_______ 。

请回答下列问题:
(1)写出下列物质的化学式:D
(2)在反应①~⑦中,不属于氧化还原反应的是
(3)反应④的离子方程式是
(4)反应⑦的化学方程式是:
(5)除去D溶液中混有的少量G的方法是
(6)检验G溶液中阳离子的方法是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐1】 是医药、卫生行业上广泛使用的消毒剂。某课外小组采用滴定法测定某医用消毒剂中
是医药、卫生行业上广泛使用的消毒剂。某课外小组采用滴定法测定某医用消毒剂中 的浓度。实验步骤如下:
的浓度。实验步骤如下:
①标准液的配制和标定:称取一定量 固体溶于水,避光放置
固体溶于水,避光放置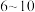 天,过滤并取滤液于滴定管中待用,称取
天,过滤并取滤液于滴定管中待用,称取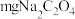 (摩尔质量为
(摩尔质量为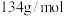 )固体于锥形瓶中,加水溶解,再加
)固体于锥形瓶中,加水溶解,再加 酸化,滴定至终点,消耗
酸化,滴定至终点,消耗 溶液的体积为
溶液的体积为 ,滴定过程中发生的反应为
,滴定过程中发生的反应为 。
。
② 浓度的测定:取待测样品
浓度的测定:取待测样品 稀释至
稀释至 ,再移取
,再移取 于锥形瓶中,加
于锥形瓶中,加 酸化,用上述
酸化,用上述 标准液滴定至终点,消耗溶液的体积为
标准液滴定至终点,消耗溶液的体积为 。
。
回答下列问题:
(1)②中移取 待测液
待测液 所用主要仪器名称为
所用主要仪器名称为_______ 。
(2)标定 标准液时需要控制温度为
标准液时需要控制温度为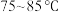 ,温度过低反应较慢,温度过高可能会因
,温度过低反应较慢,温度过高可能会因_______ 而导致 标准液的标定浓度偏高。
标准液的标定浓度偏高。
(3) 标准液滴定
标准液滴定 的离子方程式为
的离子方程式为_______ ;滴定过程中,眼睛应注视______ ;当滴定到______ 时,可以认为已达到滴定终点。
(4)该医用消毒剂中 的物质的量浓度为
的物质的量浓度为______  。
。
(5)②中若用盐酸代替 ,测定结果将
,测定结果将______ (填“偏高”“偏低”或“无影响”)。
 是医药、卫生行业上广泛使用的消毒剂。某课外小组采用滴定法测定某医用消毒剂中
是医药、卫生行业上广泛使用的消毒剂。某课外小组采用滴定法测定某医用消毒剂中 的浓度。实验步骤如下:
的浓度。实验步骤如下:①标准液的配制和标定:称取一定量
 固体溶于水,避光放置
固体溶于水,避光放置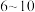 天,过滤并取滤液于滴定管中待用,称取
天,过滤并取滤液于滴定管中待用,称取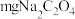 (摩尔质量为
(摩尔质量为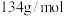 )固体于锥形瓶中,加水溶解,再加
)固体于锥形瓶中,加水溶解,再加 酸化,滴定至终点,消耗
酸化,滴定至终点,消耗 溶液的体积为
溶液的体积为 ,滴定过程中发生的反应为
,滴定过程中发生的反应为 。
。②
 浓度的测定:取待测样品
浓度的测定:取待测样品 稀释至
稀释至 ,再移取
,再移取 于锥形瓶中,加
于锥形瓶中,加 酸化,用上述
酸化,用上述 标准液滴定至终点,消耗溶液的体积为
标准液滴定至终点,消耗溶液的体积为 。
。回答下列问题:
(1)②中移取
 待测液
待测液 所用主要仪器名称为
所用主要仪器名称为(2)标定
 标准液时需要控制温度为
标准液时需要控制温度为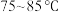 ,温度过低反应较慢,温度过高可能会因
,温度过低反应较慢,温度过高可能会因 标准液的标定浓度偏高。
标准液的标定浓度偏高。(3)
 标准液滴定
标准液滴定 的离子方程式为
的离子方程式为(4)该医用消毒剂中
 的物质的量浓度为
的物质的量浓度为 。
。(5)②中若用盐酸代替
 ,测定结果将
,测定结果将
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐2】大量燃放鞭炮会引起空气中SO2等有害气体含量增高,造成大气污染。某兴趣小组欲探究SO2的性质,并利用SO2制备食品抗氧化剂焦亚硫酸钠(Na2S2O5)。已知Na2S2O5溶于水即生成NaHSO3。
(1)制取SO2并探究其性质

①装置A1中发生反应的化学方程式为_______ 。
②装置B用于检验SO2的漂白性,其中所盛试剂为_______ ,装置C中发生反应的SO2和H2S的物质的量之比为_______ 。
③为了实现绿色环保的目标,甲同学欲用装置A2代替装置A1,你认为装置A2除具有绿色环保的优点外,还具有的优点是_______ (任写一点)。
(2)制备焦亚硫酸钠并测定其含量
①将SO2通入Na2SO3制取Na2S2O5,发生的反应为Na2SO3+SO2=Na2S2O5,该反应为_______ (填“氧化还原反应”或“非氧化还原反应”)。
②测定某葡萄酒中Na2S2O5残留量的方案为:取葡萄酒样品100.00mL,加入盐酸充分蒸馏。将馏分用0.0100mol/L标准I2溶液进行滴定(反应方程式为SO2+I2+2H2O=H2SO4+2HI),消耗标准I2溶液25.00mL。
计算样品中抗氧化剂的残留量(以SO2计)为_______ g•L-1(写出计算过程)。
(1)制取SO2并探究其性质

①装置A1中发生反应的化学方程式为
②装置B用于检验SO2的漂白性,其中所盛试剂为
③为了实现绿色环保的目标,甲同学欲用装置A2代替装置A1,你认为装置A2除具有绿色环保的优点外,还具有的优点是
(2)制备焦亚硫酸钠并测定其含量
①将SO2通入Na2SO3制取Na2S2O5,发生的反应为Na2SO3+SO2=Na2S2O5,该反应为
②测定某葡萄酒中Na2S2O5残留量的方案为:取葡萄酒样品100.00mL,加入盐酸充分蒸馏。将馏分用0.0100mol/L标准I2溶液进行滴定(反应方程式为SO2+I2+2H2O=H2SO4+2HI),消耗标准I2溶液25.00mL。
计算样品中抗氧化剂的残留量(以SO2计)为
您最近一年使用:0次




