酸碱滴定法与氧化还原滴定法均为重要的定量分析法,应用广泛。回答下列问题:
I.酸碱中和滴定
选择酚酞作指示剂,用标准NaOH溶液测定白醋中醋酸的浓度,以检测白醋是否符合国家标准。测定过程如图所示:

已知:国家标准规定酿造白醋中醋酸含量不得低于 。
。
(1)①滴定达到终点时的现象是滴入半滴标准NaOH溶液后_______ 。
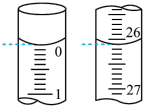
②某次实验滴定开始和结束时。碱式滴定管中的液面如图所示,则消耗NaOH溶液的体积为_______ mL。
③已知实验所用标准NaOH溶液的浓度为 ,根据上述滴定结果可知该白醋
,根据上述滴定结果可知该白醋_______ (填“符合”或“不符合”)国家标准。
④下列操作中,可能使所测白醋中醋酸的浓度数值偏低的是_______ (填编号)。
A.碱式滴定管未用标准NaOH溶液润洗就直接注入标准NaOH溶液
B.滴定前盛放白醋稀溶液的锥形瓶用蒸馏水洗净后没有干燥
C.滴定过程中摇动锥形瓶时有液滴溅出
D.读取NaOH溶液体积时,开始时仰视读数,滴定结束时俯视读数
E.碱式滴定管在滴定前有气泡,滴定后气泡消失
(2)若用 NaOH溶液分别滴定体积均为20.00mL、浓度均为
NaOH溶液分别滴定体积均为20.00mL、浓度均为 的盐酸和醋酸溶液,得到滴定过程中pH随加入NaOH溶液体积而变化的两条滴定曲线如图所示。
的盐酸和醋酸溶液,得到滴定过程中pH随加入NaOH溶液体积而变化的两条滴定曲线如图所示。

①滴定醋酸的曲线是_______ (填“I”或“II”)。
② 和
和 的关系:
的关系:
_______  (填“>”“=”或“<”)。
(填“>”“=”或“<”)。
II.氧化还原滴定
(3) 的纯度(杂质不参与反应)通常利用“间接碘量法”测定。已知:
的纯度(杂质不参与反应)通常利用“间接碘量法”测定。已知:
 。步骤如下:
。步骤如下:
①称取1.250g胆矾产品配成100mL溶液;
②取其中25.00mL溶液,滴加KI溶液至不再产生沉淀;
③用
 标准溶液滴定,平行滴定3次。
标准溶液滴定,平行滴定3次。
若 标准溶液的平均用量为10.00mL,则胆矾产品纯度为
标准溶液的平均用量为10.00mL,则胆矾产品纯度为_______ %。
I.酸碱中和滴定
选择酚酞作指示剂,用标准NaOH溶液测定白醋中醋酸的浓度,以检测白醋是否符合国家标准。测定过程如图所示:

已知:国家标准规定酿造白醋中醋酸含量不得低于
 。
。(1)①滴定达到终点时的现象是滴入半滴标准NaOH溶液后
②某次实验滴定开始和结束时。碱式滴定管中的液面如图所示,则消耗NaOH溶液的体积为

③已知实验所用标准NaOH溶液的浓度为
 ,根据上述滴定结果可知该白醋
,根据上述滴定结果可知该白醋④下列操作中,可能使所测白醋中醋酸的浓度数值偏低的是
A.碱式滴定管未用标准NaOH溶液润洗就直接注入标准NaOH溶液
B.滴定前盛放白醋稀溶液的锥形瓶用蒸馏水洗净后没有干燥
C.滴定过程中摇动锥形瓶时有液滴溅出
D.读取NaOH溶液体积时,开始时仰视读数,滴定结束时俯视读数
E.碱式滴定管在滴定前有气泡,滴定后气泡消失
(2)若用
 NaOH溶液分别滴定体积均为20.00mL、浓度均为
NaOH溶液分别滴定体积均为20.00mL、浓度均为 的盐酸和醋酸溶液,得到滴定过程中pH随加入NaOH溶液体积而变化的两条滴定曲线如图所示。
的盐酸和醋酸溶液,得到滴定过程中pH随加入NaOH溶液体积而变化的两条滴定曲线如图所示。
①滴定醋酸的曲线是
②
 和
和 的关系:
的关系:
 (填“>”“=”或“<”)。
(填“>”“=”或“<”)。II.氧化还原滴定
(3)
 的纯度(杂质不参与反应)通常利用“间接碘量法”测定。已知:
的纯度(杂质不参与反应)通常利用“间接碘量法”测定。已知:
 。步骤如下:
。步骤如下:①称取1.250g胆矾产品配成100mL溶液;
②取其中25.00mL溶液,滴加KI溶液至不再产生沉淀;
③用

 标准溶液滴定,平行滴定3次。
标准溶液滴定,平行滴定3次。若
 标准溶液的平均用量为10.00mL,则胆矾产品纯度为
标准溶液的平均用量为10.00mL,则胆矾产品纯度为
更新时间:2023-01-03 19:18:21
|
相似题推荐
解答题-实验探究题
|
较难
(0.4)
名校
【推荐1】碘是人体不可缺少的微量元素,也是制造各种无机及有机碘化物的重要原料。
(1)采用离子交换法从卤水(含有I-)中提取碘的工艺流程如下:
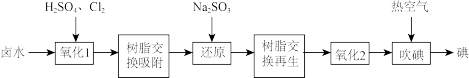
①树脂吸附原理是将氧化生成的In-与树脂中的阴离子发生交换。写出“氧化1”步骤中生成In-的离子反应方程式为_______ 。
②还原前对树脂进行处理。证明“还原”时Na2SO3被氧化的实验操作是_______ 。
(2)实验室中,可采用如图昕示装置制取碘。

①实验中,冷凝管中的冷凝水通常从a端通入,其目的是_______ 。
②该实验温度控制在40℃左右的原因_______ 。
(3)为测定卤水样品中I的含量,进行下列实验:
①取100.00 mL卤水样品减压浓缩垒20.00 mL,加入过量的0.1500 mol·L-1 CuCl2溶液20.00mL。(发生反应为2Cu2++4I-=I2+2CuI↓)。
②密封静置2h,生成白色沉淀,过滤。
③用0.1000 mol·L-1 Na2S2O3标准溶液进行滴定。(反应I2+2S2O =2I-+S4O
=2I-+S4O )
)
请补充完整滴定过程的有关实验操作:将过滤所得的滤液全部转移至锥形瓶中,_______ ;向洗涤干净的碱式滴定管中加入Na2S2O3标准溶液,_______ ,边振荡边逐滴加入标准溶液,观察锥形瓶中溶液颜色变化,直至_______ ,停止滴定,读数并记录数据。
(4)实验测得消耗Na2S2O3溶液的体积为22.00 mL。计算卤水样品中I-的物质的量浓度_______ (写出计算过程)。
(1)采用离子交换法从卤水(含有I-)中提取碘的工艺流程如下:
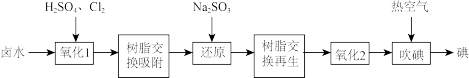
①树脂吸附原理是将氧化生成的In-与树脂中的阴离子发生交换。写出“氧化1”步骤中生成In-的离子反应方程式为
②还原前对树脂进行处理。证明“还原”时Na2SO3被氧化的实验操作是
(2)实验室中,可采用如图昕示装置制取碘。

①实验中,冷凝管中的冷凝水通常从a端通入,其目的是
②该实验温度控制在40℃左右的原因
(3)为测定卤水样品中I的含量,进行下列实验:
①取100.00 mL卤水样品减压浓缩垒20.00 mL,加入过量的0.1500 mol·L-1 CuCl2溶液20.00mL。(发生反应为2Cu2++4I-=I2+2CuI↓)。
②密封静置2h,生成白色沉淀,过滤。
③用0.1000 mol·L-1 Na2S2O3标准溶液进行滴定。(反应I2+2S2O
 =2I-+S4O
=2I-+S4O )
)请补充完整滴定过程的有关实验操作:将过滤所得的滤液全部转移至锥形瓶中,
(4)实验测得消耗Na2S2O3溶液的体积为22.00 mL。计算卤水样品中I-的物质的量浓度
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
名校
【推荐2】实验室常利用甲醛法测定(NH4)2SO4样品中氮的质量分数,其反应原理为:4NH4++6HCHO=3H++6H2O+(CH2)6N4H+ ,然后用NaOH标准溶液滴定反应生成的酸,某兴趣小组用甲醛法进行了如下实验:
步骤I 称取样品1.500g。
步骤II 将样品溶解后,完全转移到250 mL容量瓶中,定容,充分摇匀。
步骤Ⅲ 移取25.00mL样品溶液于250mL锥形瓶中,加入10mL20%的中性甲醛溶液,摇匀、静置5 min后,加入1~2滴酚酞试液,用NaOH标准溶液滴定至终点。按上述操作方法再重复2次。
(1)根据步骤Ⅲ填空:
①到达滴定终点时,俯视碱式滴定管读数,则测得样品中氮的质量分数________ (填“偏高”、“偏低”或“无影响”)。
②达到滴定终点时,发现碱式滴定管的尖端有气泡,则滴定时用去NaOH标准溶液的体积__________ (填“偏大”、“偏小”或“无影响”)
③滴定时边滴边摇动锥形瓶,眼睛应观察___________
④滴定达到终点判断:__________________________________________
(2)滴定结果如下表所示:
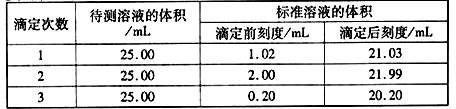
若NaOH标准溶液的浓度为0.1010mol·L-1则该样品中氮的质量分数为______________
步骤I 称取样品1.500g。
步骤II 将样品溶解后,完全转移到250 mL容量瓶中,定容,充分摇匀。
步骤Ⅲ 移取25.00mL样品溶液于250mL锥形瓶中,加入10mL20%的中性甲醛溶液,摇匀、静置5 min后,加入1~2滴酚酞试液,用NaOH标准溶液滴定至终点。按上述操作方法再重复2次。
(1)根据步骤Ⅲ填空:
①到达滴定终点时,俯视碱式滴定管读数,则测得样品中氮的质量分数
②达到滴定终点时,发现碱式滴定管的尖端有气泡,则滴定时用去NaOH标准溶液的体积
③滴定时边滴边摇动锥形瓶,眼睛应观察
④滴定达到终点判断:
(2)滴定结果如下表所示:

若NaOH标准溶液的浓度为0.1010mol·L-1则该样品中氮的质量分数为
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
解题方法
【推荐3】某学习小组为了探究 CH3COOH 的电离情况,进行了如下实验。
【实验一】配制并测定醋酸中 CH3COOH 的浓度。
将 0.2mol/L 醋酸稀释,并用 0.1000mol/L NaOH 溶液滴定 20.00mL 稀释后的溶液。4 次滴定消耗 NaOH 溶液的体积如下:
(1)该滴定涉及的离子反应方程式为__________________ 。
(2)滴定时量取 20.00ml 的待测液,选择的仪器为_______________ 。
A.酸式滴定管 B.碱式滴定管 C.量筒
(3)滴定时加入的指示剂为_______________ ,到达滴定终点的判断:_______________ 。
(4)该醋酸中 CH3COOH 的物质的量浓度为_______________ 。
(5)下列操作会导致测定 CH3COOH 的浓度偏低的是_______________。
【实验二】探究浓度对 CH3COOH 电离的影响。
用 PH 计测定 25℃时不同浓度的醋酸的 PH,结果如下:
(6)根据表中数据可以得出 CH3COOH 是弱电解质的结论,你认为得出此结论的依据是 _______________ 。
(7)根据表中数据还可以得出另一个结论:随着溶液中 CH3COOH 浓度的减小,CH3COOH 的电离程度将_______________ (填“增大”“减小”或“不变”)。
【实验一】配制并测定醋酸中 CH3COOH 的浓度。
将 0.2mol/L 醋酸稀释,并用 0.1000mol/L NaOH 溶液滴定 20.00mL 稀释后的溶液。4 次滴定消耗 NaOH 溶液的体积如下:
| 试验次数 | 1 | 2 | 3 | 4 |
| 消耗NaOH溶液的体积/mL | 20.05 | 20.00 | 18.40 | 19.95 |
(2)滴定时量取 20.00ml 的待测液,选择的仪器为
A.酸式滴定管 B.碱式滴定管 C.量筒
(3)滴定时加入的指示剂为
(4)该醋酸中 CH3COOH 的物质的量浓度为
(5)下列操作会导致测定 CH3COOH 的浓度偏低的是_______________。
| A.酸式滴定管洗净后未用待装液润洗 |
| B.滴定前碱式滴定管尖端处有气泡,滴定后气泡消失 |
| C.摇动锥形瓶用力过猛,使少量溶液溅出 |
| D.滴定前仰视读数,滴定完毕俯视读数 |
【实验二】探究浓度对 CH3COOH 电离的影响。
用 PH 计测定 25℃时不同浓度的醋酸的 PH,结果如下:
| 浓度/(mol/L) | 0.0010 | 0.0100 | 0.0200 | 0.100 | 0.200 |
| PH | 3.88 | 3.38 | 3.23 | 2.88 | 2.83 |
(7)根据表中数据还可以得出另一个结论:随着溶液中 CH3COOH 浓度的减小,CH3COOH 的电离程度将
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
名校
【推荐1】已知:2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O.
某化学小组根据上述反应原理进行下列实验:
I.测定H2C2O4溶液的物质的量浓度
实验步骤如下:
①取待测H2C2O4溶液25.00mL放入锥形瓶中,再加入适量的稀硫酸;
②用0.1mol/L KMnO4溶液滴定至终点,记录数据;
③重复滴定2次,平均消耗KMnO4溶液20.00mL。
请回答:
(1)滴定时,将KMnO4溶液装在______ (填“酸式”或“碱式”)滴定管中。
(2)若在步骤①操作之前,先用待测H2C2O4溶液润洗锥形瓶,则测得H2C2O4溶液的浓度会______ (填“偏大”“偏小”或“无影响”)。
(3)步骤②中到达滴定终点时的现象为_______________________________ 。
(4)计算H2C2O4溶液的物质的量浓度为__________ mol/L。
Ⅱ.探究反应物浓度对化学反应速率的影响设计如下实验方案(实验温度均为25℃):
请回答:
(5)表中v1=______ 。
(6)实验中需要测量的数据是______________________________ 。
(7)实验中______ (填“能”或“不能”)用0.2mol/L盐酸代替0.1mol/LH2SO4溶液,理由是_________ 。
某化学小组根据上述反应原理进行下列实验:
I.测定H2C2O4溶液的物质的量浓度
实验步骤如下:
①取待测H2C2O4溶液25.00mL放入锥形瓶中,再加入适量的稀硫酸;
②用0.1mol/L KMnO4溶液滴定至终点,记录数据;
③重复滴定2次,平均消耗KMnO4溶液20.00mL。
请回答:
(1)滴定时,将KMnO4溶液装在
(2)若在步骤①操作之前,先用待测H2C2O4溶液润洗锥形瓶,则测得H2C2O4溶液的浓度会
(3)步骤②中到达滴定终点时的现象为
(4)计算H2C2O4溶液的物质的量浓度为
Ⅱ.探究反应物浓度对化学反应速率的影响设计如下实验方案(实验温度均为25℃):
| 实验序号 | 体积V/mL | |||
| 0.1mol•L-1KMnO4溶液 | 0.11mol•L-1H2C2O4溶液 | 0.11mol•L-1H2SO4溶液 | H2O | |
| ① | 2.0 | 5.0 | 6.0 | 7.0 |
| ② | 2.0 | 8.0 | 6.0 | V1 |
| ③ | 2.0 | V2 | 6.0 | 2.0 |
(5)表中v1=
(6)实验中需要测量的数据是
(7)实验中
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
名校
【推荐2】科学界目前流行的关于生命起源理论认为生命起源于约40亿年前古洋底的热液环境,那里普遍存在铁硫族化合物(用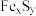 表示),为探究其组成,某小组设计了如下实验:
表示),为探究其组成,某小组设计了如下实验:

已知:i.样品中杂质不溶于水、盐酸,且不参与装置C中反应;
ii. 在稀溶液中近手无色。
在稀溶液中近手无色。
实验步骤:
①按图连接装置,进行气密性检查,然后装入相应的药品;
②通入氧气并加热,装置C中固体逐渐转变为红棕色;
③待固体完全转化后,取装置D中的溶液 于锥形瓶中,用
于锥形瓶中,用 的草酸溶液滴定未反应完的高锰酸钾,平均消耗草酸溶液
的草酸溶液滴定未反应完的高锰酸钾,平均消耗草酸溶液 (装置D中溶液体积反应前后不变);
(装置D中溶液体积反应前后不变);
④取装置C中的残留固体于烧杯中,加入稀盐酸,充分搅拌后过滤;
⑤向滤液中加入足量氢氧化钠溶液,出现沉淀。过滤后取滤渣灼烧,得 固体。
固体。
(1)A为 发生装置,则试剂a、b可以分别是
发生装置,则试剂a、b可以分别是___________ 。该铁硫簇化合物与 反应的产物的化学式为:
反应的产物的化学式为:___________ 。
(2)装置E中品红溶液的作用是___________ 。
(3)实验步骤③中取装置D中的溶液 于锥形瓶所用的量取仪器是
于锥形瓶所用的量取仪器是___________ ,写出草酸溶液滴定酸性高锰酸钾溶液时反应的离子方程式:___________ 。
(4)为防止污染,F中试剂应为___________ ,步骤⑤中灼烧滤渣应在___________ 进行(填仪器名称)。
(5)若配制草酸标准液时,定容操作俯视刻度线,则导致x:y的值___________ (填“偏大”“偏小”。)
(6)若实验完成时装置E中品红溶液无变化,根据上述实验所得数据,可确定该铁硫簇化合物的化学式为___________ 。
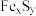 表示),为探究其组成,某小组设计了如下实验:
表示),为探究其组成,某小组设计了如下实验:
已知:i.样品中杂质不溶于水、盐酸,且不参与装置C中反应;
ii.
 在稀溶液中近手无色。
在稀溶液中近手无色。实验步骤:
①按图连接装置,进行气密性检查,然后装入相应的药品;
②通入氧气并加热,装置C中固体逐渐转变为红棕色;
③待固体完全转化后,取装置D中的溶液
 于锥形瓶中,用
于锥形瓶中,用 的草酸溶液滴定未反应完的高锰酸钾,平均消耗草酸溶液
的草酸溶液滴定未反应完的高锰酸钾,平均消耗草酸溶液 (装置D中溶液体积反应前后不变);
(装置D中溶液体积反应前后不变); ④取装置C中的残留固体于烧杯中,加入稀盐酸,充分搅拌后过滤;
⑤向滤液中加入足量氢氧化钠溶液,出现沉淀。过滤后取滤渣灼烧,得
 固体。
固体。(1)A为
 发生装置,则试剂a、b可以分别是
发生装置,则试剂a、b可以分别是 反应的产物的化学式为:
反应的产物的化学式为:(2)装置E中品红溶液的作用是
(3)实验步骤③中取装置D中的溶液
 于锥形瓶所用的量取仪器是
于锥形瓶所用的量取仪器是(4)为防止污染,F中试剂应为
(5)若配制草酸标准液时,定容操作俯视刻度线,则导致x:y的值
(6)若实验完成时装置E中品红溶液无变化,根据上述实验所得数据,可确定该铁硫簇化合物的化学式为
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
名校
【推荐3】用0.1320mol/L的HCl溶液滴定未知浓度的NaOH溶液,实验数据如下表所示,
回答下列问题:
(1)如图中甲为___________ 滴定管,乙为_________ 滴定管(填“酸式”或“碱式 ”)

(2)实验中,需要润洗的仪器是:________________________
(3)取待测液NaOH溶液25.00ml 于锥形瓶中,使用酚酞做指示剂。滴定终点的判断依据是________________________________________
(4)若滴定前,滴定管尖端有气泡,滴定后气泡消失,将使所测结果____________ (填“偏高”“偏低”“不变”,下同);若读酸式滴定管读数时,滴定前仰视读数,滴定后正确读数,则所测结果___________ 。
(5) 未知浓度的NaOH溶液的物质的量浓度为_____________ mol/l。
| 实验编号 | 待测NaOH溶液的体积/mL | HCl溶液的体积/mL |
| 1 | 25.00 | 24.41 |
| 2 | 25.00 | 24.39 |
| 3 | 25.00 | 24.60 |
(1)如图中甲为

(2)实验中,需要润洗的仪器是:
(3)取待测液NaOH溶液25.00ml 于锥形瓶中,使用酚酞做指示剂。滴定终点的判断依据是
(4)若滴定前,滴定管尖端有气泡,滴定后气泡消失,将使所测结果
(5) 未知浓度的NaOH溶液的物质的量浓度为
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
解题方法
【推荐1】氯化苄(C6H5CH2Cl)是一种重要的有机化学原料。工业上采用甲苯与干燥氯气在光照条件下反应合成氯化苄。
(1)写出实验室制取氯气的化学方程式___ 。
(2)用下列方法分析氯化苄粗产品的纯度。
步骤1:称取5.11g样品于烧瓶中,加入200.00mL4mol/L氢氧化钠溶液共热,冷却至室温。加入 200.00mL4mol/L硝酸,一段时间后,将烧瓶中的溶液全部转移至250.00 mL 的容量瓶中,加水定容。
步骤Ⅱ:从能瓶中各収25.00 mL溶液于三只锥形瓶中,各加入25.00 mL0.2000mol/L硝酸银溶液。
步骤Ⅲ:以硫酸铁铵作指示剂,用0.2000 mol/LNH4SCN溶液分别滴定剩余的硝酸银,所得滴定数据如下表。
①加入硝酸的目的是_________ 。
②在步骤Ⅲ操作中,判断达到滴定终点的现象是_______ 。
③该样品中氯化苄的质量分数(写出计算过程)__________ 。
④上述测定结见迎常商于氯化苄中筑元素的理论含量,原因是_______ 。
(1)写出实验室制取氯气的化学方程式
(2)用下列方法分析氯化苄粗产品的纯度。
步骤1:称取5.11g样品于烧瓶中,加入200.00mL4mol/L氢氧化钠溶液共热,冷却至室温。加入 200.00mL4mol/L硝酸,一段时间后,将烧瓶中的溶液全部转移至250.00 mL 的容量瓶中,加水定容。
步骤Ⅱ:从能瓶中各収25.00 mL溶液于三只锥形瓶中,各加入25.00 mL0.2000mol/L硝酸银溶液。
步骤Ⅲ:以硫酸铁铵作指示剂,用0.2000 mol/LNH4SCN溶液分别滴定剩余的硝酸银,所得滴定数据如下表。
实验数据 实验序号 | NH4SCN溶液体积读书/mL | |
| 滴定前 | 滴定后 | |
| 第一次 | 0.40 | 10.38 |
| 第二次 | 0.30 | 10.32 |
| 第三次 | 0.20 | 10.41 |
②在步骤Ⅲ操作中,判断达到滴定终点的现象是
③该样品中氯化苄的质量分数(写出计算过程)
④上述测定结见迎常商于氯化苄中筑元素的理论含量,原因是
您最近一年使用:0次
【推荐2】用0.1320mol/L的HCl溶液滴定未知浓度的NaOH溶液,实验数据如下表所示:
回答下列问题:
(1)如图中甲为___________ 滴定管,(填“酸式”或“碱式”)。

(2)若滴定前,滴定管尖端有气泡,滴定后气泡消失,将使所测结果___________ (填“偏高”“偏低”“不变”,下同);若读酸式滴定管读数时,滴定前仰视读数,滴定后正确读数,则导致所测结果___________ 。
(3)未知浓度的NaOH溶液的物质的量浓度为___________ mol/L。
(4)在化学分析中采用 为指示剂,以
为指示剂,以 标准溶液滴定溶液中的
标准溶液滴定溶液中的 ,利用
,利用 与
与 生成砖红色沉淀,指示到达滴定终点。当溶液中的
生成砖红色沉淀,指示到达滴定终点。当溶液中的 恰好完全沉淀
恰好完全沉淀 浓度等于
浓度等于 时,溶液中
时,溶液中 为
为___________ mol/L,此时溶液中 为
为____ mol/L。(已知 、
、 的
的 分别为
分别为 和2.0×10−10)。已知:难溶电解质
和2.0×10−10)。已知:难溶电解质 在常温下的Ksp=2.0×10−20,则常温下:某
在常温下的Ksp=2.0×10−20,则常温下:某 溶液中c(Cu2+)=0.02mol/L,如要生成
溶液中c(Cu2+)=0.02mol/L,如要生成 沉淀,应调整溶液的
沉淀,应调整溶液的 最小为
最小为___________ 。
| 实验编号 | 待测NaOH溶液的体积/mL | HCl溶液的体积/mL |
| 1 | 25.00 | 24.41 |
| 2 | 25.00 | 24.39 |
| 3 | 25.00 | 22.60 |
(1)如图中甲为

(2)若滴定前,滴定管尖端有气泡,滴定后气泡消失,将使所测结果
(3)未知浓度的NaOH溶液的物质的量浓度为
(4)在化学分析中采用
 为指示剂,以
为指示剂,以 标准溶液滴定溶液中的
标准溶液滴定溶液中的 ,利用
,利用 与
与 生成砖红色沉淀,指示到达滴定终点。当溶液中的
生成砖红色沉淀,指示到达滴定终点。当溶液中的 恰好完全沉淀
恰好完全沉淀 浓度等于
浓度等于 时,溶液中
时,溶液中 为
为 为
为 、
、 的
的 分别为
分别为 和2.0×10−10)。已知:难溶电解质
和2.0×10−10)。已知:难溶电解质 在常温下的Ksp=2.0×10−20,则常温下:某
在常温下的Ksp=2.0×10−20,则常温下:某 溶液中c(Cu2+)=0.02mol/L,如要生成
溶液中c(Cu2+)=0.02mol/L,如要生成 沉淀,应调整溶液的
沉淀,应调整溶液的 最小为
最小为
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
名校
【推荐3】硫酸四氨合铜晶体([Cu(NH3)4]SO4·H2O)常在工业上用途广泛。常温下该物质在空气中不稳定,受热时易发生分解。某小组拟合成硫酸四氨合铜晶体并测定其纯度。
I.CuSO4溶液的制备
①称取4g铜粉,在A仪器中灼烧10分钟并不断搅拌,放置冷却。
②在蒸发皿中加入30mL3mol/L的硫酸,将A中固体慢慢放入其中,加热并不断搅拌。
③趁热过滤得蓝色溶液。
(1)A仪器的名称为_______ ,相比用铜与浓硫酸直接反应制备硫酸铜,上述方法的优点是_______ 。
II.晶体的制备:将上述制备的CuSO4溶液按如图所示进行操作:
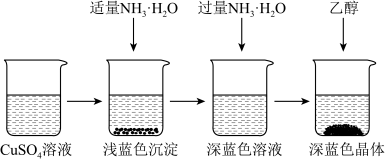
(2)已知浅蓝色沉淀的成分为Cu2(OH)2SO4,试写出生成此沉淀的离子反应方程式_______ 。
(3)析出晶体时采用加入乙醇的方法,而不是浓缩结晶的原因是_______ 。
III.氨含量的测定
精确称取wg晶体,加适量水溶解,注入如图所示的三颈瓶中,然后逐滴加入足量10%NaOH溶液,通入水蒸气,将样品液中的氨全部蒸出,并用蒸馏水冲洗导管内壁,用V1mL0.5mol/L的盐酸标准溶液完全吸收。取下接收瓶,用0.5mol/LNaOH标准溶液滴定过剩的HCl(选用甲基橙作指示剂),到终点时消耗V2mLNaOH溶液。

(4)装置1中长玻璃管的作用_______ ,样品中氨的质量分数的表达式_______ 。
(5)下列实验操作可能使氨含量测定结果偏高的原因是_______。
I.CuSO4溶液的制备
①称取4g铜粉,在A仪器中灼烧10分钟并不断搅拌,放置冷却。
②在蒸发皿中加入30mL3mol/L的硫酸,将A中固体慢慢放入其中,加热并不断搅拌。
③趁热过滤得蓝色溶液。
(1)A仪器的名称为
II.晶体的制备:将上述制备的CuSO4溶液按如图所示进行操作:

(2)已知浅蓝色沉淀的成分为Cu2(OH)2SO4,试写出生成此沉淀的离子反应方程式
(3)析出晶体时采用加入乙醇的方法,而不是浓缩结晶的原因是
III.氨含量的测定
精确称取wg晶体,加适量水溶解,注入如图所示的三颈瓶中,然后逐滴加入足量10%NaOH溶液,通入水蒸气,将样品液中的氨全部蒸出,并用蒸馏水冲洗导管内壁,用V1mL0.5mol/L的盐酸标准溶液完全吸收。取下接收瓶,用0.5mol/LNaOH标准溶液滴定过剩的HCl(选用甲基橙作指示剂),到终点时消耗V2mLNaOH溶液。

(4)装置1中长玻璃管的作用
(5)下列实验操作可能使氨含量测定结果偏高的原因是_______。
| A.滴定时未用NaOH标准溶液润洗滴定管 |
| B.读数时,滴定前平视,滴定后俯视 |
| C.滴定过程中选用酚酞作指示剂 |
| D.取下接收瓶前,未用蒸馏水冲洗插入接收瓶中的导管外壁 |
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐1】25℃时,现有浓度均为 的下列溶液
的下列溶液
①盐酸②醋酸③硫酸④氢氧化钠⑤氨水⑥醋酸铵⑦硫酸氢铵⑧氯化铵⑨碳酸氢铵请回答下列问题:
(1)①②③④⑤按PH由大到小的顺序是(填序号,下同)_____ 。
(2)⑤⑦⑧⑨四种溶液中 浓度由大到小的顺序是
浓度由大到小的顺序是_____ 。
(3)①②③④⑤五种溶液中水的电离程度由大到小的顺序为_____ (已知 、
、 )。
)。
(4)等浓度,等体积的①②③三种溶液,用等物质的量浓度的④溶液恰好完全中和时,消耗④溶液的体积由大到小顺序为_____ 。
(5)等体积,等pH①②③三种溶液,分别加入形状大小相同的镁片,开始产生气泡速率的关系为_____ 。
(6)⑥中的离子浓度由大到小的顺序为_____ 。
 的下列溶液
的下列溶液①盐酸②醋酸③硫酸④氢氧化钠⑤氨水⑥醋酸铵⑦硫酸氢铵⑧氯化铵⑨碳酸氢铵请回答下列问题:
(1)①②③④⑤按PH由大到小的顺序是(填序号,下同)
(2)⑤⑦⑧⑨四种溶液中
 浓度由大到小的顺序是
浓度由大到小的顺序是(3)①②③④⑤五种溶液中水的电离程度由大到小的顺序为
 、
、 )。
)。(4)等浓度,等体积的①②③三种溶液,用等物质的量浓度的④溶液恰好完全中和时,消耗④溶液的体积由大到小顺序为
(5)等体积,等pH①②③三种溶液,分别加入形状大小相同的镁片,开始产生气泡速率的关系为
(6)⑥中的离子浓度由大到小的顺序为
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐2】(1)相同物质的量浓度下的各溶液:NaX、NaY、NaZ,其pH值依次为8、9、10,则HX、HY、HZ的酸性由强到弱的顺序为:________________________________
(2)将AlCl3溶于水后,经加热蒸发、蒸干,灼烧,最后所得白色固体的主要成分是__________________
(3)在一定温度下,有a盐酸,b硫酸,c醋酸三种酸。(填序号 )
①当其物质的量浓度相同时,c(H+)由大到小的顺序是_______________ 。
②同体积、同物质的量浓度的三种酸,中和NaOH的能力由大到小的顺序是____________ 。
③当三者c(H+)相同时,物质的量浓度由大到小的顺序为____________________ 。
(4)难溶电解质的水溶液中存在着溶解平衡。已知:在常温下, K sp [Cu(OH)2]=2.0×10-20写出Cu(OH)2溶度积常数表达式___________________________________ 当溶液中各离子浓度系数次方的乘积大于溶度积时,则产生沉淀,反之沉淀溶解。某CuSO4溶液里c(Cu2+)=0.02mol/L,如要生成Cu(OH)2沉淀,应调整溶液的pH,使之大于 _______________ 才能达到目的。
(2)将AlCl3溶于水后,经加热蒸发、蒸干,灼烧,最后所得白色固体的主要成分是
(3)在一定温度下,有a盐酸,b硫酸,c醋酸三种酸。(
①当其物质的量浓度相同时,c(H+)由大到小的顺序是
②同体积、同物质的量浓度的三种酸,中和NaOH的能力由大到小的顺序是
③当三者c(H+)相同时,物质的量浓度由大到小的顺序为
(4)难溶电解质的水溶液中存在着溶解平衡。已知:在常温下, K sp [Cu(OH)2]=2.0×10-20写出Cu(OH)2溶度积常数表达式
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
解题方法
【推荐3】三氯化硼的熔点-107.3℃,沸点为12.5℃,易水解生成硼酸(H3BO3),可用于制造高纯硼、有机合成催化剂等。实验室制取三氯化硼的原理为:B2O3+3C+3Cl2 2BCl3+3CO。
2BCl3+3CO。
(1)甲组同学拟用下列装置制取纯净干燥的氯气(不用收集)。
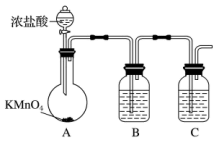
①装置B的作用是___________ ,装置C中盛放的试剂是___________ 。
②装宜A中发生反应的离子方程式为_______________ 。
(2)乙组同学选用甲组实验中的装置A、B、C和下列装置(装置可重复使用)制取BCl3并验证反应中有CO生成。
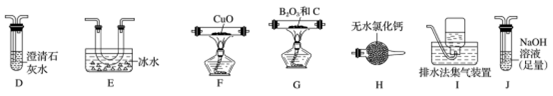
①乙组同学的实验装置中依次连接的合理顺序为:
A→B→C→G→___→____→____→____→F→____→____→_____。____________
②能证明反应中有CO生成的现象是_____________ 。
③开始反应时,先后(选填下列序号)______________ 。
a.点燃G处酒精灯b.打开A处分液漏斗活塞
④BCl3易水解,写出BCl3水解的化学方程式_____________ 。
⑤硼酸是一元弱酸,Ka=-5.8×10-10,碳酸的Ka1=4.4×10-7,现提供饱和的硼酸溶液和0.1mol/LNa2CO3溶液,设计实验证明硼酸酸性比碳酸弱。简述操作和现象____________ 。
 2BCl3+3CO。
2BCl3+3CO。(1)甲组同学拟用下列装置制取纯净干燥的氯气(不用收集)。

①装置B的作用是
②装宜A中发生反应的离子方程式为
(2)乙组同学选用甲组实验中的装置A、B、C和下列装置(装置可重复使用)制取BCl3并验证反应中有CO生成。

①乙组同学的实验装置中依次连接的合理顺序为:
A→B→C→G→___→____→____→____→F→____→____→_____。
②能证明反应中有CO生成的现象是
③开始反应时,先后(选填下列序号)
a.点燃G处酒精灯b.打开A处分液漏斗活塞
④BCl3易水解,写出BCl3水解的化学方程式
⑤硼酸是一元弱酸,Ka=-5.8×10-10,碳酸的Ka1=4.4×10-7,现提供饱和的硼酸溶液和0.1mol/LNa2CO3溶液,设计实验证明硼酸酸性比碳酸弱。简述操作和现象
您最近一年使用:0次



