回收钴废料能有效缓解金属资源浪费、环境污染等问题。一种以含钴催化剂废料(主要含Co、Fe,还含有少量的CoO、FeO、Fe2O3、BaO)制备氧化钴(Co2O3)的工艺流程如图所示:
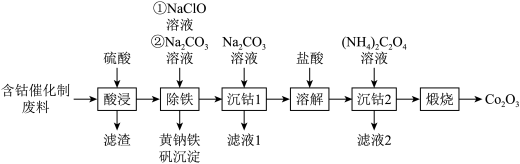
已知:i.金属钴与铁具有相似的化学性质:
ii.氧化性Co3+>ClO-。
回答下列问题:
(1)“酸浸”后,“滤渣”的主要成分有_____ (填化学式)。
(2)“除铁”时先加入NaClO溶液,主要反应的离子方程式为_____ ,再加入Na2CO3溶液调节pH为2.5~3.0,生成黄钠铁矾沉淀。
(3)“滤液2”中主要溶质的化合物类型:______ (填“离子化合物”或“共价化合物”)。
(4)“沉钴2”中产生的CoC2O4在空气中“煅烧”同时只产生使澄清石灰水变浑浊的气体,该反应的化学方程式为:______ ,若取50 g含钴催化剂废料,将按以上流程中的“煅烧”后产生的气体通入澄清石灰水中,得到100 g白色沉淀,则含钴催化剂废料中钴元素的质量分数为:_____ 。(相对原子质量:Co:59、Ca:40、C:12、O:16)

已知:i.金属钴与铁具有相似的化学性质:
ii.氧化性Co3+>ClO-。
回答下列问题:
(1)“酸浸”后,“滤渣”的主要成分有
(2)“除铁”时先加入NaClO溶液,主要反应的离子方程式为
(3)“滤液2”中主要溶质的化合物类型:
(4)“沉钴2”中产生的CoC2O4在空气中“煅烧”同时只产生使澄清石灰水变浑浊的气体,该反应的化学方程式为:
更新时间:2023-01-10 22:29:07
|
相似题推荐
解答题-工业流程题
|
适中
(0.65)
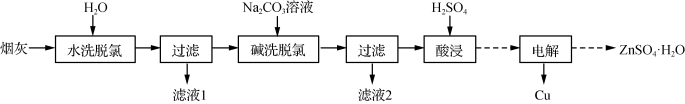
【推荐1】以高氯冶炼烟灰(主要成分为铜锌的氯化物、氧化物、硫酸盐,少量铁元素和砷元素)为原料,可回收制备Cu和ZnSO4·H2O,其主要实验流程如下:
已知:①Fe3+完全沉淀pH为3.2,此时Zn2+、Cu2+未开始沉淀;②K3[Fe(CN)6]可用于检验Fe2+:3Fe2++2[Fe(CN)6]3-===Fe3[Fe(CN)6]2↓(深蓝色);③砷元素进入水体中对环境污染大,可通过沉淀法除去。
(1)两段脱氯均需在85 ℃条件下进行,适宜的加热方式为________ 。
(2)碱洗脱氯时,溶液中Cu2+主要转化为Cu(OH)2和Cu2(OH)2CO3,也会发生副反应得到Cu2(OH)3Cl沉淀并放出气体,该副反应的离子方程式为________________________ 。若用NaOH溶液进行碱洗操作时,浓度不宜过大,通过下表的数据分析其原因是___________ 。
(3)ZnSO4的溶解度曲线如下图所示。“电解”后,从溶液中回收ZnSO4·H2O的实验、操作为___________ 。
(4)滤液1和滤液2中含一定量的Cu2+、Zn2+。为提高原料利用率,可采取的措施有:将滤液1和滤液2混合,回收铜锌沉淀物;循环使用电解过程产生的________ (填化学式)。
(5)已知H3AsO3的还原性强于Fe2+,Ksp(FeAsO3)>Ksp(FeAsO4)=5.7×10-21。测得酸浸液中杂质铁元素(以Fe2+存在)、砷元素(以H3AsO3存在)的浓度分别为1.15 g·L-1、0.58 g·L-1,可采用“氧化中和共沉淀”法除去,请设计实验方案:____________________________ (实验中须使用的试剂有:30%双氧水,0.001 mol·L-1K3[Fe(CN)6]溶液,回收的铜锌沉淀物)。
已知:①Fe3+完全沉淀pH为3.2,此时Zn2+、Cu2+未开始沉淀;②K3[Fe(CN)6]可用于检验Fe2+:3Fe2++2[Fe(CN)6]3-===Fe3[Fe(CN)6]2↓(深蓝色);③砷元素进入水体中对环境污染大,可通过沉淀法除去。
(1)两段脱氯均需在85 ℃条件下进行,适宜的加热方式为
(2)碱洗脱氯时,溶液中Cu2+主要转化为Cu(OH)2和Cu2(OH)2CO3,也会发生副反应得到Cu2(OH)3Cl沉淀并放出气体,该副反应的离子方程式为
NaOH溶液浓度对脱氯率和其他元素浸出率的影响
NaOH浓度 | 脱氯率/% | 元素浸出率/% | ||
Cl | Zn | Cu | As | |
1.0 | 51.20 | 0.51 | 0.04 | 0.00 |
2.0 | 80.25 | 0.89 | 0.06 | 58.87 |
3.0 | 86.58 | 7.39 | 0.26 | 78.22 |
(3)ZnSO4的溶解度曲线如下图所示。“电解”后,从溶液中回收ZnSO4·H2O的实验、操作为

(4)滤液1和滤液2中含一定量的Cu2+、Zn2+。为提高原料利用率,可采取的措施有:将滤液1和滤液2混合,回收铜锌沉淀物;循环使用电解过程产生的
(5)已知H3AsO3的还原性强于Fe2+,Ksp(FeAsO3)>Ksp(FeAsO4)=5.7×10-21。测得酸浸液中杂质铁元素(以Fe2+存在)、砷元素(以H3AsO3存在)的浓度分别为1.15 g·L-1、0.58 g·L-1,可采用“氧化中和共沉淀”法除去,请设计实验方案:
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
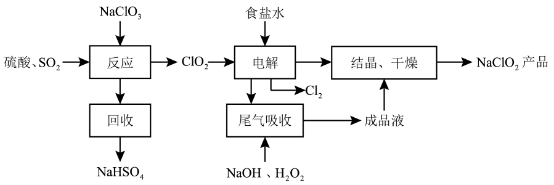
【推荐2】NaClO2是一种重要的杀菌消毒剂,也常用来漂白织物等,其一种生产工艺如下:
回答下列问题:
(1)NaClO2中 的化合价为
的化合价为__________ 。
(2)写出“反应”步骤中生成 的化学方程式
的化学方程式____________ 。
(3)“电解”所用食盐水由粗盐水精制而成,精制时,为除去 和
和 ,要加入的试剂分别为
,要加入的试剂分别为__________ 、__________ 。
(4)“尾气吸收”是吸收“电解”过程排出的少量 ,此吸收反应中,氧化剂与还原剂的物质的量之比为
,此吸收反应中,氧化剂与还原剂的物质的量之比为__________ ,该反应中氧化产物是____________ 。
(5)“有效氯含量”可用来衡量含氯消毒剂的消毒能力,其定义是:每克含氯消毒剂的氧化能力相当于多少克 的氧化能力。
的氧化能力。 的有效氯含量为
的有效氯含量为____________ 。(计算结果保留两位小数)。

回答下列问题:
(1)NaClO2中
 的化合价为
的化合价为(2)写出“反应”步骤中生成
 的化学方程式
的化学方程式(3)“电解”所用食盐水由粗盐水精制而成,精制时,为除去
 和
和 ,要加入的试剂分别为
,要加入的试剂分别为(4)“尾气吸收”是吸收“电解”过程排出的少量
 ,此吸收反应中,氧化剂与还原剂的物质的量之比为
,此吸收反应中,氧化剂与还原剂的物质的量之比为(5)“有效氯含量”可用来衡量含氯消毒剂的消毒能力,其定义是:每克含氯消毒剂的氧化能力相当于多少克
 的氧化能力。
的氧化能力。 的有效氯含量为
的有效氯含量为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐3】氯化亚铜是一种应用较广的催化剂,易水解,微溶于水,不溶于乙醇。以低品位铜矿砂(主要成分 )为原料制备氯化亚铜的路线如下:
)为原料制备氯化亚铜的路线如下:
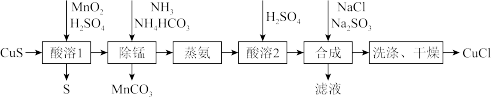
(1)“酸溶1”步骤中发生反应的化学方程式为_______ 。
(2)“除锰”步骤中 转化为
转化为 沉淀,
沉淀, 转变为
转变为 留在溶液中。则“除锰”步骤中发生反应的离子方程式为
留在溶液中。则“除锰”步骤中发生反应的离子方程式为_______ 。
(3)“合成”步骤加入 的速率不宜过快,否则会产生
的速率不宜过快,否则会产生_______ 气体(写化学式),除可能与酸溶时硫酸过量有关,还可能的原因是_______ 。(用离子方程式表示)
(4)“洗涤”步骤先用盐酸洗,再用无水乙醇洗涤。用无水乙醇洗涤除可洗去杂质,减少 的溶解外,还可以
的溶解外,还可以_______ 。
 )为原料制备氯化亚铜的路线如下:
)为原料制备氯化亚铜的路线如下: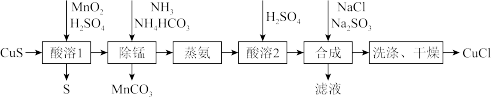
(1)“酸溶1”步骤中发生反应的化学方程式为
(2)“除锰”步骤中
 转化为
转化为 沉淀,
沉淀, 转变为
转变为 留在溶液中。则“除锰”步骤中发生反应的离子方程式为
留在溶液中。则“除锰”步骤中发生反应的离子方程式为(3)“合成”步骤加入
 的速率不宜过快,否则会产生
的速率不宜过快,否则会产生(4)“洗涤”步骤先用盐酸洗,再用无水乙醇洗涤。用无水乙醇洗涤除可洗去杂质,减少
 的溶解外,还可以
的溶解外,还可以
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
【推荐1】工业上,处理低品位黄铜矿[二硫化亚铁铜(CuFeS2)含量较低]常采用生物堆浸法。堆浸所得的溶液可用于制备绿矾(FeSO4·7H2O)和胆矾(CuSO4·5H2O)。相关流程如图。
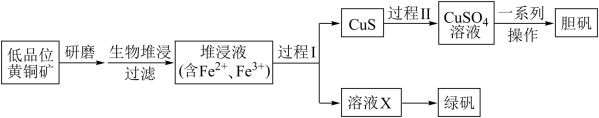
(1)对低品位黄铜矿“研磨”的目的是___________
(2)生物堆浸过程的反应在Tf细菌的作用下进行,主要包括两个阶段,第一阶段的反应为:CuFeS2+4H++O2 Cu2++Fe2++2S+2H2O,第二阶段将Fe2+变为Fe3+的离子方程式为
Cu2++Fe2++2S+2H2O,第二阶段将Fe2+变为Fe3+的离子方程式为___________ 。
(3)过程Ⅰ中,加入Na2S2O3固体会还原堆浸液中的Fe3+,得到溶液X。请设计一个简单实验方案判断该溶液中的Fe3+是否全部被还原___________
(4)过程Ⅱ用H2O2和稀硫酸处理后,CuS完全溶解生成了CuSO4溶液,写出过程Ⅱ的离子方程式___________ ;其中H2O2的作用为___________ (填“氧化剂”或“还原剂”)
(5)制备胆矾的“一系列操作”包含___________ 、___________ 、过滤、洗涤、干燥。
(6)绿矾的纯度可通过其与KMnO4溶液反应来测定。取mg绿矾晶体,加适量稀硫酸溶解。用物质的量浓度为cmol/L的KMnO4溶液与之反应。至恰好完全反应时,消耗KMnO4溶液的体积为VmL。绿矾晶体质量分数的计算式为___________ (已知:FeSO4·7H2O的摩尔质量为278g/mol)

(1)对低品位黄铜矿“研磨”的目的是
(2)生物堆浸过程的反应在Tf细菌的作用下进行,主要包括两个阶段,第一阶段的反应为:CuFeS2+4H++O2
 Cu2++Fe2++2S+2H2O,第二阶段将Fe2+变为Fe3+的离子方程式为
Cu2++Fe2++2S+2H2O,第二阶段将Fe2+变为Fe3+的离子方程式为(3)过程Ⅰ中,加入Na2S2O3固体会还原堆浸液中的Fe3+,得到溶液X。请设计一个简单实验方案判断该溶液中的Fe3+是否全部被还原
(4)过程Ⅱ用H2O2和稀硫酸处理后,CuS完全溶解生成了CuSO4溶液,写出过程Ⅱ的离子方程式
(5)制备胆矾的“一系列操作”包含
(6)绿矾的纯度可通过其与KMnO4溶液反应来测定。取mg绿矾晶体,加适量稀硫酸溶解。用物质的量浓度为cmol/L的KMnO4溶液与之反应。至恰好完全反应时,消耗KMnO4溶液的体积为VmL。绿矾晶体质量分数的计算式为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
【推荐2】 是一种压电材料。以
是一种压电材料。以 为原料,采用下列路线可制备粉状
为原料,采用下列路线可制备粉状 。
。
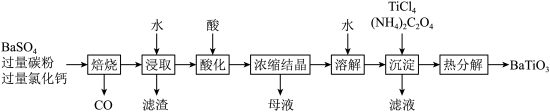
回答下列问题:
(1)“焙烧”步骤中碳粉的主要作用是___________ 。
(2)“焙烧”后固体产物有 、易溶于水的
、易溶于水的 和微溶于水的
和微溶于水的 。“浸取”时主要反应的离子方程式为
。“浸取”时主要反应的离子方程式为___________ 。
(3)“酸化”步骤应选用的酸是___________ (填标号)。
a.稀硫酸 b.浓硫酸 c.盐酸 d.磷酸
(4)如果焙烧后的产物直接用酸浸取,是否可行?___________ ,其原因是___________ 。
(5)“沉淀”步骤中生成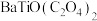 的化学方程式为
的化学方程式为___________ 。
 是一种压电材料。以
是一种压电材料。以 为原料,采用下列路线可制备粉状
为原料,采用下列路线可制备粉状 。
。
回答下列问题:
(1)“焙烧”步骤中碳粉的主要作用是
(2)“焙烧”后固体产物有
 、易溶于水的
、易溶于水的 和微溶于水的
和微溶于水的 。“浸取”时主要反应的离子方程式为
。“浸取”时主要反应的离子方程式为(3)“酸化”步骤应选用的酸是
a.稀硫酸 b.浓硫酸 c.盐酸 d.磷酸
(4)如果焙烧后的产物直接用酸浸取,是否可行?
(5)“沉淀”步骤中生成
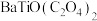 的化学方程式为
的化学方程式为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐3】同学甲用下述装置组装了一套可以证明实验室制取 的过程中有
的过程中有 和水蒸气挥发出来的装置。(已知:氯气易溶于四氯化碳,而氯化氢不溶)请根据要求回答下列问题:
和水蒸气挥发出来的装置。(已知:氯气易溶于四氯化碳,而氯化氢不溶)请根据要求回答下列问题:

(1)①按气流方向填出接口顺序:a→_________ →f。②A中反应的离子方程式是_________ 。③B中盛放试剂的名称是___________ ;C中盛放的是 溶液,其作用是
溶液,其作用是___________ 。
(2)A装置中所用溶液浓度为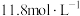 ,现欲用其配制
,现欲用其配制 的稀溶液,则需用量筒量取
的稀溶液,则需用量筒量取________  浓溶液;配制过程中,需用的玻璃仪器除烧杯、玻璃棒、量筒,还需
浓溶液;配制过程中,需用的玻璃仪器除烧杯、玻璃棒、量筒,还需________ ;若所配制的稀溶液浓度偏小,则下列可能的原因分析中正确的是________ (填字母)。
A.配制前,容量瓶中有少量蒸馏水 B.量取浓溶液时,仰视液面
C.未经冷却,立即转移至容量瓶定容 D.定容时,仰视液面
 的过程中有
的过程中有 和水蒸气挥发出来的装置。(已知:氯气易溶于四氯化碳,而氯化氢不溶)请根据要求回答下列问题:
和水蒸气挥发出来的装置。(已知:氯气易溶于四氯化碳,而氯化氢不溶)请根据要求回答下列问题:
(1)①按气流方向填出接口顺序:a→
 溶液,其作用是
溶液,其作用是(2)A装置中所用溶液浓度为
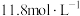 ,现欲用其配制
,现欲用其配制 的稀溶液,则需用量筒量取
的稀溶液,则需用量筒量取 浓溶液;配制过程中,需用的玻璃仪器除烧杯、玻璃棒、量筒,还需
浓溶液;配制过程中,需用的玻璃仪器除烧杯、玻璃棒、量筒,还需A.配制前,容量瓶中有少量蒸馏水 B.量取浓溶液时,仰视液面
C.未经冷却,立即转移至容量瓶定容 D.定容时,仰视液面
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
【推荐1】已知A、B、C、D、E、F、G是原子序数依次递增的短周期元素,已知A和D,C和F为同一主族元素,A与B、A与G形成共价化合物,B原子的最外层电子数比次外层多3,G元素的最高正化合价与最低负化合价的代数和为6,E的最高价氧化物的水化物既可以和强酸反应又可以和强碱反应,F形成的化合物是造成酸雨的主要原因。请回答下列问题:
(1)七种元素中,F元素在周期表中的位置是___________ 。
(2)比较C与D元素的原子形成的简单离子半径:___________ >___________ 。
(3)由C、D形成的一种淡黄色固体的电子式___________ ;画出B单质的结构式___________ 。
(4)F与G元素的气态氢化物的热稳定性由大到小的顺序___________ (用化学式表示)
(5)E的最高价氧化物对应的水化物可用作治疗胃酸过多的药物,其反应的离子方程式为:___________
(6)A、C、D形成化合物的化学键的类型___________ 。
(1)七种元素中,F元素在周期表中的位置是
(2)比较C与D元素的原子形成的简单离子半径:
(3)由C、D形成的一种淡黄色固体的电子式
(4)F与G元素的气态氢化物的热稳定性由大到小的顺序
(5)E的最高价氧化物对应的水化物可用作治疗胃酸过多的药物,其反应的离子方程式为:
(6)A、C、D形成化合物的化学键的类型
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
【推荐2】A、B、C、D、E、 F、G是周期表中短周期的七种元素,有关性质或结构信息如下表:
(1) B元素名称为____ ,A与C以原子个数比为1:1形成的化合物的电子式为___ ,用电子式表示C与E形成化合物的过程____ 。
(2)DG形成的化合物是由____ (极性或非极性)键形成的分子,电子式为_____ 。
(3) 非金属性D____ E(填大于或小于),请从原子结构的角度解释原因:_____ 。
| 元素 | 有关性质或结构信息 |
A | 宇宙中含量最多的元素 |
B | 金属B能与NaOH溶液反应,且是所在周期中单核离子半径最小的 |
C | C与B同周期,且是所在周期中原子半径最大的(稀有气体除外) |
D | D原子最外层电子数是电子层数的2倍,其氢化物有臭鸡蛋气味 |
E | E与D同周期,且在该周期中原子半径最小 |
F | F的氢化物和最高价氧化物的水化物反应生成一种离子化合物 |
G | G是形成化合物种类最多的元素 |
(2)DG形成的化合物是由
(3) 非金属性D
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
【推荐3】已知X、Y、Z、W四种元素分别是元素周期表中连续三个短周期的元素,且原子序数依次增大。X、W同主族,Y、Z为同周期的相邻元素。W原子的质子数等于Y、Z原子最外层电子数之和。Y与X形成的分子中有3个共价键。Z原子最外层电子数是次外层电子数的3倍,试推断:
(1)X、Z两种元素的元素符号:X__ 、Z__ 。
(2)由以上元素两两形成的化合物中:溶于水显碱性的气态氢化物的化学键属于__ 键;含有离子键和共价键的化合物的化学式为__ 。
(3)由X、Y、Z所形成的常见离子化合物是__ (写化学式),该化合物与W的最高价氧化物对应的水化物的浓溶液加热时反应的离子方程式为__ 。X与W形成的化合物与水反应时,水是__ (填“氧化剂”或“还原剂”)。
(4)用电子式表示W与Z形成W2Z化合物的过程:__ 。
(5)Q与Z同主族,位于第4周期,其原子序数为__ 。
(1)X、Z两种元素的元素符号:X
(2)由以上元素两两形成的化合物中:溶于水显碱性的气态氢化物的化学键属于
(3)由X、Y、Z所形成的常见离子化合物是
(4)用电子式表示W与Z形成W2Z化合物的过程:
(5)Q与Z同主族,位于第4周期,其原子序数为
您最近一年使用:0次
【推荐1】为探究无水盐X(仅含5种元素)的组成和性质,设计并完成如下实验:

请回答:
(1)组成X的5种元素符号是H、N___________ ;X的化学式是___________ 。
(2)写出向X溶液中加入足量的浓Ba(OH)2溶液并微热的离子方程式___________ 。
(3)写出检验X中金属阳离子的实验操作和现象:___________ 。

请回答:
(1)组成X的5种元素符号是H、N
(2)写出向X溶液中加入足量的浓Ba(OH)2溶液并微热的离子方程式
(3)写出检验X中金属阳离子的实验操作和现象:
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐2】(NH4)2SO4是常见的化肥和化工原料,受热易分解。某兴趣小组拟探究其分解产物。
[查阅资料](NH4)2SO4在260℃和400℃时分解的产物不同。
[实验探究]该小组拟选用如图所示装置进行实验(夹持和加热装置略)。

(1)按图示连接好装置后,检查___________ ,再按图示加入试剂。
(2)实验起止的操作顺序为___________(填序号)。
I.探究(NH4)2SO4在260° C时分解的产物。
已知:装置B中盛有60 mL 0. 5 mol·L-1盐酸,反应一段时间后,观察到装置A中有液体剩余,C中品红溶液不褪色。取下装置B,其中剩余的稀盐酸恰好可与50 mL 0.2 mol·L-1NaOH溶液完全反应,经检验反应后的溶液中无 和
和 ;另检验出A中剩余的液体为NH4HSO4溶液。
;另检验出A中剩余的液体为NH4HSO4溶液。
(3)(NH4)2SO4在260 °C 分解得到的另一产物为___________ (填化学式),参加反应的(NH4)2SO4的质量为___________ g。
II.探究(NH4)2SO4、在400° C时分解的产物。
当装置A中无残留物时,停止实验。观察到装置A、B之间的导气管内有少量白色固体,C中品红溶液褪色。经检验,该白色固体和装置D内溶液中有 、无
、无 。进一步研究发现,气体产物中无氮氧化物。
。进一步研究发现,气体产物中无氮氧化物。
(4)装置A、B之间的导气管内的少量白色固体为___________ (填化学式)。
(5)检验装置D内溶液中有 、无
、无 的实验操作和现象为
的实验操作和现象为___________ 。
(6)(NH4)2SO4在400 °C分解的产物除NH3、H2O外,还有___________ (填化学式)。
[查阅资料](NH4)2SO4在260℃和400℃时分解的产物不同。
[实验探究]该小组拟选用如图所示装置进行实验(夹持和加热装置略)。

(1)按图示连接好装置后,检查
(2)实验起止的操作顺序为___________(填序号)。
| A.加热装置A |
| B.停止通入N2 |
| C.通入N2排尽空气 |
| D.停止加热 |
I.探究(NH4)2SO4在260° C时分解的产物。
已知:装置B中盛有60 mL 0. 5 mol·L-1盐酸,反应一段时间后,观察到装置A中有液体剩余,C中品红溶液不褪色。取下装置B,其中剩余的稀盐酸恰好可与50 mL 0.2 mol·L-1NaOH溶液完全反应,经检验反应后的溶液中无
 和
和 ;另检验出A中剩余的液体为NH4HSO4溶液。
;另检验出A中剩余的液体为NH4HSO4溶液。(3)(NH4)2SO4在260 °C 分解得到的另一产物为
II.探究(NH4)2SO4、在400° C时分解的产物。
当装置A中无残留物时,停止实验。观察到装置A、B之间的导气管内有少量白色固体,C中品红溶液褪色。经检验,该白色固体和装置D内溶液中有
 、无
、无 。进一步研究发现,气体产物中无氮氧化物。
。进一步研究发现,气体产物中无氮氧化物。(4)装置A、B之间的导气管内的少量白色固体为
(5)检验装置D内溶液中有
 、无
、无 的实验操作和现象为
的实验操作和现象为(6)(NH4)2SO4在400 °C分解的产物除NH3、H2O外,还有
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐3】碳酸锰(MnCO3)是制造高性能磁性材料的主要原料。实验室以KMnO4为原料制备少量MnCO3并研究其性
质,制备MnCO3的装置如图1所示。
已知: MnCO3难溶于水、乙醇,100°C开始分解。 请回答下列问题:__________________ 。
(2)在烧瓶中加入一定量的KMnO4固体,滴加硫酸酸化的H2C2O4溶液,其反应的离子方程式为_____________ , 反应过程中c(Mn2+)随时间的变化曲线如图2所示,则tmin时, c(Mn2+)迅速增大的原因是__________ 。
(3)反应一段时间后, 当装置A中的溶液由紫色变为无色,再滴加NH4HCO3溶液充分反应生成MnCO3。生成MnCO3的离子方程式为__________________ 。
(4)实验结束后,将装置A中的混合物过滤,用乙醇洗涤滤渣,再_____ , 即 得到干燥的MnCO3固体。用乙醇洗涤的优点是___________________ 。
(5)在空气中加热MnCO3固体,随着温度的升高,残留固体的质量变化如图3所示。则A点的成分为________ (填化学式),B→C反应的化学方程式为______________________ 。
质,制备MnCO3的装置如图1所示。
已知: MnCO3难溶于水、乙醇,100°C开始分解。 请回答下列问题:

(2)在烧瓶中加入一定量的KMnO4固体,滴加硫酸酸化的H2C2O4溶液,其反应的离子方程式为
(3)反应一段时间后, 当装置A中的溶液由紫色变为无色,再滴加NH4HCO3溶液充分反应生成MnCO3。生成MnCO3的离子方程式为
(4)实验结束后,将装置A中的混合物过滤,用乙醇洗涤滤渣,再
(5)在空气中加热MnCO3固体,随着温度的升高,残留固体的质量变化如图3所示。则A点的成分为
您最近一年使用:0次



