NaClO2是一种重要的杀菌消毒剂,也常用来漂白织物等,其一种生产工艺如下:
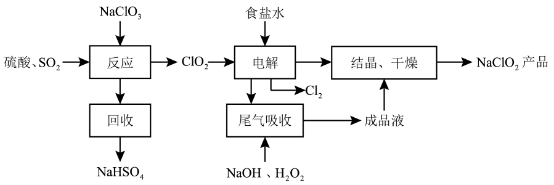
回答下列问题:
(1)NaClO2中 的化合价为
的化合价为__________ 。
(2)写出“反应”步骤中生成 的化学方程式
的化学方程式____________ 。
(3)“电解”所用食盐水由粗盐水精制而成,精制时,为除去 和
和 ,要加入的试剂分别为
,要加入的试剂分别为__________ 、__________ 。
(4)“尾气吸收”是吸收“电解”过程排出的少量 ,此吸收反应中,氧化剂与还原剂的物质的量之比为
,此吸收反应中,氧化剂与还原剂的物质的量之比为__________ ,该反应中氧化产物是____________ 。
(5)“有效氯含量”可用来衡量含氯消毒剂的消毒能力,其定义是:每克含氯消毒剂的氧化能力相当于多少克 的氧化能力。
的氧化能力。 的有效氯含量为
的有效氯含量为____________ 。(计算结果保留两位小数)。

回答下列问题:
(1)NaClO2中
 的化合价为
的化合价为(2)写出“反应”步骤中生成
 的化学方程式
的化学方程式(3)“电解”所用食盐水由粗盐水精制而成,精制时,为除去
 和
和 ,要加入的试剂分别为
,要加入的试剂分别为(4)“尾气吸收”是吸收“电解”过程排出的少量
 ,此吸收反应中,氧化剂与还原剂的物质的量之比为
,此吸收反应中,氧化剂与还原剂的物质的量之比为(5)“有效氯含量”可用来衡量含氯消毒剂的消毒能力,其定义是:每克含氯消毒剂的氧化能力相当于多少克
 的氧化能力。
的氧化能力。 的有效氯含量为
的有效氯含量为
更新时间:2019-02-02 21:39:46
|
相似题推荐
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐1】二氧化锰在工业上具有重要的作用,工业上可利用菱锰矿(主要成分为MnCO3、SiO2、FeCO3以及少量CuO)制取。制备流程如图所示:
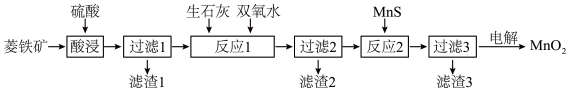
(1)酸浸过程中,MnCO3溶解的离子方程式为_______ ,选择用硫酸而不选择盐酸溶解,除了盐酸挥发造成设备腐蚀以外,另一个原因是_______ 。
(2)滤渣1的主要成分是_______ ,除铁的过程中,应该先加_______ (填“生石灰”或“双氧水”),原因是_______ 。
(3)用惰性电极对过滤3得到的滤液进行电解,得到MnO2,写出电解过程中阳极电极反应式:_______

(1)酸浸过程中,MnCO3溶解的离子方程式为
(2)滤渣1的主要成分是
(3)用惰性电极对过滤3得到的滤液进行电解,得到MnO2,写出电解过程中阳极电极反应式:
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐2】云南省某校化学兴趣小组设计如下实验方案。用浓硫酸与铜片反应制备SO2并进行相关实验探究,实验装置如图所示:

请回答下列问题:
(1)打开分液漏斗的旋塞,仪器a中的浓硫酸不能顺利流下,原因可能是___________ (填序号)。
A.分液漏斗上端玻璃塞上的凹槽没有与漏斗上的小孔对齐
B.分液漏斗上端玻璃塞未打开
C.浓硫酸浓度过大
(2)若撤去酒精灯,实验室利用装置A制备SO2时发生的化学方程式是___________
(3)装置B的作用是___________ 。
(4)设计装置C的目的是验证SO2的___________ 性,装置C中反应的离子方程式是___________ 。
(5)若装置D中生成的正盐与酸式盐的物质的量之比为1:2时,D中反应的离子方程式是___________ 。
(6)向NaHSO3溶液中加入NaClO溶液时,反应有三种可能的情况:
I. 与ClO-恰好反应 II.NaClO不足 III.NaClO过量
与ClO-恰好反应 II.NaClO不足 III.NaClO过量
甲同学分别取上述混合溶液于试管中,通过下列实验确定该反应属于哪一种情况,请完成下表:(已知:H2SO3:Ka1=1.54×10-2,Ka2=1.02×10-7;H2CO3:Ka1=4.3×10-7,Ka2=5.61×10-11;HClO:Ka=3×10-8)

请回答下列问题:
(1)打开分液漏斗的旋塞,仪器a中的浓硫酸不能顺利流下,原因可能是
A.分液漏斗上端玻璃塞上的凹槽没有与漏斗上的小孔对齐
B.分液漏斗上端玻璃塞未打开
C.浓硫酸浓度过大
(2)若撤去酒精灯,实验室利用装置A制备SO2时发生的化学方程式是
(3)装置B的作用是
(4)设计装置C的目的是验证SO2的
(5)若装置D中生成的正盐与酸式盐的物质的量之比为1:2时,D中反应的离子方程式是
(6)向NaHSO3溶液中加入NaClO溶液时,反应有三种可能的情况:
I.
 与ClO-恰好反应 II.NaClO不足 III.NaClO过量
与ClO-恰好反应 II.NaClO不足 III.NaClO过量甲同学分别取上述混合溶液于试管中,通过下列实验确定该反应属于哪一种情况,请完成下表:(已知:H2SO3:Ka1=1.54×10-2,Ka2=1.02×10-7;H2CO3:Ka1=4.3×10-7,Ka2=5.61×10-11;HClO:Ka=3×10-8)
| 序号 | 实验操作 | 现象 | 结论 |
| ① | 加入少量CaCO3粉末 | I或II | |
| ② | 滴加少量淀粉-KI溶液,振荡 | 溶液先变蓝后褪色 | |
| ③ | 滴加少量溴水,振荡 | II |
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐3】回答下列问题:
(1)一定条件下,用Fe2O3、NiO或Cr2O3作催化剂对燃煤烟气回收。反应为2CO(g)+SO2(g) 2CO2(g)+S(l) △H=-270 kJ·mol-1。
2CO2(g)+S(l) △H=-270 kJ·mol-1。
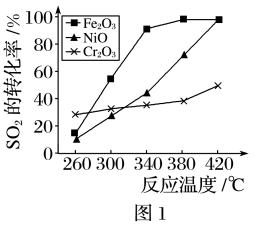
①其他条件相同、催化剂不同,SO2的转化率随反应温度的变化如图1,Fe2O3和NiO作催化剂均能使SO2的转化率达到最高,不考虑催化剂价格因素,选择Fe2O3的主要优点是____
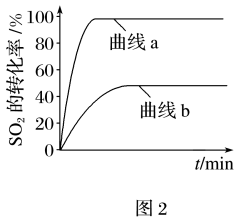
②某科研小组用Fe2O3作催化剂,在380℃时,分别研究了n(CO):n(SO2)为1:1、3:1时SO2转化率的变化情况(图2)。则图2中表示n(CO):n(SO2)=3:1的变化曲线为____ 。
(2)目前,科学家正在研究一种以乙烯作为还原剂的脱硝(NO)原理,其脱硝机理示意图如图3,脱硝率与温度、负载率(分子筛中催化剂的质量分数)的关系如图4所示。
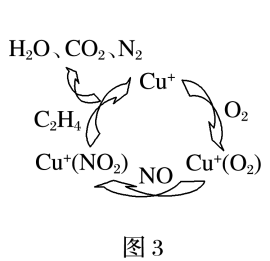
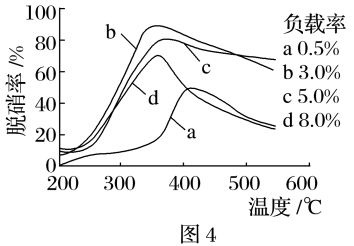
①写出该脱硝原理总反应的化学方程式:____ 。
②为达到最佳脱硝效果,应采取的条件是____ 。
(3)甲醇在工业上可利用水煤气来合成:CO(g)+2H2(g) CH3OH(g) △H<0。将1 mol CO和2 mol H2通入密闭容器中进行反应,在一定温度和压强下达到平衡时甲醇的体积分数φ(CH3OH)变化趋势如图所示:
CH3OH(g) △H<0。将1 mol CO和2 mol H2通入密闭容器中进行反应,在一定温度和压强下达到平衡时甲醇的体积分数φ(CH3OH)变化趋势如图所示:
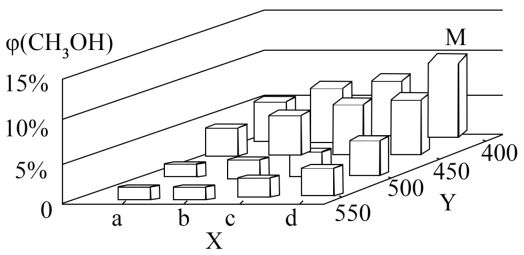
图中Y轴表示的外界条件为____ 。
已知v(正)=k(正)·p(CO)·p2(H2),v(逆)=k(逆)·p(CH3OH),其中k(正)、k(逆)分别为正、逆反应速率常数,p为各组分的分压。在M点所处的温度(T3℃)和压强(p0kPa)下,反应中20分钟达到平衡φ(CH3OH)=10%,该温度下反应的平衡常数Kp=____ kPa-2(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。若在15分钟时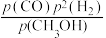 =3.27p20 kPa2,此时
=3.27p20 kPa2,此时 =
=____ (计算结果保留两位小数)。
(1)一定条件下,用Fe2O3、NiO或Cr2O3作催化剂对燃煤烟气回收。反应为2CO(g)+SO2(g)
 2CO2(g)+S(l) △H=-270 kJ·mol-1。
2CO2(g)+S(l) △H=-270 kJ·mol-1。

①其他条件相同、催化剂不同,SO2的转化率随反应温度的变化如图1,Fe2O3和NiO作催化剂均能使SO2的转化率达到最高,不考虑催化剂价格因素,选择Fe2O3的主要优点是
②某科研小组用Fe2O3作催化剂,在380℃时,分别研究了n(CO):n(SO2)为1:1、3:1时SO2转化率的变化情况(图2)。则图2中表示n(CO):n(SO2)=3:1的变化曲线为
(2)目前,科学家正在研究一种以乙烯作为还原剂的脱硝(NO)原理,其脱硝机理示意图如图3,脱硝率与温度、负载率(分子筛中催化剂的质量分数)的关系如图4所示。


①写出该脱硝原理总反应的化学方程式:
②为达到最佳脱硝效果,应采取的条件是
(3)甲醇在工业上可利用水煤气来合成:CO(g)+2H2(g)
 CH3OH(g) △H<0。将1 mol CO和2 mol H2通入密闭容器中进行反应,在一定温度和压强下达到平衡时甲醇的体积分数φ(CH3OH)变化趋势如图所示:
CH3OH(g) △H<0。将1 mol CO和2 mol H2通入密闭容器中进行反应,在一定温度和压强下达到平衡时甲醇的体积分数φ(CH3OH)变化趋势如图所示:
图中Y轴表示的外界条件为
已知v(正)=k(正)·p(CO)·p2(H2),v(逆)=k(逆)·p(CH3OH),其中k(正)、k(逆)分别为正、逆反应速率常数,p为各组分的分压。在M点所处的温度(T3℃)和压强(p0kPa)下,反应中20分钟达到平衡φ(CH3OH)=10%,该温度下反应的平衡常数Kp=
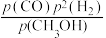 =3.27p20 kPa2,此时
=3.27p20 kPa2,此时 =
=
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
解题方法
【推荐1】已知 为
为 和
和 的混合物,且知氧化性顺序:
的混合物,且知氧化性顺序: ,取
,取 样品进行如下图所示的实验:
样品进行如下图所示的实验:
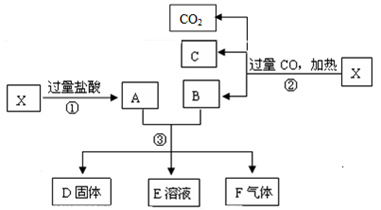
(1)写出③步可能发生反应的3个离子方程式为________________________ 、________________________ 、________________________ 。
(2)若溶液E中只有一种金属离子,则一定是______ ;若D固体是纯净物,该固体是______ 。(填化学式)
(3)向溶液A中加入 粉,若会反应,则写出反应的离子方程式,若不会反应,则填“不能”在横线上
粉,若会反应,则写出反应的离子方程式,若不会反应,则填“不能”在横线上__________________________________________ 。
 为
为 和
和 的混合物,且知氧化性顺序:
的混合物,且知氧化性顺序: ,取
,取 样品进行如下图所示的实验:
样品进行如下图所示的实验:
(1)写出③步可能发生反应的3个离子方程式为
(2)若溶液E中只有一种金属离子,则一定是
(3)向溶液A中加入
 粉,若会反应,则写出反应的离子方程式,若不会反应,则填“不能”在横线上
粉,若会反应,则写出反应的离子方程式,若不会反应,则填“不能”在横线上
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐2】利用元素的化合价推测物质的性质是化学研究的重要手段。如图是硫元素的常见化合价与部分物质类别的对应关系:___________ 性。
(2)从硫元素化合价变化的角度分析,图中只有还原性的物质有___________ (填化学式)。
(3)将H2S与SO2混合可生成淡黄色沉淀。该反应中氧化产物与还原产物的物质的量之比为___________ 。
(4)配平下列反应:___________
________Na2S+________Na2SO3+________H2SO4=________Na2SO4+________S↓+________H2O
(5)如图是验证SO2性质的实验装置。___________ (填序号,下同);B中___________ ;C中___________ 。
②D装置的作用是___________ 。

(2)从硫元素化合价变化的角度分析,图中只有还原性的物质有
(3)将H2S与SO2混合可生成淡黄色沉淀。该反应中氧化产物与还原产物的物质的量之比为
(4)配平下列反应:
________Na2S+________Na2SO3+________H2SO4=________Na2SO4+________S↓+________H2O
(5)如图是验证SO2性质的实验装置。
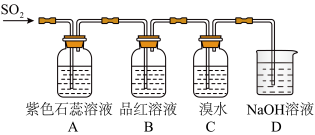
②D装置的作用是
您最近一年使用:0次
【推荐3】回答下列问题:
(1)按如图所示操作,充分反应后:

①I中发生反应的离子方程式为_______ ;
②II中铜丝上观察到的现象是_______ ;
③结合I、II实验现象可知Fe2+、Cu2+、Ag+的氧化性由强到弱的顺序为_______ 。
(2)某一反应体系中有反应物和生成物共5种物质:S、H2S、 HNO3、NO、H2O。该反应体系中的还原产物是_______ 。
(3)将Cl2通入HBr溶液中,发生反应Cl2+2Br-=2Cl-+Br2,而将少量 Cl2通入FeBr2的溶液中,反应的离子方程式为2Fe2++Cl2=2Fe3++2Cl-,这个事实说明具有还原性的粒子的还原性强弱顺序为_______ 。
(1)按如图所示操作,充分反应后:

①I中发生反应的离子方程式为
②II中铜丝上观察到的现象是
③结合I、II实验现象可知Fe2+、Cu2+、Ag+的氧化性由强到弱的顺序为
(2)某一反应体系中有反应物和生成物共5种物质:S、H2S、 HNO3、NO、H2O。该反应体系中的还原产物是
(3)将Cl2通入HBr溶液中,发生反应Cl2+2Br-=2Cl-+Br2,而将少量 Cl2通入FeBr2的溶液中,反应的离子方程式为2Fe2++Cl2=2Fe3++2Cl-,这个事实说明具有还原性的粒子的还原性强弱顺序为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐1】以Cl2、NaOH、(NH2)2CO(尿素)和SO2为原料可制备N2H4·H2O(水合肼)和无水Na2SO3,其主要实验流程如图:

已知:①Cl2+2OH-=ClO-+Cl-+H2O是放热反应。
②N2H4·H2O沸点约118℃,具有强还原性,能与NaClO剧烈反应生成N2。
(1)步骤I制备NaClO溶液时,若温度超过40℃,Cl2与NaOH溶液反应生成NaClO3和NaCl,其离子方程式为_______ ;实验中控制温度除用冰水浴外,还缓慢通入Cl2,其理由是________ 。
(2)步骤II合成N2H4·H2O的装置如图a所示。合成N2H4·H2O发生反应的离子方程式为______ ;使用冷凝管的目的是_______ 。

(3)步骤IV用步骤III得到的副产品Na2CO3制备无水Na2CO3(水溶搅拌器液中H2SO3, ,
, 随pH的分布如图b所示,Na2CO3的溶解度曲线如图c所示)。
随pH的分布如图b所示,Na2CO3的溶解度曲线如图c所示)。
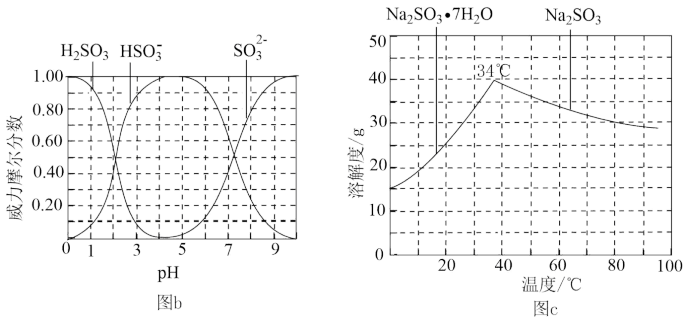
①边搅拌边向Na2CO3溶液中通入SO2制备NaHSO3溶液。实验中确定何时停止通SO2的实验方案为___________ 。
②请补充完整由NaHSO3溶液制备无水Na2CO3的实验方案:边搅拌边向NaHSO3溶液中滴加NaOH溶液,测量溶液pH,pH约为________ 时,停止滴加NaOH溶液,加热浓缩溶液至有大量晶体析出,在高于_________ ℃条件下趁热过滤,用少量无水乙醇洗涤,干燥,密封包装。

已知:①Cl2+2OH-=ClO-+Cl-+H2O是放热反应。
②N2H4·H2O沸点约118℃,具有强还原性,能与NaClO剧烈反应生成N2。
(1)步骤I制备NaClO溶液时,若温度超过40℃,Cl2与NaOH溶液反应生成NaClO3和NaCl,其离子方程式为
(2)步骤II合成N2H4·H2O的装置如图a所示。合成N2H4·H2O发生反应的离子方程式为

(3)步骤IV用步骤III得到的副产品Na2CO3制备无水Na2CO3(水溶搅拌器液中H2SO3,
 ,
, 随pH的分布如图b所示,Na2CO3的溶解度曲线如图c所示)。
随pH的分布如图b所示,Na2CO3的溶解度曲线如图c所示)。
①边搅拌边向Na2CO3溶液中通入SO2制备NaHSO3溶液。实验中确定何时停止通SO2的实验方案为
②请补充完整由NaHSO3溶液制备无水Na2CO3的实验方案:边搅拌边向NaHSO3溶液中滴加NaOH溶液,测量溶液pH,pH约为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐2】某学习小组在实验室制备氯化铁并配制其溶液,过程如下。
【制备无水FeCl3】无水FeCl3是一种常见的化工原料,易升华,在空气中极易吸水,可利用以下实验装置制备。

(1)按气流方向,连接顺序为a→_______ →j→k→f→g→b→c(填仪器连接口的字母编号)。
(2)装置B的作用是_______ 。
(3)A中发生的离子反应为_______ 。
【配制FeCl3溶液】
(4)配置100mL0.5mol/LFeCl3溶液,需用量筒量取5.0mol/LFeCl3溶液_______ mL,还需要的仪器有烧杯、玻璃棒、_______ 。
(5)下列实验操作对所配制的FeCl3溶液物质的量浓度有何影响?(填“偏大”“偏小”或“无影响”)
①定容时,俯视刻度线:_______ 。
②未洗涤烧杯及玻璃棒:_______ 。
【制备无水FeCl3】无水FeCl3是一种常见的化工原料,易升华,在空气中极易吸水,可利用以下实验装置制备。

(1)按气流方向,连接顺序为a→
(2)装置B的作用是
(3)A中发生的离子反应为
【配制FeCl3溶液】
(4)配置100mL0.5mol/LFeCl3溶液,需用量筒量取5.0mol/LFeCl3溶液
(5)下列实验操作对所配制的FeCl3溶液物质的量浓度有何影响?(填“偏大”“偏小”或“无影响”)
①定容时,俯视刻度线:
②未洗涤烧杯及玻璃棒:
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐3】铁及其化合物在生产生活中具有重要的应用,高铁酸钾(K2FeO4)是一种高效水处理剂,紫色固体。已知K2FeO4具有下列性质:①可溶于水,溶液为紫色,微溶于浓KOH溶液;②在0℃~5℃、强碱性溶液中比较稳定。某实验小组制备并探究K2FeO4性质,回答下列问题:
(1)制备K2FeO4(夹持装置略):

①A为氯气发生装置,其中仪器a的名称是_______ ,固体甲的化学式为_______ ,浓盐酸在该反应中表现的性质为_______ ;将Cl2通过装置B可除去杂质,以免影响实验,B中的试剂是_______ 。
②C为制备K2FeO4的装置,采用冰水浴的原因是_______ ,KClO与Fe(OH)3在碱性环境中反应生成K2FeO4,该氧化还原反应中氧化剂与还原剂的物质的量之比为_______ 。
③D为尾气处理装置,发生反应的离子方程式为_______ 。
(2)探究K2FeO4的性质:
根据实验1和2的现象,写出K2FeO4在酸性条件下发生反应的离子方程式_______ 。
(1)制备K2FeO4(夹持装置略):

①A为氯气发生装置,其中仪器a的名称是
②C为制备K2FeO4的装置,采用冰水浴的原因是
③D为尾气处理装置,发生反应的离子方程式为
(2)探究K2FeO4的性质:
| 实验1 | 取少量C中紫色溶液,加入过量稀硫酸,迅速产生大量气体,该气体能使带火星的木条复燃。 |
| 实验2 | 取实验1中的溶液,滴加KSCN溶液至过量,溶液呈红色。 |
您最近一年使用:0次
【推荐1】去除粗盐中少量 、
、 和
和 的实验步骤如下:
的实验步骤如下:
Ⅰ.取一定量粗盐于烧杯中,加蒸馏水搅拌,使粗盐全部溶解,得到粗盐水。
Ⅱ.在粗盐水依次加入适当过量的试剂A、试剂B和试剂C,静置后过滤,除去沉淀,得到滤液。
Ⅲ.向所得滤液加盐酸,蒸发结晶可得到去除杂质离子的精盐。
提供的试剂:粗食盐、饱和 溶液、20%
溶液、20% 溶液、
溶液、
 溶液、
溶液、 盐酸、蒸馏水、pH试纸。
盐酸、蒸馏水、pH试纸。
请回答:
(1)步骤Ⅱ,试剂A、B、C分别是_______ 、 、
、_______ (只需填化学式)。
(2)步骤Ⅱ,证明 已沉淀完全的方法
已沉淀完全的方法_______ 。
(3)步骤Ⅲ,加入盐酸的目的_______ 。
(4)步骤Ⅲ,用_______ (填仪器名称)将蒸发皿夹持到陶土网上冷却。
 、
、 和
和 的实验步骤如下:
的实验步骤如下:Ⅰ.取一定量粗盐于烧杯中,加蒸馏水搅拌,使粗盐全部溶解,得到粗盐水。
Ⅱ.在粗盐水依次加入适当过量的试剂A、试剂B和试剂C,静置后过滤,除去沉淀,得到滤液。
Ⅲ.向所得滤液加盐酸,蒸发结晶可得到去除杂质离子的精盐。
提供的试剂:粗食盐、饱和
 溶液、20%
溶液、20% 溶液、
溶液、
 溶液、
溶液、 盐酸、蒸馏水、pH试纸。
盐酸、蒸馏水、pH试纸。请回答:
(1)步骤Ⅱ,试剂A、B、C分别是
 、
、(2)步骤Ⅱ,证明
 已沉淀完全的方法
已沉淀完全的方法(3)步骤Ⅲ,加入盐酸的目的
(4)步骤Ⅲ,用
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐2】某学生利用如图所示装置进行“铁与水蒸气反应”的实验,并利用产物进一步制取FeCl3·6H2O晶体。(图中夹持及尾气处理装置均已略去),已知3Fe+4H2O(g) Fe3O4+4H2。
Fe3O4+4H2。
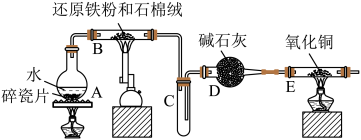
回答下列问题:
(1)所用铁粉中若有铝粉,欲除去混有的铝粉可以选用的试剂为_____ (填字母)。
A.稀盐酸 B.氢氧化钠溶液
C.浓硫酸 D.FeCl3溶液
此步涉及反应的离子方程式为_____ ;将经除杂后的铁粉进一步干燥后装入反应容器。
(2)D装置的作用:_____ 。
(3)该小组学生向B中反应后的生成物中加入足量的盐酸,过滤,用上述滤液制取FeCl3·6H2O晶体,设计流程如下:滤液 FeCl3溶液
FeCl3溶液 FeCl3·6H2O晶体
FeCl3·6H2O晶体
用离子方程式表示步骤Ⅰ中通入Cl2的作用并用单线桥表示电子转移的方向和数目:____ 。
 Fe3O4+4H2。
Fe3O4+4H2。
回答下列问题:
(1)所用铁粉中若有铝粉,欲除去混有的铝粉可以选用的试剂为
A.稀盐酸 B.氢氧化钠溶液
C.浓硫酸 D.FeCl3溶液
此步涉及反应的离子方程式为
(2)D装置的作用:
(3)该小组学生向B中反应后的生成物中加入足量的盐酸,过滤,用上述滤液制取FeCl3·6H2O晶体,设计流程如下:滤液
 FeCl3溶液
FeCl3溶液 FeCl3·6H2O晶体
FeCl3·6H2O晶体用离子方程式表示步骤Ⅰ中通入Cl2的作用并用单线桥表示电子转移的方向和数目:
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐3】碘化钾可用于有机合成、制药等,它是一种白色立方结晶或粉末,易溶于水。实验室制备KI的实验装置如下:

实验步骤如下:
①在上图所示的C中加入127g研细的单质I2和195g30%的KOH溶液,剧烈搅拌。
②I2完全反应后,打开弹簧夹向其中通入足量的H2S。
③将装置C中所得溶液用稀H2SO4酸化后,置于水浴上加热10min。
④在装置C的溶液中加入BaCO3,充分搅拌后,过滤、洗涤。
⑤将滤液用氢碘酸酸化,蒸发浓缩至表面出现结晶膜,________、________、洗涤、干燥。
⑥得产品145g。
回答下列问题:
(1)步骤①将碘研细的目的是________________________________________________ 。
(2)装置A中发生反应的离子方程式为__________________________________________ ;
装置B中的试剂是________ ,C装置的名称是________ 。
(3)装置C中I2与KOH反应产物之一是KIO3,该反应的化学方程式为___________ 。
(4)步骤④的目的是_________________________________________________________ 。
(5)补充完整步骤⑤:______________ 、______________ 。

实验步骤如下:
①在上图所示的C中加入127g研细的单质I2和195g30%的KOH溶液,剧烈搅拌。
②I2完全反应后,打开弹簧夹向其中通入足量的H2S。
③将装置C中所得溶液用稀H2SO4酸化后,置于水浴上加热10min。
④在装置C的溶液中加入BaCO3,充分搅拌后,过滤、洗涤。
⑤将滤液用氢碘酸酸化,蒸发浓缩至表面出现结晶膜,________、________、洗涤、干燥。
⑥得产品145g。
回答下列问题:
(1)步骤①将碘研细的目的是
(2)装置A中发生反应的离子方程式为
装置B中的试剂是
(3)装置C中I2与KOH反应产物之一是KIO3,该反应的化学方程式为
(4)步骤④的目的是
(5)补充完整步骤⑤:
您最近一年使用:0次



