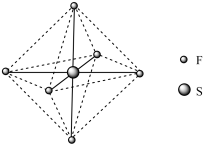
和
和 均是化工中重要的化合物。已知
均是化工中重要的化合物。已知 的熔点是
的熔点是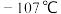 ,
, 的熔点是
的熔点是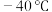 ,则下列说法正确的是
,则下列说法正确的是A. 和 和 均为非极性分子 均为非极性分子 |
B.液态 和 和 气化时克服的微粒间作用力相同 气化时克服的微粒间作用力相同 |
C. 和 和 中每个原子均满足8电子稳定结构 中每个原子均满足8电子稳定结构 |
D. 键能比 键能比 键能大,则 键能大,则 的熔点高于 的熔点高于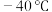 |
更新时间:2023-01-14 22:41:34
|
相似题推荐
单选题
|
适中
(0.65)
【推荐1】下列说法正确的是
A.HCl和 分子中均含有 分子中均含有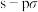 键 键 |
B.甲醛(HCHO)中H—C—H的键角小于光气( )中Cl—C—Cl的键角; )中Cl—C—Cl的键角; 键角大于 键角大于 键角 键角 |
C. 是由极性键组成的极性较弱的分子,它在 是由极性键组成的极性较弱的分子,它在 中的溶解度高于在水中的溶解度 中的溶解度高于在水中的溶解度 |
D.酸性: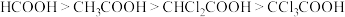 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐2】用价电子对互斥理论(VSEPR)可以预测许多分子或离子的空间构型,也可推测键角大小,下列判断正确的是
| A.COCl2(光气)是平面三角形分子 | B.BeCl2是V形分子 |
| C.CS2键角等于120° | D. 键角小于 键角小于 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐3】氯化亚铜的化学式CuCl或Cu2Cl2,为白色立方结晶或白色粉末。微溶于水,可溶于不同浓度的KCl溶液,生成[CuCl2]-、[CuCl3]2-和[CuCl4]3-等离子。例如:CuCl(s)+2Cl-(aq) [CuCl3]2-(aq) △H。氯化亚铜溶于氨水生成氯化二氨合亚铜([Cu(NH3)2]Cl),不溶于乙醇。下列说法正确的是
[CuCl3]2-(aq) △H。氯化亚铜溶于氨水生成氯化二氨合亚铜([Cu(NH3)2]Cl),不溶于乙醇。下列说法正确的是
 [CuCl3]2-(aq) △H。氯化亚铜溶于氨水生成氯化二氨合亚铜([Cu(NH3)2]Cl),不溶于乙醇。下列说法正确的是
[CuCl3]2-(aq) △H。氯化亚铜溶于氨水生成氯化二氨合亚铜([Cu(NH3)2]Cl),不溶于乙醇。下列说法正确的是| A.NH3不能形成分子间氢键 | B.HCuCl2中有3个配位键 |
| C.NH3的键角大于H2O的键角 | D.[Cu(NH3)2]Cl中提供孤电子对的原子是N和Cl |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐1】下列推测合理的是
A. 和 和 都是正四面体形分子且键角都为 都是正四面体形分子且键角都为 |
B.相同条件下, 的酸性弱于 的酸性弱于 |
| C.相同条件下,邻羟基苯甲酸的沸点高于对羟基苯甲酸 |
D. 分子中各原子的最外层电子都满足8电子稳定结构 分子中各原子的最外层电子都满足8电子稳定结构 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐2】下列各组分子空间构型和极性均相同的是
A. 和 和 | B. 和 和 | C. 和 和 | D. 和 和 |
您最近一年使用:0次
单选题
|
适中
(0.65)
解题方法
【推荐1】短周期主族元素X、Y、Z、W的原子序数依次增大,它们原子的最外层电子数之和为18,X、Z基态原子的p轨道上均有2个未成对电子,W与X位于同一主族。下列说法正确的是
| A.WX2分子为极性分子 |
| B.元素电负性:Z>W |
| C.原子半径:r(W)>r(Z)>r(Y) |
| D.最高价氧化物水化物的酸性:Z>W |
您最近一年使用:0次
【推荐2】下列实验操作、现象和结论均正确的是
| 选项 | 实验操作 | 现象 | 结论 |
| A | 向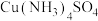 溶液中滴加乙醇 溶液中滴加乙醇 | 析出深蓝色晶体 | 乙醇是非极性分子 |
| B | 在酸性 溶液中滴加对甲基苯酚 溶液中滴加对甲基苯酚 | 溶液颜色变浅 | 酚羟基具有还原性 |
| C | 在电石上滴加饱和食盐水,将产生的气体通入溴水中 | 溴水褪色 | 一定是乙炔与溴发生反应 |
| D | 在 溶液中滴加 溶液中滴加 溶液 溶液 | 没有白色沉淀产生 |  位于配合物内界 位于配合物内界 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐1】下列有关说法中正确的是 ( )
| A.12C、13C、14C是碳的三种同素异形体 |
| B.HCl、HBr、HI的稳定性逐渐减弱,而熔沸点逐渐升高 |
| C.液态 HCl、固态 AgCl 均不导电,所以 HCl、AgCl 是非电解质 |
| D.NaHSO4在熔融状态下不仅破坏了离子键,还破坏了共价键 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
解题方法
【推荐2】下列说法不正确的是


| A.钠电离最外层一个电子所需要的能量:①>② |
B.已知 分子为正四面体, 分子为正四面体, 中的∠O-P-O小于 中的∠O-P-O小于 中的∠O-P-O 中的∠O-P-O |
| C.水中的氢键可以表示为O-H…O,其中H…O之间的距离即为该氢键的键长 |
| D.乙烯分子中的σ键和π键数目之比为5:1 |
您最近一年使用:0次

 的沸点较低
的沸点较低 可发生反应:
可发生反应:
 杂化轨道上有未成对电子,易两分子
杂化轨道上有未成对电子,易两分子 键
键 与
与 加成的主要产物是
加成的主要产物是
 的电负性较大,使双键电子云向中心碳原子偏移;
的电负性较大,使双键电子云向中心碳原子偏移; 和
和