高铁酸钾( )是20世纪70年代以来开发的一种继臭氧、过氧化氢之后的新型水处理剂,且还原产物
)是20世纪70年代以来开发的一种继臭氧、过氧化氢之后的新型水处理剂,且还原产物 可以作为净水剂,不存在二次污染;分解产物为氧气,不会造成环境污染。某化学兴趣小组计划用铁锈(主要成分为
可以作为净水剂,不存在二次污染;分解产物为氧气,不会造成环境污染。某化学兴趣小组计划用铁锈(主要成分为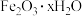 )制备高铁酸钾,其工艺流程如图。根据工艺流程并结合所学知识,回答下列问题:
)制备高铁酸钾,其工艺流程如图。根据工艺流程并结合所学知识,回答下列问题:

(1) 中Fe呈
中Fe呈___ 价;列举 常见的一种用途:
常见的一种用途:________ 。
(2)该小组同学准备利用KMnO4与浓盐酸制取Cl2,请写出该反应的离子方程式:__________ ;用电子式表示Cl2的形成过程:_________________ 。
(3)已知:低温时,Cl2与NaOH生成NaClO与NaCl;高温时,Cl2与NaOH反应生成NaClO3与NaCl。若测得Cl2与KOH反应后的溶液中c(K+)=8 mol∙L−1,且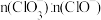 =1:5,则溶液中c(ClO-)=
=1:5,则溶液中c(ClO-)=______ mol∙L−1。(设KOH与Cl2恰好完全反应)
(4)该流程中进行了多次过滤操作,请写出过滤时需要用到的玻璃仪器:___________ 。
(5) 在高温下会分解产生Fe2O3和O2,若高铁酸钾分解收集到672mL气体(标准状况下,气体全部逸出),此时转移的电子的物质的量为
在高温下会分解产生Fe2O3和O2,若高铁酸钾分解收集到672mL气体(标准状况下,气体全部逸出),此时转移的电子的物质的量为________ mol。
 )是20世纪70年代以来开发的一种继臭氧、过氧化氢之后的新型水处理剂,且还原产物
)是20世纪70年代以来开发的一种继臭氧、过氧化氢之后的新型水处理剂,且还原产物 可以作为净水剂,不存在二次污染;分解产物为氧气,不会造成环境污染。某化学兴趣小组计划用铁锈(主要成分为
可以作为净水剂,不存在二次污染;分解产物为氧气,不会造成环境污染。某化学兴趣小组计划用铁锈(主要成分为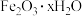 )制备高铁酸钾,其工艺流程如图。根据工艺流程并结合所学知识,回答下列问题:
)制备高铁酸钾,其工艺流程如图。根据工艺流程并结合所学知识,回答下列问题:
(1)
 中Fe呈
中Fe呈 常见的一种用途:
常见的一种用途:(2)该小组同学准备利用KMnO4与浓盐酸制取Cl2,请写出该反应的离子方程式:
(3)已知:低温时,Cl2与NaOH生成NaClO与NaCl;高温时,Cl2与NaOH反应生成NaClO3与NaCl。若测得Cl2与KOH反应后的溶液中c(K+)=8 mol∙L−1,且
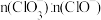 =1:5,则溶液中c(ClO-)=
=1:5,则溶液中c(ClO-)=(4)该流程中进行了多次过滤操作,请写出过滤时需要用到的玻璃仪器:
(5)
 在高温下会分解产生Fe2O3和O2,若高铁酸钾分解收集到672mL气体(标准状况下,气体全部逸出),此时转移的电子的物质的量为
在高温下会分解产生Fe2O3和O2,若高铁酸钾分解收集到672mL气体(标准状况下,气体全部逸出),此时转移的电子的物质的量为
更新时间:2023-02-15 21:51:30
|
相似题推荐
解答题-原理综合题
|
较易
(0.85)
解题方法
【推荐1】高铁酸钠(Na2FeO4)是水处理过程中的一种新型的绿色多功能净水剂。其净水过程中所发生的化学反应主要为4Na2FeO4+10H2O=4Fe(OH)3(胶体)+3O2↑+8NaOH。相比传统的用氯气进行水的消毒处理,高铁酸钠安全无异味,投加更方便。请回答下列问题:
(1)高铁酸钠(Na2FeO4)属于_______ (“酸”、“碱”、“盐”或“氧化物”),其中铁的化合价为_______ 价;与O2互为同素异形体的物质的化学式为_______ 。
(2)将上述反应的化学方程式改写成离子方程式:_______ ,该反应中物质的氧化性大小关系是:Na2FeO4_______ O2。
(3)实验室制备Fe(OH)3胶体的操作:向烧杯中加入40 mL蒸馏水,将烧杯中的蒸馏水加热至沸腾,向沸水中逐滴加入5~6滴_______ (填化学式)饱和溶液,继续煮沸至_______ 呈_______ ,停止加热。
(4)当生成48 g O2时,至少有_______ g水参与反应,生成的NaOH的质量为_______ g。
(1)高铁酸钠(Na2FeO4)属于
(2)将上述反应的化学方程式改写成离子方程式:
(3)实验室制备Fe(OH)3胶体的操作:向烧杯中加入40 mL蒸馏水,将烧杯中的蒸馏水加热至沸腾,向沸水中逐滴加入5~6滴
(4)当生成48 g O2时,至少有
您最近一年使用:0次
解答题-工业流程题
|
较易
(0.85)
解题方法
【推荐2】钛和钛的合金在航天领域有着广泛的应用,因而有“空间金属”之称;工业上用钛铁矿(主要成分为 ,含有
,含有 等杂质)为原料制备金属钛的工艺流程如下:
等杂质)为原料制备金属钛的工艺流程如下:

已知:① 易水解生成不溶于水的
易水解生成不溶于水的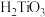 ;②高温下钛易与
;②高温下钛易与 等发生反应。
等发生反应。
(1)钛铁矿酸浸前需要粉碎,目的是___________ 。
(2)①钛铁矿粉末中 与稀硫酸发生反应的离子方程式为
与稀硫酸发生反应的离子方程式为___________ 。
②“滤渣I”的主要成分为___________ 和___________ ,工业上用稀硫酸浸取钛铁矿粉末时,温度不宜太高的原因是___________ 。
(3)写出高温下 转化为
转化为 的化学方程式
的化学方程式___________ 。
(4)镁与 高温下反应制备粗钛时需加保护气,下列可作为保护气的是
高温下反应制备粗钛时需加保护气,下列可作为保护气的是___________ (填标号)。
a. b.Ar c.
b.Ar c. d.
d.
(5)“粗钛”中含有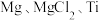 ,熔、沸点如下表所示。
,熔、沸点如下表所示。
可采用真空蒸馏的方法分离得到Ti.需加热的温度略高于___________ ℃即可。
 ,含有
,含有 等杂质)为原料制备金属钛的工艺流程如下:
等杂质)为原料制备金属钛的工艺流程如下:
已知:①
 易水解生成不溶于水的
易水解生成不溶于水的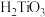 ;②高温下钛易与
;②高温下钛易与 等发生反应。
等发生反应。(1)钛铁矿酸浸前需要粉碎,目的是
(2)①钛铁矿粉末中
 与稀硫酸发生反应的离子方程式为
与稀硫酸发生反应的离子方程式为②“滤渣I”的主要成分为
(3)写出高温下
 转化为
转化为 的化学方程式
的化学方程式(4)镁与
 高温下反应制备粗钛时需加保护气,下列可作为保护气的是
高温下反应制备粗钛时需加保护气,下列可作为保护气的是a.
 b.Ar c.
b.Ar c. d.
d.
(5)“粗钛”中含有
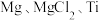 ,熔、沸点如下表所示。
,熔、沸点如下表所示。 |  |  |  | |
| 熔点/℃ |  | 648.8 | 714 | 1667 |
| 沸点/℃ | 136.4 | 1090 | 1412 | 3287 |
您最近一年使用:0次
解答题-工业流程题
|
较易
(0.85)
名校
解题方法
【推荐3】铜及其化合物在工业上有许多用途。回答下列问题:
(1)某工厂以辉铜矿(主要成分为 Cu2S,含少量 Fe2O3、SiO2等杂质)为原料制备不溶于水的碱式碳酸铜的流程如下:

①“浸取”反应中氧化剂的化学式为___________ ;若“浸取”反应中得到一种单质,则滤渣Ⅰ的成分为 MnO2和___________ (写化学式)。
②“除铁”这一步反应在25℃进行,加入的试剂 A 为___________ ,若加A后溶液的pH调为4,溶液中 Fe3+浓度为___________ mol∙L−1。{已知 Ksp[Fe(OH)3]=4.0×10−38}
③写出“沉锰”(除 Mn2+)过程中反应的离子方程式:___________ 。
④滤液Ⅱ经蒸发结晶得到的盐主要是___________ (写化学式)。
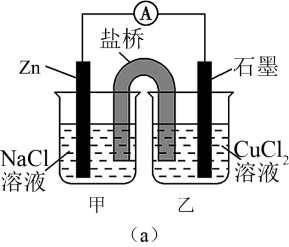
(2)如图(a)为某实验小组设计的原电池装置,盐桥内装载的是足量用饱和氯化钾溶液浸泡的琼脂,反应前两电极质量相等,一段时间后,两电极质量相差 25.8 g,则导线中通过了___________ mol 电子。
(1)某工厂以辉铜矿(主要成分为 Cu2S,含少量 Fe2O3、SiO2等杂质)为原料制备不溶于水的碱式碳酸铜的流程如下:

①“浸取”反应中氧化剂的化学式为
②“除铁”这一步反应在25℃进行,加入的试剂 A 为
③写出“沉锰”(除 Mn2+)过程中反应的离子方程式:
④滤液Ⅱ经蒸发结晶得到的盐主要是
(2)如图(a)为某实验小组设计的原电池装置,盐桥内装载的是足量用饱和氯化钾溶液浸泡的琼脂,反应前两电极质量相等,一段时间后,两电极质量相差 25.8 g,则导线中通过了

您最近一年使用:0次
解答题-实验探究题
|
较易
(0.85)
名校
【推荐1】双氧水和84消毒液是生活中常用的两种消毒剂,了解物质的性质是科学合理使用化学品的基础和前提,请回答下列问题:
(1)某同学设计如下实验研究H2O2的性质
①从理论上看H2O2既有氧化性又有还原性,原因是___________ 。
②能证明H2O2具有还原性的实验是___________ (填序号),可作为证据的实验现象是___________ (填字母)。
(2)84消毒液的有效成分为NaClO;
①84消毒液不能和洁厕灵(主要成分为较高浓度的盐酸)混用,否则易产生有毒气体,反应的化学方程式为___________ 。
②巴西奥运会期间,由于工作人员将84消毒液与双氧水混用,导致游泳池藻类快速生长,池水变绿。一种可能的原因是NaClO与H2O2反应产生O2促进藻类快速生长。该反应中氧化性:NaClO___________ H2O2 (填“>”或“<”)。反应的离子反应方程式为___________ 。
(1)某同学设计如下实验研究H2O2的性质
| 序号 | 实验 | 实验现象 |
| ⅰ | 向5% H2O2溶液中滴加酸性KMnO4溶液 | a.溶液紫色褪去 b.有大量气泡产生 |
| ⅱ | 向5% H2O2溶液中滴加淀粉碘化钾溶液 | c.溶液变蓝 |
②能证明H2O2具有还原性的实验是
(2)84消毒液的有效成分为NaClO;
①84消毒液不能和洁厕灵(主要成分为较高浓度的盐酸)混用,否则易产生有毒气体,反应的化学方程式为
②巴西奥运会期间,由于工作人员将84消毒液与双氧水混用,导致游泳池藻类快速生长,池水变绿。一种可能的原因是NaClO与H2O2反应产生O2促进藻类快速生长。该反应中氧化性:NaClO
您最近一年使用:0次
解答题-工业流程题
|
较易
(0.85)
解题方法
【推荐2】某课外小组研究铝土矿中 Al2O3的含量。查阅资料得知,铝土矿的主要成分是 Al2O3,杂质是 Fe2O3、 SiO2(已知 SiO2性质与 CO2相似,其形成的酸不溶于水)等。从铝土矿中提取 Al2O3 的过程如下:

(1)固体 B 是___________ (填化学式,下同);固体 C 是___________ (填化学式,下同)。
(2)第③步中,生成氢氧化铝的离子方程式是___________ 。
(3)工业上制取 AlCl3常用 Al2O3与碳单质、氯气在高温条件下反应,已知每消耗 0.5molC ,转移 1mol 电子, 则该反应的氧化产物为___________ (填化学式)。

(1)固体 B 是
(2)第③步中,生成氢氧化铝的离子方程式是
(3)工业上制取 AlCl3常用 Al2O3与碳单质、氯气在高温条件下反应,已知每消耗 0.5molC ,转移 1mol 电子, 则该反应的氧化产物为
您最近一年使用:0次
解答题-工业流程题
|
较易
(0.85)
【推荐3】酸性锌锰干电池是一次性电池,外壳为金属锌,中间是碳棒,其周围是由碳粉、MnO2和NH4Cl等组成的糊状填充物。该电池放电反应为:Zn+2NH4C1 +2MnO2= Zn(NH3)2Cl2+2MnOOH现以该废电池制备高锰酸钾的流程如下:
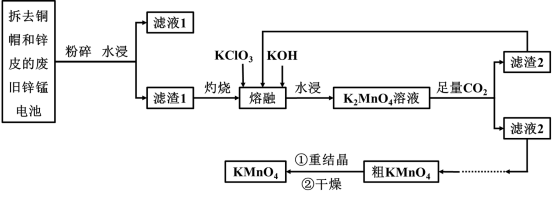
(1)滤液1的主要成分是_______ ,灼烧的目的是除去_____ (填名称)并使MnOOH转化为______ (填化学式)
(2)熔融时发生反应的化学方程式为_______ ,K2MnO4溶液中通入足量CO2反应的离子方程式为______ 。
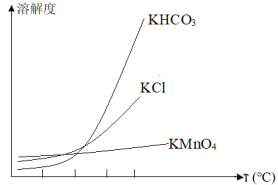
(3)已知:物质的溶解度曲线如图所示,滤液2得粗KMnO4操作是______ 、_____ 。
(4)干燥KMnO4晶体时温度不宜过高的理由是____ 。
(5)称取6.448g上述制得的KMnO4晶体(不含有与草酸反应的杂质),配成100mL溶液,用移液管移取25.00mL该溶液于锥形瓶,用酸酸化,再用1.010 mol∙L−1 H2C2O4溶液滴定三次平均消耗H2C2O4溶液体积为24.75mL.则KMnO4晶体的纯度为_______ %[Mr(MO4) =158]

(1)滤液1的主要成分是
(2)熔融时发生反应的化学方程式为
(3)已知:物质的溶解度曲线如图所示,滤液2得粗KMnO4操作是

(4)干燥KMnO4晶体时温度不宜过高的理由是
(5)称取6.448g上述制得的KMnO4晶体(不含有与草酸反应的杂质),配成100mL溶液,用移液管移取25.00mL该溶液于锥形瓶,用酸酸化,再用1.010 mol∙L−1 H2C2O4溶液滴定三次平均消耗H2C2O4溶液体积为24.75mL.则KMnO4晶体的纯度为
您最近一年使用:0次
解答题-实验探究题
|
较易
(0.85)
名校
【推荐1】某同学设计实验以探究元素性质的递变规律,实验装置如图1所示。甲同学根据元素非金属性与对应最高价含氧酸之间的关系,设计了如图1装置来一次性完成N、C、Si三种非金属元素的非金属性强弱比较的实验研究。乙同学设计了如图2装置实验来验证卤族元素性质的递变规律(夹持装置已略去)。A、B、C三个胶头滴管分别是氯酸钾溶液、 溶液、淀粉
溶液、淀粉 溶液。已知常温下浓盐酸与氯酸钾溶液能反应生成氯气。
溶液。已知常温下浓盐酸与氯酸钾溶液能反应生成氯气。

(1)仪器a的名称是___________ 。
(2)图1装置内的物质为:B:___________ ,C___________ ;(填序号)
①饱和碳酸氢钠溶液 ②浓硫酸溶液 ③硅酸钠溶液 ④饱和氯化钠溶液
(3)乙同学具体操作如下:
i.先挤压A,使少量溶液滴入烧瓶内,可观察到烧瓶中有黄绿色气体生成;其主要反应的化学方程式为___________ 。
ii.挤压B,使稍过量溶液滴下充分反应的主要离子方程式为___________ 。
iii.再挤压C,使少量溶液滴入烧瓶内,可观察到的颜色变化___________ 。
(4)根据乙同学的实验可得到的结论是:___________ 。
 溶液、淀粉
溶液、淀粉 溶液。已知常温下浓盐酸与氯酸钾溶液能反应生成氯气。
溶液。已知常温下浓盐酸与氯酸钾溶液能反应生成氯气。
(1)仪器a的名称是
(2)图1装置内的物质为:B:
①饱和碳酸氢钠溶液 ②浓硫酸溶液 ③硅酸钠溶液 ④饱和氯化钠溶液
(3)乙同学具体操作如下:
i.先挤压A,使少量溶液滴入烧瓶内,可观察到烧瓶中有黄绿色气体生成;其主要反应的化学方程式为
ii.挤压B,使稍过量溶液滴下充分反应的主要离子方程式为
iii.再挤压C,使少量溶液滴入烧瓶内,可观察到的颜色变化
(4)根据乙同学的实验可得到的结论是:
您最近一年使用:0次
解答题-实验探究题
|
较易
(0.85)
名校
【推荐2】下图是某化学兴趣小组同学们设计的一套制取纯净干燥氯气,并进行氯气收集和尾气处理的实验装置(夹持仪器已省略)。

(1)仪器a的名称为___________ ,字母b所指装置的作用是___________ 。
(2)整套实验装置装配好后,首先需进行的必要操作是___________ 。
(3)高锰酸钾与浓盐酸反应的离子方程式为___________ 。
(4)实验小组同学计划在反应结束后向A装置中继续通一会儿氮气,这样做的目的是_____ 。
(5)实验室收集氯气除装置D的方法外,还可用___________ 法收集。
(6)装置E中倒扣漏斗的作用是___________ 。

(1)仪器a的名称为
(2)整套实验装置装配好后,首先需进行的必要操作是
(3)高锰酸钾与浓盐酸反应的离子方程式为
(4)实验小组同学计划在反应结束后向A装置中继续通一会儿氮气,这样做的目的是
(5)实验室收集氯气除装置D的方法外,还可用
(6)装置E中倒扣漏斗的作用是
您最近一年使用:0次
解答题-实验探究题
|
较易
(0.85)
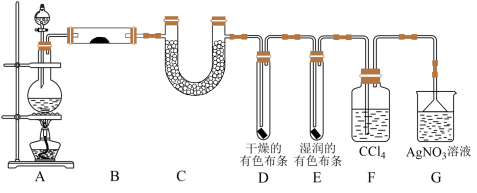
【推荐3】某校化学实验兴趣小组为了验证在实验室制备 的过程中有水蒸气和HCl挥发出来,同时证明氯气的某些性质,甲同学设计了如图所示的实验装置。
的过程中有水蒸气和HCl挥发出来,同时证明氯气的某些性质,甲同学设计了如图所示的实验装置。
已知: 易溶于
易溶于 ,而HCl不溶于
,而HCl不溶于 。
。
请回答下列问题:
(1)装置A中发生反应的化学方程式是_______ 。
(2)装置B中盛放的试剂为无水硫酸铜,作用是_______ 。
(3)装置D和E中出现不同现象的原因是_______ (结合化学方程式说明)。
(4)写出装置G中发生的主要反应的离子方程式_______ 。
(5)乙同学认为甲同学的实验有缺陷,不能确保最终通入 溶液中的气体只有一种,为了确保实验结论的可靠性,证明最终通入
溶液中的气体只有一种,为了确保实验结论的可靠性,证明最终通入 溶液的气体只有一种,乙同学提出在F与G两个装置之间再加一个装置,装置中应放入
溶液的气体只有一种,乙同学提出在F与G两个装置之间再加一个装置,装置中应放入_______ (填写试剂或用品名称)。
(6)丙同学认为可以将装置F中的液体换成NaOH溶液,你认为是否可行?理由是_______ 。
 的过程中有水蒸气和HCl挥发出来,同时证明氯气的某些性质,甲同学设计了如图所示的实验装置。
的过程中有水蒸气和HCl挥发出来,同时证明氯气的某些性质,甲同学设计了如图所示的实验装置。
已知:
 易溶于
易溶于 ,而HCl不溶于
,而HCl不溶于 。
。请回答下列问题:
(1)装置A中发生反应的化学方程式是
(2)装置B中盛放的试剂为无水硫酸铜,作用是
(3)装置D和E中出现不同现象的原因是
(4)写出装置G中发生的主要反应的离子方程式
(5)乙同学认为甲同学的实验有缺陷,不能确保最终通入
 溶液中的气体只有一种,为了确保实验结论的可靠性,证明最终通入
溶液中的气体只有一种,为了确保实验结论的可靠性,证明最终通入 溶液的气体只有一种,乙同学提出在F与G两个装置之间再加一个装置,装置中应放入
溶液的气体只有一种,乙同学提出在F与G两个装置之间再加一个装置,装置中应放入(6)丙同学认为可以将装置F中的液体换成NaOH溶液,你认为是否可行?理由是
您最近一年使用:0次
解答题-实验探究题
|
较易
(0.85)
解题方法
【推荐1】Ⅰ.铁是一种常见的金属,它的单质及化合物在生活生产中处处可见。
(1)苹果中含有丰富的铁元素,新榨的苹果汁是浅绿色的,在空气中久置后会变成黄色,原因是___________ ,若再向其中加入少量的维生素C,又将恢复浅绿色,上述过程中,氧气是___________ 剂(选填“氧化”或“还原”,下同),维生素C是___________ 剂。
Ⅱ.铁及其重要化合物的“价类二维图”如下图所示。___________ 。
(3)要实现Fe转化为Fe3O4,除了将Fe与氧气点燃外,另外的方法是(写出化学方程式)___________ 。
(4)下列关于金属冶炼的说法中正确的是____;
(5)有关合金的说法错误的是____。
(6)生活中的钢铁制品如废旧铁锅,使用时间长久后若要丢弃,应归为____。
(7)在烧制砖瓦时,用黏土做成的坯经过烘烧后,铁的化合物转化成而制得红色砖瓦____。
(8)要实现Fe转化为Fe2+,可选用足量的____。
(9)下列各组离子在溶液中能大量共存的是____。
(10)有失去标签的NaCl、FeCl2、FeCl3、MgCl2四种溶液,只需要一种试剂就可以把它们鉴别开来,这种试剂是____。
Ⅲ.某化学兴趣小组同学设计以下实验探究氢氧化亚铁的制备:
两组同学分别设计如下实验探究能较长时间观察到白色Fe(OH)2沉淀的制取方法。
A组实验:用NaOH溶液和FeSO4溶液直接反应。(如图)___________ 。
(12)该方法能观察到白色Fe(OH)2沉淀,但沉淀颜色快速发生变化,其颜色变化为___________ 。
B组实验:选用稀硫酸、铁粉、NaOH溶液进行实验,装置如图。___________ (填“打开”或“关闭”)止水夹K,然后打开分液漏斗的玻璃塞和活塞,使稀硫酸与铁粉反应,一段时间后,___________ (填“打开”或“关闭”)止水夹K,制得白色Fe(OH)2沉淀,且沉淀能持续一段时间不变色。
(1)苹果中含有丰富的铁元素,新榨的苹果汁是浅绿色的,在空气中久置后会变成黄色,原因是
Ⅱ.铁及其重要化合物的“价类二维图”如下图所示。

(3)要实现Fe转化为Fe3O4,除了将Fe与氧气点燃外,另外的方法是(写出化学方程式)
(4)下列关于金属冶炼的说法中正确的是____;
| A.通过电解饱和食盐水制备金属钠 |
| B.热还原法常用的还原剂有CO、H2、C等 |
| C.金属Mg、Al均能通过电解熔融氯化物的方法获得 |
| D.人类历史上金属被发现的顺序与金属的活泼性无关 |
(5)有关合金的说法错误的是____。
| A.熔点通常低于组成金属 | B.任意两种金属均可以形成合金 |
| C.钢比生铁的含碳量低 | D.可能含有非金属 |
(6)生活中的钢铁制品如废旧铁锅,使用时间长久后若要丢弃,应归为____。
| A.干垃圾 | B.湿垃圾 | C.有毒有害垃圾 | D.可回收垃圾 |
(7)在烧制砖瓦时,用黏土做成的坯经过烘烧后,铁的化合物转化成而制得红色砖瓦____。
| A.Fe2O3 | B.Fe3O4 | C.FeO | D.Fe(OH)3 |
(8)要实现Fe转化为Fe2+,可选用足量的____。
| A.浓硫酸 | B.氯气 | C.稀硝酸 | D.稀硫酸 |
(9)下列各组离子在溶液中能大量共存的是____。
A.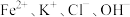 | B.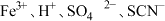 |
C. | D. |
(10)有失去标签的NaCl、FeCl2、FeCl3、MgCl2四种溶液,只需要一种试剂就可以把它们鉴别开来,这种试剂是____。
| A.氨水 | B.盐酸 | C.Na2SO4溶液 | D.KSCN溶液 |
Ⅲ.某化学兴趣小组同学设计以下实验探究氢氧化亚铁的制备:
两组同学分别设计如下实验探究能较长时间观察到白色Fe(OH)2沉淀的制取方法。
A组实验:用NaOH溶液和FeSO4溶液直接反应。(如图)

(12)该方法能观察到白色Fe(OH)2沉淀,但沉淀颜色快速发生变化,其颜色变化为
B组实验:选用稀硫酸、铁粉、NaOH溶液进行实验,装置如图。

您最近一年使用:0次
解答题-工业流程题
|
较易
(0.85)
名校
解题方法
【推荐2】工业上用铝土矿(含氧化铝、氧化铁)制取铝的过程如图:
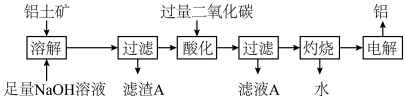
请回答下列问题:
(1)“滤渣A”的化学式为_____ ,该物质除了用于冶炼金属以外,还可用作____ 。
(2)通入“过量二氧化碳”时生成沉淀的离子方程式为________ 。
(3)往“滤液A”中加入适量的CaO后过滤,所得滤液可以加入___ 过程中循环利用。
(4)若铝土矿中还含有二氧化硅,则“灼烧”后所得固体中混有的杂质为___ (填化学式)。

请回答下列问题:
(1)“滤渣A”的化学式为
(2)通入“过量二氧化碳”时生成沉淀的离子方程式为
(3)往“滤液A”中加入适量的CaO后过滤,所得滤液可以加入
(4)若铝土矿中还含有二氧化硅,则“灼烧”后所得固体中混有的杂质为
您最近一年使用:0次
解答题-工业流程题
|
较易
(0.85)
名校
解题方法
【推荐3】无水AlCl3易升华,可用作有机合成的催化剂等。工业上以铝土矿(Al2O3、Fe2O3)为原料制备无水AlCl3的工艺流程如下:
(1)氧化铁的颜色为___________ 。
(2)氯化炉中Al2O3、Cl2和C反应的化学方程式为___________ 。
(3)用Na2SO3溶液可除去冷却器排出的尾气中的Cl2,请配平该反应的离子方程式:___________ 。
 +___________Cl2+___________= ___________
+___________Cl2+___________= ___________ +___________Cl-+___________
+___________Cl-+___________ ;
;
(4)升华器中主要含有AlCl3和FeCl3,需加入少量Al除去其中的FeCl3杂质,请设计实验方案检验FeCl3杂质是否除净:___________ 。
(5)为测定制得的无水AlCl3产品(含杂质FeCl3)的纯度,称取l6.25g无水AlCl3样品,溶于过量的NaOH溶液中,过滤出沉淀物,沉淀物经洗涤、灼烧、冷却、称重,得其质量为0.32g。
①写出加入过量NaOH溶液时发生反应的离子方程式:___________ 、___________ 。
②AlCl3产品的纯度为___________ 。
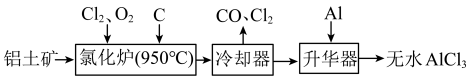
(1)氧化铁的颜色为
(2)氯化炉中Al2O3、Cl2和C反应的化学方程式为
(3)用Na2SO3溶液可除去冷却器排出的尾气中的Cl2,请配平该反应的离子方程式:
 +___________Cl2+___________= ___________
+___________Cl2+___________= ___________ +___________Cl-+___________
+___________Cl-+___________ ;
;(4)升华器中主要含有AlCl3和FeCl3,需加入少量Al除去其中的FeCl3杂质,请设计实验方案检验FeCl3杂质是否除净:
(5)为测定制得的无水AlCl3产品(含杂质FeCl3)的纯度,称取l6.25g无水AlCl3样品,溶于过量的NaOH溶液中,过滤出沉淀物,沉淀物经洗涤、灼烧、冷却、称重,得其质量为0.32g。
①写出加入过量NaOH溶液时发生反应的离子方程式:
②AlCl3产品的纯度为
您最近一年使用:0次



