镍是一种常用的催化剂。以红土镍矿(主要含有 、
、 、
、 、
、 等)为原料,制取纳米镍粉,同时获得净水剂黄钠铁矾
等)为原料,制取纳米镍粉,同时获得净水剂黄钠铁矾 的工艺流程如下:
的工艺流程如下:
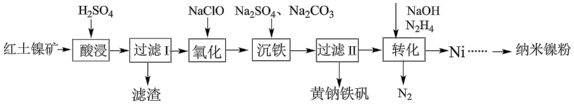
回答下列问题:
(1)黄钠铁矾 中,铁的化合价为
中,铁的化合价为_______ 价;黄钠铁矾能净水的原因是_______ 。
(2)过滤操作时要遵循“一贴、二低、三靠”的原则,其中“二低”指的是滤纸边缘略低于漏斗口、_______ 。
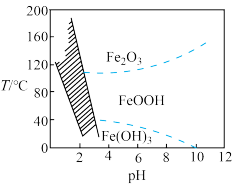
(3)“沉铁”过程加入 的目的是
的目的是_______ ,控制不同的条件可以得到不同的沉淀,所得沉淀与温度、 的关系如图所示(图中阴影部分表示的是黄钠铁矾稳定存在区域)。若反应在120℃时进行,加入的
的关系如图所示(图中阴影部分表示的是黄钠铁矾稳定存在区域)。若反应在120℃时进行,加入的 偏多,则所得黄钠铁矾中混有的杂质是
偏多,则所得黄钠铁矾中混有的杂质是_______ (填化学式)。
(4)“转化”过程,向“过滤II”所得滤液(富含 )中加入
)中加入 ,控制溶液中
,控制溶液中 的浓度,可得到不同晶态物质(
的浓度,可得到不同晶态物质(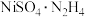 、
、 或二者的混合物)。当生成
或二者的混合物)。当生成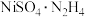 和
和 的物质的量之比为
的物质的量之比为 时,该反应的离子方程式为
时,该反应的离子方程式为_______ ;在其他条件不变的情况下,随 浓度增大,产物中
浓度增大,产物中 的含量增加,原因是
的含量增加,原因是_______ 。
(5)化学镀镍是金属表面镀镍的常用方法,以 为镀液,次亚磷酸钠
为镀液,次亚磷酸钠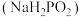 为还原剂,在90℃的酸性溶液中发生反应,
为还原剂,在90℃的酸性溶液中发生反应, 被氧化为亚磷酸
被氧化为亚磷酸 。写出化学镀镍反应的离子方程式:
。写出化学镀镍反应的离子方程式:_______ 。
 、
、 、
、 、
、 等)为原料,制取纳米镍粉,同时获得净水剂黄钠铁矾
等)为原料,制取纳米镍粉,同时获得净水剂黄钠铁矾 的工艺流程如下:
的工艺流程如下:
回答下列问题:
(1)黄钠铁矾
 中,铁的化合价为
中,铁的化合价为(2)过滤操作时要遵循“一贴、二低、三靠”的原则,其中“二低”指的是滤纸边缘略低于漏斗口、
(3)“沉铁”过程加入
 的目的是
的目的是 的关系如图所示(图中阴影部分表示的是黄钠铁矾稳定存在区域)。若反应在120℃时进行,加入的
的关系如图所示(图中阴影部分表示的是黄钠铁矾稳定存在区域)。若反应在120℃时进行,加入的 偏多,则所得黄钠铁矾中混有的杂质是
偏多,则所得黄钠铁矾中混有的杂质是
(4)“转化”过程,向“过滤II”所得滤液(富含
 )中加入
)中加入 ,控制溶液中
,控制溶液中 的浓度,可得到不同晶态物质(
的浓度,可得到不同晶态物质(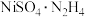 、
、 或二者的混合物)。当生成
或二者的混合物)。当生成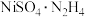 和
和 的物质的量之比为
的物质的量之比为 时,该反应的离子方程式为
时,该反应的离子方程式为 浓度增大,产物中
浓度增大,产物中 的含量增加,原因是
的含量增加,原因是(5)化学镀镍是金属表面镀镍的常用方法,以
 为镀液,次亚磷酸钠
为镀液,次亚磷酸钠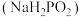 为还原剂,在90℃的酸性溶液中发生反应,
为还原剂,在90℃的酸性溶液中发生反应, 被氧化为亚磷酸
被氧化为亚磷酸 。写出化学镀镍反应的离子方程式:
。写出化学镀镍反应的离子方程式:
更新时间:2023-03-09 01:36:12
|
相似题推荐
解答题-无机推断题
|
适中
(0.65)
名校
【推荐1】离子反应是中学化学中重要的反应类型,回答下列问题:
(1)在发生离子反应的反应物或生成物中,一定存在___________ (填序号)。
①单质 ②化合物 ③酸 ④碱 ⑤盐 ⑥氧化物 ⑦电解质
(2)将两种盐混合后溶于水得到一种无色透明溶液,溶液中含有下列离子中的某些离子:H+、Na+、Mg2+、Cu2+、Ba2+、SO 、CO
、CO 和Cl-,取该溶液进行如下实验:
和Cl-,取该溶液进行如下实验:
Ⅰ.取少量溶液滴入紫色石蕊溶液,溶液呈红色。
Ⅱ.取少许溶液滴入过量的Ba(OH)2溶液,有白色沉淀产生。过滤,向沉淀中加入足量稀盐酸,沉淀不溶解。
Ⅲ.取步骤Ⅱ中滤液少许,先滴加硝酸酸化,再滴加AgNO3溶液,产生白色沉淀。
①根据以上现象判断,两种盐的混合溶液中肯定不存在的离子是___________ ;两种盐分别是___________ 。
②写出反应的离子方程式:
实验Ⅱ中滴入过量的Ba(OH)2溶液:___________ ;
实验Ⅲ中:___________ 。
③为检验该混合溶液中是否含有Cl-,某同学取原混合溶液少许,滴加AgNO3溶液,产生白色沉淀,证明溶液中含有Cl-。该同学的操作是否合理___________ (填“合理”或“不合理”),如果认为不合理,请说明你的理由___________ 。
(1)在发生离子反应的反应物或生成物中,一定存在
①单质 ②化合物 ③酸 ④碱 ⑤盐 ⑥氧化物 ⑦电解质
(2)将两种盐混合后溶于水得到一种无色透明溶液,溶液中含有下列离子中的某些离子:H+、Na+、Mg2+、Cu2+、Ba2+、SO
 、CO
、CO 和Cl-,取该溶液进行如下实验:
和Cl-,取该溶液进行如下实验:Ⅰ.取少量溶液滴入紫色石蕊溶液,溶液呈红色。
Ⅱ.取少许溶液滴入过量的Ba(OH)2溶液,有白色沉淀产生。过滤,向沉淀中加入足量稀盐酸,沉淀不溶解。
Ⅲ.取步骤Ⅱ中滤液少许,先滴加硝酸酸化,再滴加AgNO3溶液,产生白色沉淀。
①根据以上现象判断,两种盐的混合溶液中肯定不存在的离子是
②写出反应的离子方程式:
实验Ⅱ中滴入过量的Ba(OH)2溶液:
实验Ⅲ中:
③为检验该混合溶液中是否含有Cl-,某同学取原混合溶液少许,滴加AgNO3溶液,产生白色沉淀,证明溶液中含有Cl-。该同学的操作是否合理
您最近一年使用:0次
【推荐2】某学习小组通过下列装置探究MnO2与FeCl3•6H2O能否反应产生Cl2。

实验操作:点燃酒精灯,加热
实验现象:ⅰ.A中部分固体溶解,上方出现白雾
ⅱ.稍后,产生黄色气体,管壁附着黄色液滴
ⅲ.B中溶液变蓝
已知:①溴水为橙色;
②三氯化铁常温下为固体,熔点为282℃,300℃以上易升华,易溶于水。
(1)现象ⅰ中的白雾主要成分是______ (化学式)的水溶液。
(2)分析现象ⅰ和ⅱ,推测黄色气体的成分,有以下三种可能:
甲.同时存在Cl2和FeCl3 乙.FeCl3 丙.Cl2
①为检验黄色气体中是否存在氯化铁,应将黄色气体通入______ 溶液,溶液变红。黄色气体中存在氯化铁说明氯化铁具有的性质为______ 。
结论:甲或乙成立。
氯化铁可使B中溶液变蓝,反应的离子方程式是____________________ 。
②为进一步确认黄色气体中存在氯气,该小组提出以下2个方案:
Ⅰ.在A、B间增加盛有某种试剂的洗气瓶C除去FeCl3,观察到B中溶液变为蓝色。C中盛放的试剂是______ (填字母序号)
A.饱和NaHCO3溶液 B.NaOH溶液 C.饱和NaCl溶液
D.浓硫酸 E.Na2SO3溶液
Ⅱ.将B中KI—淀粉溶液替换为NaBr溶液,B中溶液呈橙色;并检验反应后不存在 。检验
。检验 的原因是
的原因是____________________ 。
选择NaBr溶液是由氧化剂氧化性的强弱决定,则 、Cl2、Br2的氧化性由强到弱的顺序为
、Cl2、Br2的氧化性由强到弱的顺序为______ 。
结论:甲成立。
(3)使用NaOH溶液处理尾气中存在的Cl2所对应的离子反应方程式为____________________ 。

实验操作:点燃酒精灯,加热
实验现象:ⅰ.A中部分固体溶解,上方出现白雾
ⅱ.稍后,产生黄色气体,管壁附着黄色液滴
ⅲ.B中溶液变蓝
已知:①溴水为橙色;
②三氯化铁常温下为固体,熔点为282℃,300℃以上易升华,易溶于水。
(1)现象ⅰ中的白雾主要成分是
(2)分析现象ⅰ和ⅱ,推测黄色气体的成分,有以下三种可能:
甲.同时存在Cl2和FeCl3 乙.FeCl3 丙.Cl2
①为检验黄色气体中是否存在氯化铁,应将黄色气体通入
结论:甲或乙成立。
氯化铁可使B中溶液变蓝,反应的离子方程式是
②为进一步确认黄色气体中存在氯气,该小组提出以下2个方案:
Ⅰ.在A、B间增加盛有某种试剂的洗气瓶C除去FeCl3,观察到B中溶液变为蓝色。C中盛放的试剂是
A.饱和NaHCO3溶液 B.NaOH溶液 C.饱和NaCl溶液
D.浓硫酸 E.Na2SO3溶液
Ⅱ.将B中KI—淀粉溶液替换为NaBr溶液,B中溶液呈橙色;并检验反应后不存在
 。检验
。检验 的原因是
的原因是选择NaBr溶液是由氧化剂氧化性的强弱决定,则
 、Cl2、Br2的氧化性由强到弱的顺序为
、Cl2、Br2的氧化性由强到弱的顺序为结论:甲成立。
(3)使用NaOH溶液处理尾气中存在的Cl2所对应的离子反应方程式为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐3】目前世界上新建的金矿中约有80%都采用氧化法提金。某工厂利用锌冶炼渣回收金、银等贵金属的流程如下图所示:
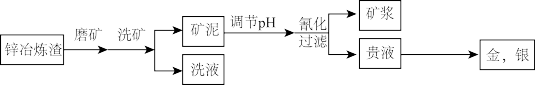
已知:HCN有剧毒,其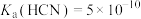 ,
, 平衡常数
平衡常数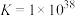
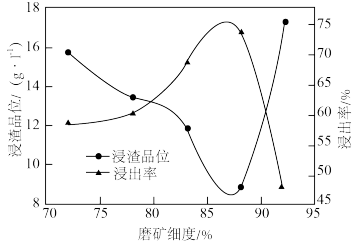
(1)磨矿细度对浸出率的影响如图所示,依据浸出率应选择磨矿细度_______ 为宜。
(2)生产中用生石灰调节矿泥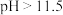 ,其目的之一是阻止溶液中的氰化物转化为HCN而挥发,其作用原理是
,其目的之一是阻止溶液中的氰化物转化为HCN而挥发,其作用原理是_______ (用离子方程式表示)。
(3)“氰化”环节,是以NaCN溶液浸取调节pH的矿泥,敞口放置,将Au转换为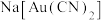 。
。
①其化学方程式为_______ 。
②“氰化”环节中,金的溶解速率在80℃时达到最大值,但生产中控制反应液的温度在10-20℃,原因是:_______ (答两点)。
③已知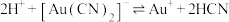 ,该反应的K=
,该反应的K=_______ (写出具体数值)。
(4)用锌还原 生成金,消耗的锌与生成的金的物质的量之比为
生成金,消耗的锌与生成的金的物质的量之比为_______ 。
(5)氰化物有剧毒,经合理处理就可以基本消除对环境的负面影响。 可消除水中的氰化物(如NaCN),经以下反应实现:
可消除水中的氰化物(如NaCN),经以下反应实现: 。生成物A的化学式为
。生成物A的化学式为_______ 。
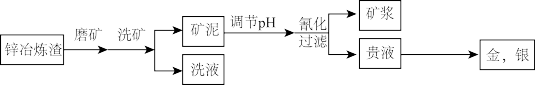
已知:HCN有剧毒,其
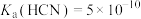 ,
, 平衡常数
平衡常数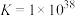
(1)磨矿细度对浸出率的影响如图所示,依据浸出率应选择磨矿细度

(2)生产中用生石灰调节矿泥
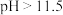 ,其目的之一是阻止溶液中的氰化物转化为HCN而挥发,其作用原理是
,其目的之一是阻止溶液中的氰化物转化为HCN而挥发,其作用原理是(3)“氰化”环节,是以NaCN溶液浸取调节pH的矿泥,敞口放置,将Au转换为
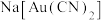 。
。①其化学方程式为
②“氰化”环节中,金的溶解速率在80℃时达到最大值,但生产中控制反应液的温度在10-20℃,原因是:
③已知
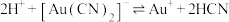 ,该反应的K=
,该反应的K=(4)用锌还原
 生成金,消耗的锌与生成的金的物质的量之比为
生成金,消耗的锌与生成的金的物质的量之比为(5)氰化物有剧毒,经合理处理就可以基本消除对环境的负面影响。
 可消除水中的氰化物(如NaCN),经以下反应实现:
可消除水中的氰化物(如NaCN),经以下反应实现: 。生成物A的化学式为
。生成物A的化学式为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐1】草酸钠(Na2C2O4),为草酸的钠盐,白色晶体,可溶于水,具有还原性,可作分析实验的基准试剂。分析实验中的计算要求保留四位有效数字,现分析实验室需配制 的草酸钠溶液100mL,用于标定高锰酸钾标准溶液的浓度。
的草酸钠溶液100mL,用于标定高锰酸钾标准溶液的浓度。
(1)计算及称量:经计算后用分析天平准确称取______ g草酸钠晶体。
(2)溶解:将草酸钠晶体转移至100mL______ 中,用适量的蒸馏水溶解,恢复至室温。
(3)转移:将恢复至室温后的溶液用玻璃棒小心地引流到______ 中,用蒸馏水______ 。轻轻振荡,使溶液混合均匀。
(4)定容:缓缓地将蒸馏水注入容量瓶中,直到液面距刻度线1~2cm时,改用______ 滴加蒸馏水至溶液凹液面正好与刻度线相切,塞上瓶塞,反复上下颠倒,摇匀。
(5)用配制的草酸钠溶液来测定高锰酸钾溶液的浓度,测定原理如下:______
 (配平方程式)
(配平方程式)
取该草酸钠溶液25.00mL,用一定浓度的高锰酸钾溶液滴定,恰好反应时,消耗高锰酸钾溶液22.00mL,则高锰酸钾溶液的浓度为______  。(写出计算过程)
。(写出计算过程)
 的草酸钠溶液100mL,用于标定高锰酸钾标准溶液的浓度。
的草酸钠溶液100mL,用于标定高锰酸钾标准溶液的浓度。(1)计算及称量:经计算后用分析天平准确称取
(2)溶解:将草酸钠晶体转移至100mL
(3)转移:将恢复至室温后的溶液用玻璃棒小心地引流到
(4)定容:缓缓地将蒸馏水注入容量瓶中,直到液面距刻度线1~2cm时,改用
(5)用配制的草酸钠溶液来测定高锰酸钾溶液的浓度,测定原理如下:
 (配平方程式)
(配平方程式)取该草酸钠溶液25.00mL,用一定浓度的高锰酸钾溶液滴定,恰好反应时,消耗高锰酸钾溶液22.00mL,则高锰酸钾溶液的浓度为
 。(写出计算过程)
。(写出计算过程)
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐2】一种类似钻石的装饰品——锆石(ZrSiO4),其做为装饰品,价格低廉,外观璀璨。天然锆石中常含有Fe、Al、Cu的氧化物杂质,称为锆英石。工业上一种以锆英石为原料制备ZrO2的工艺流程如下:
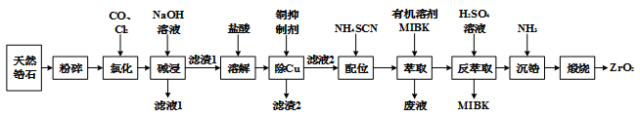
Ⅰ. Zr在化合物中通常显 价,氯化过程中除C、O元素外,其它元素均转化为其高价氯化物;
价,氯化过程中除C、O元素外,其它元素均转化为其高价氯化物;
Ⅱ.SiCl4极易水解生成硅酸;ZrCl4易溶于水,400℃升华
Ⅲ.Fe(SCN)3难溶于MIBK,Zr (SCN) 4在水中的溶解度小于在MIBK中的溶解度。
请回答下列问题
(1)滤渣1的主要成分是:______________
(2)①“氯化”过程中,锆石(ZrSiO4)发生反应的化学方程式为______________
②ZrCl4产率随温度、压强的变化如图所示,回答问题

“氯化”过程选择的最佳条件为_______ ;“氯化”环节产率随温度升高先增大后减小的原因为______
(3)“滤液1”中含有的阴离子,除OH-外还有____________________
(4)①常用的铜抑制剂为NaCN (氰化钠),NaCN可与重金属阳离子反应,生成溶度积较小的沉淀(如Cu(CN)2,Ksp=4×10-10),已知盐酸溶解后的溶液中Cu2+的浓度为1mol/L,若需要溶液中Cu2+浓度等于1.0×10-6 mol/L,则预处理1L该溶液需要1mol/LNaCN溶液的体积为_____________ (假设溶液混合后体积可以相加,计算结果保留两位小数)
②由于氰化钠有剧毒,因此需要对“废液”中的氰化钠进行处理,通常选用漂白粉或漂白液在碱性条件下将其氧化,其中一种产物为空气的主要成分,则在碱性条件下漂白液与氰化钠反应的离子方程式为_____________

Ⅰ. Zr在化合物中通常显
 价,氯化过程中除C、O元素外,其它元素均转化为其高价氯化物;
价,氯化过程中除C、O元素外,其它元素均转化为其高价氯化物;Ⅱ.SiCl4极易水解生成硅酸;ZrCl4易溶于水,400℃升华
Ⅲ.Fe(SCN)3难溶于MIBK,Zr (SCN) 4在水中的溶解度小于在MIBK中的溶解度。
请回答下列问题
(1)滤渣1的主要成分是:
(2)①“氯化”过程中,锆石(ZrSiO4)发生反应的化学方程式为
②ZrCl4产率随温度、压强的变化如图所示,回答问题

“氯化”过程选择的最佳条件为
(3)“滤液1”中含有的阴离子,除OH-外还有
(4)①常用的铜抑制剂为NaCN (氰化钠),NaCN可与重金属阳离子反应,生成溶度积较小的沉淀(如Cu(CN)2,Ksp=4×10-10),已知盐酸溶解后的溶液中Cu2+的浓度为1mol/L,若需要溶液中Cu2+浓度等于1.0×10-6 mol/L,则预处理1L该溶液需要1mol/LNaCN溶液的体积为
②由于氰化钠有剧毒,因此需要对“废液”中的氰化钠进行处理,通常选用漂白粉或漂白液在碱性条件下将其氧化,其中一种产物为空气的主要成分,则在碱性条件下漂白液与氰化钠反应的离子方程式为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐3】(1)有Fe2+、NO-3、Fe3+、NH+4、H+和H2O六种粒子,分别属于同一氧化还原反应中的反应物和生成物。
①请写出该反应的离子方程式(不要求配平)___________________________ 。
②该反应中氧化剂与还原剂的物质的量之比为___________________________ 。
③产生2mol还原产物时转移电子的总数为_______________________________ 。
(2)实验室配制0.5mol/L的NaCl溶液500mL,有以下仪器;
①烧杯②100mL量筒③1000mL容量瓶④500mL容量瓶⑤玻璃棒⑥托盘天平(带砝码)配制时,必须使用的仪器有_______ (填序号),还缺少的仪器是____________ 实验两次用到玻璃棒,其作用分别是____________ 、_______________ 。
(3)有一瓶澄清的溶液,可有含有大量的NO-3、Fe3+、NH+4、H+、K+、Mg2+、Al3+、SO2-4、Ba2+、CO2-3、Cl-、I-,现进行如下实验:
①测知溶液显酸性;
②取样加少量四氯化碳和数滴新制氯水,四氯化碳层溶液呈紫红色;
③另取样滴加稀NaOH溶液,使深液变为碱性,此过程中无沉淀生成;
④取少量上述碱性溶液,加Na2CO3溶液出现白色沉淀;
⑤将实验③中的碱性溶液加热,有气体放出,该气体能使湿润的红色石蕊试纸变蓝。
由此可以推断:
溶液中肯定存在的离子有_____________ 。
溶液中不能确定是否存在的离子有_______________________ 。
①请写出该反应的离子方程式(不要求配平)
②该反应中氧化剂与还原剂的物质的量之比为
③产生2mol还原产物时转移电子的总数为
(2)实验室配制0.5mol/L的NaCl溶液500mL,有以下仪器;
①烧杯②100mL量筒③1000mL容量瓶④500mL容量瓶⑤玻璃棒⑥托盘天平(带砝码)配制时,必须使用的仪器有
(3)有一瓶澄清的溶液,可有含有大量的NO-3、Fe3+、NH+4、H+、K+、Mg2+、Al3+、SO2-4、Ba2+、CO2-3、Cl-、I-,现进行如下实验:
①测知溶液显酸性;
②取样加少量四氯化碳和数滴新制氯水,四氯化碳层溶液呈紫红色;
③另取样滴加稀NaOH溶液,使深液变为碱性,此过程中无沉淀生成;
④取少量上述碱性溶液,加Na2CO3溶液出现白色沉淀;
⑤将实验③中的碱性溶液加热,有气体放出,该气体能使湿润的红色石蕊试纸变蓝。
由此可以推断:
溶液中肯定存在的离子有
溶液中不能确定是否存在的离子有
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
【推荐1】铁及其化合物在生产和生活中有着广泛的应用。制备纳米铁粉,其流程如下:
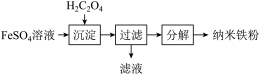
(1)沉淀时通常滴加稍过量的 ,过滤得
,过滤得 。写出沉淀反应的离子方程式为
。写出沉淀反应的离子方程式为___________ 。
(2)过滤所得到的晶体 在
在 时分解:
时分解: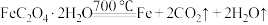 。由于生成
。由于生成 ,该反应成为制备纳米铁粉的重要方法。
,该反应成为制备纳米铁粉的重要方法。 的作用是
的作用是___________ 。
(3)用纳米铁粉处理废水中的 :酸性条件下,纳米铁粉与废水中
:酸性条件下,纳米铁粉与废水中 反应生成
反应生成 与
与 ,其反应的离子方程式是
,其反应的离子方程式是___________ 。

(1)沉淀时通常滴加稍过量的
 ,过滤得
,过滤得 。写出沉淀反应的离子方程式为
。写出沉淀反应的离子方程式为(2)过滤所得到的晶体
 在
在 时分解:
时分解: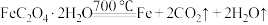 。由于生成
。由于生成 ,该反应成为制备纳米铁粉的重要方法。
,该反应成为制备纳米铁粉的重要方法。 的作用是
的作用是(3)用纳米铁粉处理废水中的
 :酸性条件下,纳米铁粉与废水中
:酸性条件下,纳米铁粉与废水中 反应生成
反应生成 与
与 ,其反应的离子方程式是
,其反应的离子方程式是
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
【推荐2】某研究小组用黄铜矿(主要成分是CuFeS2,其中S为-2价)为主要原料炼铜,其总反应为:2CuFeS2+2SiO2+5O2=2Cu+2FeSiO3+4SO2。事实上该反应是按如下流程分步进行的:

(1)氧化Ⅰ的反应主要是煅烧生成的硫化亚铁被进一步氧化为氧化亚铁,并与二氧化硅反应生成矿渣。矿渣的主要成分是(填化学式)_____________________ 。
(2)据报道,有一种细菌在氧气存在下可以将黄铜矿氧化成硫酸盐,反应是在酸性溶液中发生的。该反应的化学方程式为____________________ 。
(3)我国学者研究发现,以精CuFeS2矿为原料在沸腾炉中与O2(空气)反应,生成物冷却后经溶解、除铁、结晶,得到CuSO4·5H2O,生产成本能够降低许多。有关实验结果如下表:
①CuFeS2与O2反应的化学方程式为______________________ 。
②实际生产过程中沸腾炉温度为600~620 ℃。则控制温度的方法是_______________ 。
③当温度高于600~620 ℃时,生成物中水溶性铜下降的原因是____________ 。
④生成物冷却后的除铁的实验操作方法主要是_________ 。已知在溶液中,Cu2+开始沉淀和沉淀完全的pH分别为4.7、6.7,Fe3+开始沉淀和沉淀完全的pH分别为1.1、3.2;如果制得的硫酸铜溶液中含有少量的Fe3+,请写出除去溶液中Fe3+的实验操作步骤:_______________ 。

(1)氧化Ⅰ的反应主要是煅烧生成的硫化亚铁被进一步氧化为氧化亚铁,并与二氧化硅反应生成矿渣。矿渣的主要成分是(填化学式)
(2)据报道,有一种细菌在氧气存在下可以将黄铜矿氧化成硫酸盐,反应是在酸性溶液中发生的。该反应的化学方程式为
(3)我国学者研究发现,以精CuFeS2矿为原料在沸腾炉中与O2(空气)反应,生成物冷却后经溶解、除铁、结晶,得到CuSO4·5H2O,生产成本能够降低许多。有关实验结果如下表:
| 沸腾炉温度/℃ | 560 | 580 | 600 | 620 | 640 | 660 |
| 水溶性Cu/% | 90.1 | 91.24 | 93.50 | 92.38 | 89.96 | 84.23 |
| 酸溶性Cu/% | 92.00 | 93.60 | 97.08 | 97.82 | 98.16 | 98.19 |
①CuFeS2与O2反应的化学方程式为
②实际生产过程中沸腾炉温度为600~620 ℃。则控制温度的方法是
③当温度高于600~620 ℃时,生成物中水溶性铜下降的原因是
④生成物冷却后的除铁的实验操作方法主要是
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐3】某废料铁泥主要成分为Fe2O3、FeO和Fe,其他杂质不与硫酸反应。现取wg废料铁泥提取Fe2O3,设计实验流程如图:

(1)写出步骤(I)中铁单质参与的有关反应的离子方程式_______ 、_______ ,分离溶液A和沉淀C的操作名称是_______ 。
(2)检验溶液A中含有Fe2+应选用的试剂是_______
A.铁粉 B.FeCl3溶液 C.酸性KMnO4溶液 D.KSCN溶液
(3)步骤(Ⅱ)中加入H2O2溶液,H2O2在反应中作_______ (填“氧化剂”或“还原剂”),反应的离子反应方程式为_______ 。
(4)步骤(Ⅳ)中生成的Fe2O3固体的颜色是_______ 。
(5)若最终获得 ngFe2O3,则铁泥中铁元素的质量分数为_______ 。

(1)写出步骤(I)中铁单质参与的有关反应的离子方程式
(2)检验溶液A中含有Fe2+应选用的试剂是
A.铁粉 B.FeCl3溶液 C.酸性KMnO4溶液 D.KSCN溶液
(3)步骤(Ⅱ)中加入H2O2溶液,H2O2在反应中作
(4)步骤(Ⅳ)中生成的Fe2O3固体的颜色是
(5)若最终获得 ngFe2O3,则铁泥中铁元素的质量分数为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐1】氯酸镁[Mg(ClO3)2]常用作催熟剂、除草剂等,工业大规模生产前,实验室先按如下流程进行模拟制备少量Mg(ClO3)2·6H2O:
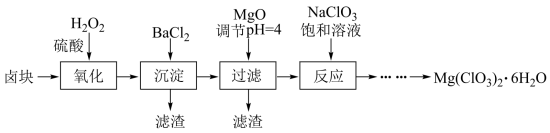
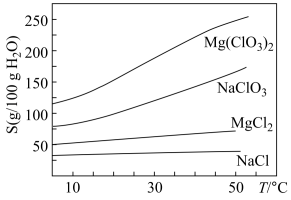
已知:①卤块主要成分为MgCl2·6H2O,含有MgSO4、FeCl2等杂质。②几种化合物的溶解度(S)随温度(T)变化曲线如右图。
(1)卤块中加H2O2的目的是________________ ,写出该反应的离子方程式__________________ 。
(2)加入BaCl2的目的是除去SO ,如何检验SO
,如何检验SO 已沉淀完全?
已沉淀完全?_________________ 。
(3)常温下,加MgO调节pH=4后溶液中c(Fe3+)=___________ (已知Ksp[Fe(OH)3=4×10-38],过滤所得滤渣的主要成分有______________ 。
(4)加入NaClO3饱和溶液公有NaCl晶体析出,写出该反应的化学方程式:___________ ,请利用该反应,结合上图,制取Mg(ClO3)2·6H2O的实验步骤依次为:
①取样,加入NaClO3饱和溶液充分反应;②蒸发结晶;③___________ ;④冷却结晶;⑤过滤、洗涤,获得Mg(ClO3)2·6H2O晶体。

已知:①卤块主要成分为MgCl2·6H2O,含有MgSO4、FeCl2等杂质。②几种化合物的溶解度(S)随温度(T)变化曲线如右图。

(1)卤块中加H2O2的目的是
(2)加入BaCl2的目的是除去SO
 ,如何检验SO
,如何检验SO 已沉淀完全?
已沉淀完全?(3)常温下,加MgO调节pH=4后溶液中c(Fe3+)=
(4)加入NaClO3饱和溶液公有NaCl晶体析出,写出该反应的化学方程式:
①取样,加入NaClO3饱和溶液充分反应;②蒸发结晶;③
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
【推荐2】以粉煤灰(主要含Al2O3、SiO2,还有少量的Fe2O3)为原料制取Al2O3的流程如下:

(1)操作Ⅰ的名称是__ 。
(2)用H2SO4“酸浸”时的离子方程式为__ (任写一个)。
(3)简述如何检验酸浸后溶液中是否有Fe3+__ 。
(4)“煅烧”时的化学方程式为__ 。
(5)沉淀A与氢氟酸反应的化学方程式为__ 。

(1)操作Ⅰ的名称是
(2)用H2SO4“酸浸”时的离子方程式为
(3)简述如何检验酸浸后溶液中是否有Fe3+
(4)“煅烧”时的化学方程式为
(5)沉淀A与氢氟酸反应的化学方程式为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
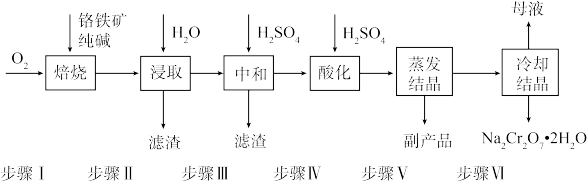
【推荐3】工业上以铬铁矿(FeCr2O4,含Al、Si氧化物等杂质)为主要原料制备红矾钠(Na2Cr2O7•2H2O)的工艺流程如图。回答下列问题:
已知:4Fe (CrO2)2 + 10Na2CO3+7O2=8Na2CrO4 +4NaFeO2+10CO2
2H++2CrO
 Cr2O
Cr2O +H2O
+H2O
请回答:
(1)步骤I,将铬铁矿粉碎有利于加快高温氧化的速率,其理由是___________ 。
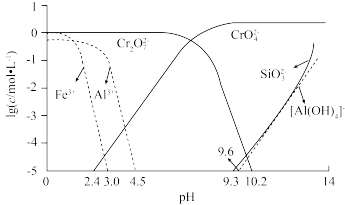
(2)矿物中相关元素可溶性组分物质的量浓度c与pH的关系如图所示。当溶液中可溶组分浓度c≤1.0×10-5mol•L-1时,可认为已除尽。步骤III中和时pH的理论范围为___________ 。
(3)下列说法正确的是___________。
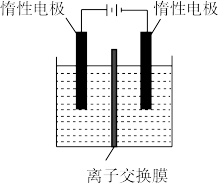
(4)利用膜电解技术(装置如图所示),以步骤III所得滤液为主要原料也可以制备Na2Cr2O7。电解时两边容器内都加入步骤III滤液,通过离子交换膜的离子只有CrO ,则Na2Cr2O7在
,则Na2Cr2O7在___________ (填“阴”或“阳”)极室制得,写出该电解过程中的总反应的化学方程式___________ 。

已知:4Fe (CrO2)2 + 10Na2CO3+7O2=8Na2CrO4 +4NaFeO2+10CO2
2H++2CrO

 Cr2O
Cr2O +H2O
+H2O请回答:
(1)步骤I,将铬铁矿粉碎有利于加快高温氧化的速率,其理由是
(2)矿物中相关元素可溶性组分物质的量浓度c与pH的关系如图所示。当溶液中可溶组分浓度c≤1.0×10-5mol•L-1时,可认为已除尽。步骤III中和时pH的理论范围为

(3)下列说法正确的是___________。
| A.步骤II,低温可提高浸取率 |
| B.步骤II,滤渣的主要成分是NaFeO2水解产生的Fe(OH)3 |
| C.步骤IV,酸化的目的主要是使Na2CrO4转变为Na2Cr2O7 |
| D.步骤V,蒸发结晶所得副产品的主要成分是Na2SO4和Na2CO3 |
 ,则Na2Cr2O7在
,则Na2Cr2O7在
您最近一年使用:0次



