燃煤烟气中含有大量 和NO是大气主要污染物,需要经过净化处理后才能排放。
和NO是大气主要污染物,需要经过净化处理后才能排放。
(1)尿素 可用于
可用于 和NO的吸收。
和NO的吸收。
①已知: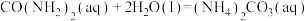
 ,
,

 ,
,
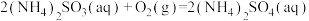
 ,反应
,反应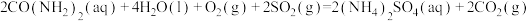 的
的
___________  。
。
②尿素 可将NO转化为
可将NO转化为 和
和 而除去,该反应的化学方程式为
而除去,该反应的化学方程式为___________ 。
(2)利用电化学联合处理法可实现 和NO同时除去,工作原理如图所示。
和NO同时除去,工作原理如图所示。
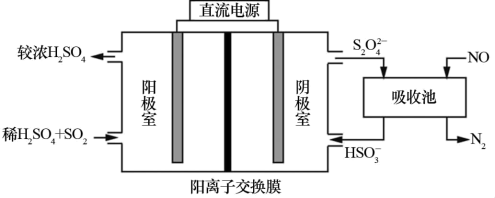
①阳极的电极反应式为___________ 。
②若工作前后阴极室成分不变,被处理的 和NO在相同条件下的体积比
和NO在相同条件下的体积比
___________ 。
 和NO是大气主要污染物,需要经过净化处理后才能排放。
和NO是大气主要污染物,需要经过净化处理后才能排放。(1)尿素
 可用于
可用于 和NO的吸收。
和NO的吸收。①已知:
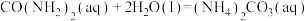
 ,
,
 ,
,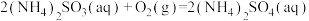
 ,反应
,反应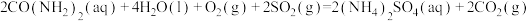 的
的
 。
。②尿素
 可将NO转化为
可将NO转化为 和
和 而除去,该反应的化学方程式为
而除去,该反应的化学方程式为(2)利用电化学联合处理法可实现
 和NO同时除去,工作原理如图所示。
和NO同时除去,工作原理如图所示。
①阳极的电极反应式为
②若工作前后阴极室成分不变,被处理的
 和NO在相同条件下的体积比
和NO在相同条件下的体积比
更新时间:2023-03-14 10:58:18
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
【推荐1】二甲醚(CH3OCH3)重整制取H2,具有无毒、无刺激性等优点。回答下列问题:
(1) CH3OCH3和O2发生反应I:CH3OCH3(g)+1/2O2(g)=2CO(g)+3H2(g) △H
已知:CH3OCH3(g) CO(g)+H2(g)+CH4 (g) △H1
CO(g)+H2(g)+CH4 (g) △H1
CH4 (g)+3/2O2(g)=CO(g)+2H2O (g) △H2
H2(g)+1/2O2(g)=H2O (g) △H3
①则反应I的△H=____ (用含△H1、△H2、△H3的代数式表示)。
②保持温度和压强不变,分别按不同进料比通入CH3OCH3和O2,发生反应I。测得平衡时H2的体积百分含量与进料气中n(O2)/n(CH3OCH3)的关系如图所示。当n(O2)/n(CH3OCH3)>0.6时,H2的体积百分含量快速降低,其主要原因是____ (填标号)。

A.过量的O2起稀释作用
B.过量的O2与H2发生副反应生成H2O
C .n(O2)/n(CH3OCH3)>0.6平衡向逆反应方向移动
(2)T℃时,在恒容密闭容器中通入CH3OCH3,发生反应II:CH3OCH3(g) CO(g)+H2(g)+CH4(g),测得容器内初始压强为41.6 kPa,反应过程中反应速率v(CH3OCH3)时间t与CH3OCH3分压P(CH3OCH3)的关系如图所示。
CO(g)+H2(g)+CH4(g),测得容器内初始压强为41.6 kPa,反应过程中反应速率v(CH3OCH3)时间t与CH3OCH3分压P(CH3OCH3)的关系如图所示。
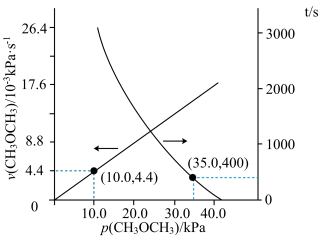
①t=400 s时,CH3OCH3的转化率为____ (保留2位有效数字);反应速率满足v(CH3OCH3)=kPn(CH3OCH3),k=_____ s-1;400 s时v(CH3OCH3)=_____ kPa.s-1。
②达到平衡时,测得体系的总压强P总= 121.6 kPa,则该反应的平衡常数Kp=________________ kPa2(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
③该温度下,要缩短达到平衡所需的时间,除改进催化剂外,还可采取的措施是____ ,其理由是____ 。
(1) CH3OCH3和O2发生反应I:CH3OCH3(g)+1/2O2(g)=2CO(g)+3H2(g) △H
已知:CH3OCH3(g)
 CO(g)+H2(g)+CH4 (g) △H1
CO(g)+H2(g)+CH4 (g) △H1CH4 (g)+3/2O2(g)=CO(g)+2H2O (g) △H2
H2(g)+1/2O2(g)=H2O (g) △H3
①则反应I的△H=
②保持温度和压强不变,分别按不同进料比通入CH3OCH3和O2,发生反应I。测得平衡时H2的体积百分含量与进料气中n(O2)/n(CH3OCH3)的关系如图所示。当n(O2)/n(CH3OCH3)>0.6时,H2的体积百分含量快速降低,其主要原因是

A.过量的O2起稀释作用
B.过量的O2与H2发生副反应生成H2O
C .n(O2)/n(CH3OCH3)>0.6平衡向逆反应方向移动
(2)T℃时,在恒容密闭容器中通入CH3OCH3,发生反应II:CH3OCH3(g)
 CO(g)+H2(g)+CH4(g),测得容器内初始压强为41.6 kPa,反应过程中反应速率v(CH3OCH3)时间t与CH3OCH3分压P(CH3OCH3)的关系如图所示。
CO(g)+H2(g)+CH4(g),测得容器内初始压强为41.6 kPa,反应过程中反应速率v(CH3OCH3)时间t与CH3OCH3分压P(CH3OCH3)的关系如图所示。
①t=400 s时,CH3OCH3的转化率为
②达到平衡时,测得体系的总压强P总= 121.6 kPa,则该反应的平衡常数Kp=
③该温度下,要缩短达到平衡所需的时间,除改进催化剂外,还可采取的措施是
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐2】SO2、NO、NO2、CO都是污染大气的有害气体,对其进行回收利用是节能减排的重要课题。
(1)上述四种气体中直接排入空气时会引起酸雨的有___________ (填化学式);
(2)回收大气污染物SO2的方法如下:
方法一:在复合组分催化剂作用下,CH4可使SO2转化为S,同时生成CO2和液态H2O。
已知:CH4(g)+2SO2(g)=CO2(g)+2S(s)+2H2O(l) ΔH=-295.9kJ·mol-1
S(s)+O2(g)=SO2(g) ΔH=-297.2kJ·mol-1
则CH4的燃烧热的热化学方程式为:___________ 。
方法二:在恒容密闭容器中,用H2还原SO2生成S的反应分两步完成(如图1所示),该过程中部分物质的物质的量浓度随时间的变化关系如图2所示:

①由分析可知X为___________ (填化学式)。
②0~t1时间段的温度为___________ 。
方法三:利用反应:NO2(g)+SO2(g) SO3(g)+NO(g)
SO3(g)+NO(g)
③一定条件下,将NO2与SO2以体积比1:1置于恒温恒容的密闭容器中发生反应:NO2(g)+SO2(g) SO3(g)+NO(g),下列能说明反应达到平衡状态的是
SO3(g)+NO(g),下列能说明反应达到平衡状态的是___________ (填字母)。
a.混合气体的密度保持不变 b.SO2的物质的量保持不变
c.容器内混合气体原子总数不变 d.每生成1molSO3的同时消耗1molNO
e.容器内的混合气体平均相对分子质量保持不变
④已知该反应的平衡常数为 ,向某恒温恒容密闭容器中通入NO2、SO2、SO3、NO各1mol,此时v(正)
,向某恒温恒容密闭容器中通入NO2、SO2、SO3、NO各1mol,此时v(正)___________ v(逆)(填“>”、“<”或“=”)
(3)CO可用于合成甲醇,其反应的化学方程式为CO(g)+2H2(g) CH3OH(g)。在一容积可变的密闭容器中充有10molCO与20molH2,在催化剂作用下发生反应生成甲醇。CO的平衡转化率(ɑ)与温度(T)、压强(p)的关系如图所示。下列说法正确的是
CH3OH(g)。在一容积可变的密闭容器中充有10molCO与20molH2,在催化剂作用下发生反应生成甲醇。CO的平衡转化率(ɑ)与温度(T)、压强(p)的关系如图所示。下列说法正确的是___________ (填字母)。
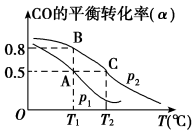
a.合成甲醇的反应为吸热反应
b.压强为p1>p2
c.A、B、C三点的平衡常数为KA=KB>KC
d.若达平衡状态A时,容器的体积为10L,则在平衡状态B时容器的体积也为10L
(1)上述四种气体中直接排入空气时会引起酸雨的有
(2)回收大气污染物SO2的方法如下:
方法一:在复合组分催化剂作用下,CH4可使SO2转化为S,同时生成CO2和液态H2O。
已知:CH4(g)+2SO2(g)=CO2(g)+2S(s)+2H2O(l) ΔH=-295.9kJ·mol-1
S(s)+O2(g)=SO2(g) ΔH=-297.2kJ·mol-1
则CH4的燃烧热的热化学方程式为:
方法二:在恒容密闭容器中,用H2还原SO2生成S的反应分两步完成(如图1所示),该过程中部分物质的物质的量浓度随时间的变化关系如图2所示:

①由分析可知X为
②0~t1时间段的温度为
方法三:利用反应:NO2(g)+SO2(g)
 SO3(g)+NO(g)
SO3(g)+NO(g)③一定条件下,将NO2与SO2以体积比1:1置于恒温恒容的密闭容器中发生反应:NO2(g)+SO2(g)
 SO3(g)+NO(g),下列能说明反应达到平衡状态的是
SO3(g)+NO(g),下列能说明反应达到平衡状态的是a.混合气体的密度保持不变 b.SO2的物质的量保持不变
c.容器内混合气体原子总数不变 d.每生成1molSO3的同时消耗1molNO
e.容器内的混合气体平均相对分子质量保持不变
④已知该反应的平衡常数为
 ,向某恒温恒容密闭容器中通入NO2、SO2、SO3、NO各1mol,此时v(正)
,向某恒温恒容密闭容器中通入NO2、SO2、SO3、NO各1mol,此时v(正)(3)CO可用于合成甲醇,其反应的化学方程式为CO(g)+2H2(g)
 CH3OH(g)。在一容积可变的密闭容器中充有10molCO与20molH2,在催化剂作用下发生反应生成甲醇。CO的平衡转化率(ɑ)与温度(T)、压强(p)的关系如图所示。下列说法正确的是
CH3OH(g)。在一容积可变的密闭容器中充有10molCO与20molH2,在催化剂作用下发生反应生成甲醇。CO的平衡转化率(ɑ)与温度(T)、压强(p)的关系如图所示。下列说法正确的是
a.合成甲醇的反应为吸热反应
b.压强为p1>p2
c.A、B、C三点的平衡常数为KA=KB>KC
d.若达平衡状态A时,容器的体积为10L,则在平衡状态B时容器的体积也为10L
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐3】化学反应与能量以及化学平衡原理是中学化学学习的重要内容。请回答下列问题:
⑴已知:CH4、H2的燃烧热(△H)分别为-890.3 kJ/mol、-285.8kJ/mol,则CO2和H2反应生成CH4和H2O(l)的热化学方程式是_________________________________ 。
⑵设想以N2和H2为反应物,以溶有A的稀盐酸为电解质溶液,可制造出既能提供电能,又能固氮的新型燃料电池,装置如图所示。电池正极的电极反应式是_____________ ,A是______________ 。
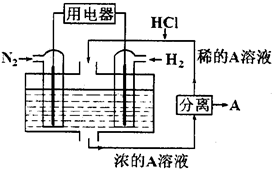
⑶25 ℃时,向含amol NH4Cl的水溶液滴加bL氨水后溶液呈中性,则所滴加氨水的浓度为________ mol·L-1。(NH3·H2O的电离平衡常数取Kb=2×10-5)
⑷甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上可用合成气制备甲醇,反应方程式为CO(g)+2H2(g) CH3OH(g)
CH3OH(g)
如图是该反应在不同温度下CO的转化率随时间变化的曲线。

①该反应的焓变△H_______ 0 (填“>”、“<”或“=”)。
②T1和T2温度下的平衡常数大小关系是K1_______ K2(填“>”、“<”或“=”)。
③若容器容积不变,下列措施可增加甲醇产率的是_________ 。
A.升高温度
B.将CH3OH(g)从体系中分离
C.使用合适的催化剂
D.充入He,使体系总压强增大
⑴已知:CH4、H2的燃烧热(△H)分别为-890.3 kJ/mol、-285.8kJ/mol,则CO2和H2反应生成CH4和H2O(l)的热化学方程式是
⑵设想以N2和H2为反应物,以溶有A的稀盐酸为电解质溶液,可制造出既能提供电能,又能固氮的新型燃料电池,装置如图所示。电池正极的电极反应式是

⑶25 ℃时,向含amol NH4Cl的水溶液滴加bL氨水后溶液呈中性,则所滴加氨水的浓度为
⑷甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上可用合成气制备甲醇,反应方程式为CO(g)+2H2(g)
 CH3OH(g)
CH3OH(g)如图是该反应在不同温度下CO的转化率随时间变化的曲线。

①该反应的焓变△H
②T1和T2温度下的平衡常数大小关系是K1
③若容器容积不变,下列措施可增加甲醇产率的是
A.升高温度
B.将CH3OH(g)从体系中分离
C.使用合适的催化剂
D.充入He,使体系总压强增大
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
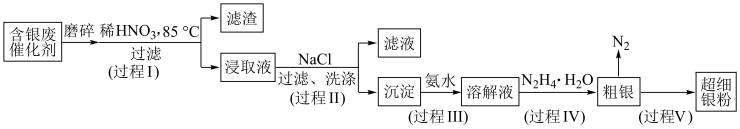
【推荐1】超细银粉在光学、生物医疗等领域有着广阔的应用前景。由含银废催化剂制备超细银粉的过程如图:
资料:i.含银废催化剂成分:主要含Ag、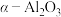 及少量MgO、
及少量MgO、 、
、 、
、 等
等
ii.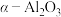 为载体,且不溶于硝酸
为载体,且不溶于硝酸
(1)预处理
过程Ⅰ中,为提高银的浸取速率采取的措施有________ ,银与稀硝酸反应的离子方程式是_______ 。
(2)分离除杂
①过程Ⅱ中,检验沉淀表面的 已洗涤干净的操作是
已洗涤干净的操作是______ 。
②过程Ⅳ中, 被氧化为
被氧化为 ,同时获得粗银,该反应的化学方程式是
,同时获得粗银,该反应的化学方程式是________ 。
(3)回收率测定
采用如下方法测定粗银中银的回收率:取mg粗银样品用硝酸溶解,以铁铵矾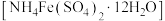 为指示剂,用cmol/L的KSCN标准溶液滴定,消耗标准溶液VmL。
为指示剂,用cmol/L的KSCN标准溶液滴定,消耗标准溶液VmL。
已知:
i.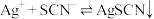 (白色)
(白色) 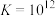 ;
;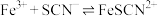 (红色)
(红色) 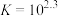
ii. 开始沉淀的pH为1.5,完全沉淀的pH为2.8
开始沉淀的pH为1.5,完全沉淀的pH为2.8
iii.AgSCN可溶于浓硝酸
①判断已达滴定终点时的现象是________ 。
②为保证获取数据准确性,滴定时溶液 一般控制在0.1~1mol/L之间,氢离子浓度太小对实验的影响是
一般控制在0.1~1mol/L之间,氢离子浓度太小对实验的影响是______ 。
③该工艺获得粗品中银的回收率是______ (用字母表示)。
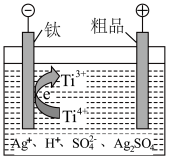
(4)精炼
精炼装置如图所示,电解液为稀 ,下列说法正确的是______(填选项)。
,下列说法正确的是______(填选项)。

资料:i.含银废催化剂成分:主要含Ag、
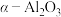 及少量MgO、
及少量MgO、 、
、 、
、 等
等ii.
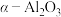 为载体,且不溶于硝酸
为载体,且不溶于硝酸(1)预处理
过程Ⅰ中,为提高银的浸取速率采取的措施有
(2)分离除杂
①过程Ⅱ中,检验沉淀表面的
 已洗涤干净的操作是
已洗涤干净的操作是②过程Ⅳ中,
 被氧化为
被氧化为 ,同时获得粗银,该反应的化学方程式是
,同时获得粗银,该反应的化学方程式是(3)回收率测定
采用如下方法测定粗银中银的回收率:取mg粗银样品用硝酸溶解,以铁铵矾
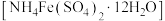 为指示剂,用cmol/L的KSCN标准溶液滴定,消耗标准溶液VmL。
为指示剂,用cmol/L的KSCN标准溶液滴定,消耗标准溶液VmL。已知:
i.
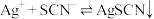 (白色)
(白色) 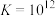 ;
;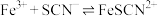 (红色)
(红色) 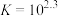
ii.
 开始沉淀的pH为1.5,完全沉淀的pH为2.8
开始沉淀的pH为1.5,完全沉淀的pH为2.8iii.AgSCN可溶于浓硝酸
①判断已达滴定终点时的现象是
②为保证获取数据准确性,滴定时溶液
 一般控制在0.1~1mol/L之间,氢离子浓度太小对实验的影响是
一般控制在0.1~1mol/L之间,氢离子浓度太小对实验的影响是③该工艺获得粗品中银的回收率是
(4)精炼
精炼装置如图所示,电解液为稀
 ,下列说法正确的是______(填选项)。
,下列说法正确的是______(填选项)。
A.体系中存在沉淀溶解平衡: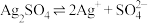 |
B.阳极的电极反应式为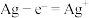 |
| C.钛电极电势高 |
D.阴极区可获得超细银粉的原理: |
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐2】按要求回答问题
(1)工业上利用甲酸的能量关系转换图如下:
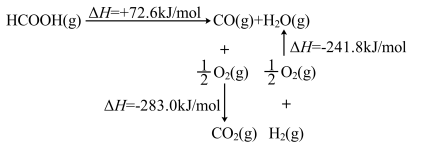
则反应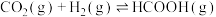 的焓变
的焓变
_______  。
。
(2)乙烷燃料电池,当电解质溶液为KOH时,写出负极的电极反应式_______ 。
(3)Cu做电极,电解 溶液,阳极反应式
溶液,阳极反应式_______ ;阴极反应式_______ 。
(4)铅蓄电池总反应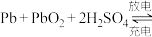
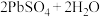 ,写出充电时阴极的电极反应式
,写出充电时阴极的电极反应式_______ 。
(5)一种心脏起搏器电解质为等物质的量的LiCl、 溶解在
溶解在 中形成的溶液,这种电池的总反应为
中形成的溶液,这种电池的总反应为 ,则该电池的正极反应为
,则该电池的正极反应为_______ 。
(1)工业上利用甲酸的能量关系转换图如下:

则反应
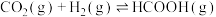 的焓变
的焓变
 。
。(2)乙烷燃料电池,当电解质溶液为KOH时,写出负极的电极反应式
(3)Cu做电极,电解
 溶液,阳极反应式
溶液,阳极反应式(4)铅蓄电池总反应
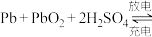
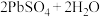 ,写出充电时阴极的电极反应式
,写出充电时阴极的电极反应式(5)一种心脏起搏器电解质为等物质的量的LiCl、
 溶解在
溶解在 中形成的溶液,这种电池的总反应为
中形成的溶液,这种电池的总反应为 ,则该电池的正极反应为
,则该电池的正极反应为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐3】工业锅炉内壁的水垢,不仅浪费燃料,而且容易引发安全隐患。某碳素钢锅炉水垢(主要成分有CaCO3、CaSO4、Mg(OH)2、Fe2O3、SiO2等)碱煮法清除的流程如图甲。
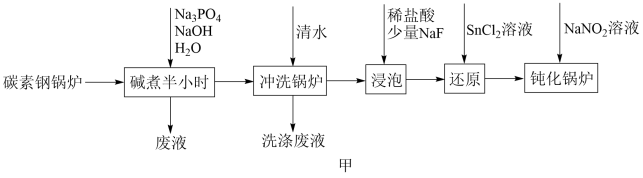
已知:20℃时几种难溶物的溶度积常数如表所示(单位省略)。
回答下列问题:
(1)“碱煮”环节,加入Na3PO4的主要目的是将CaSO4转化为Ca3(PO4)2,请写出该反应的离子方程式____ 。上述反应的平衡常数K=____ (保留2位有效数字)。
(2)“浸泡”过程中,在加入足量稀盐酸时,还要加入NaF的目的是____ 。
(3)“钝化”处理是在锅炉表面形成Fe3O4保护膜,同时生成可直接参与大气循环的气体。
①反应的离子方程式为____ ;
②为检验锅炉“钝化”处理后是否形成致密的保护膜,可往锅炉内壁刷上硫酸铜溶液,若观察到____ (填现象),则保护膜致密性欠佳。
(4)(NaPO3)x俗名格氏盐,没有固定的熔点,易溶于水,水溶液的黏度大。它能够与Ca2+、Mg2+等离子形成络合物,故常用作软水剂和锅炉、管道的去垢剂。但是Na3PO4和(NaPO3)x长期和大量使用会导致一种生态灾难:___ (填名称)。
(5)柠檬酸(用H3R表示)可用作一种环保型锅炉水垢的酸洗剂,溶液中H3R、H2R-、HR2-、R3-的含量与pH的关系如图乙所示。由此可知,0.1mol·L-1Na2HR溶液中H3R、H2R-、HR2-、R3-的浓度由大到小的排列顺序为___ 。
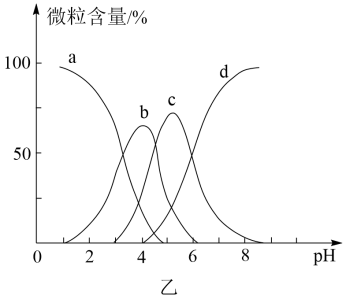
(6)用如图丙装置对锅炉用水(含Ca2+、Mg2+、HCO )进行预处理,可有效防止水垢形成。电解时,Ca2+形成沉淀的电极反应式为
)进行预处理,可有效防止水垢形成。电解时,Ca2+形成沉淀的电极反应式为___ 。


已知:20℃时几种难溶物的溶度积常数如表所示(单位省略)。
| 难溶物 | CaCO3 | CaSO4 | Mg(OH)2 | MgCO3 | Ca3(PO4)2 |
| Ksp | 2.8×10-9 | 7.0×10-5 | 5.6×10-12 | 6.8×10-6 | 2.0×10-33 |
(1)“碱煮”环节,加入Na3PO4的主要目的是将CaSO4转化为Ca3(PO4)2,请写出该反应的离子方程式
(2)“浸泡”过程中,在加入足量稀盐酸时,还要加入NaF的目的是
(3)“钝化”处理是在锅炉表面形成Fe3O4保护膜,同时生成可直接参与大气循环的气体。
①反应的离子方程式为
②为检验锅炉“钝化”处理后是否形成致密的保护膜,可往锅炉内壁刷上硫酸铜溶液,若观察到
(4)(NaPO3)x俗名格氏盐,没有固定的熔点,易溶于水,水溶液的黏度大。它能够与Ca2+、Mg2+等离子形成络合物,故常用作软水剂和锅炉、管道的去垢剂。但是Na3PO4和(NaPO3)x长期和大量使用会导致一种生态灾难:
(5)柠檬酸(用H3R表示)可用作一种环保型锅炉水垢的酸洗剂,溶液中H3R、H2R-、HR2-、R3-的含量与pH的关系如图乙所示。由此可知,0.1mol·L-1Na2HR溶液中H3R、H2R-、HR2-、R3-的浓度由大到小的排列顺序为

(6)用如图丙装置对锅炉用水(含Ca2+、Mg2+、HCO
 )进行预处理,可有效防止水垢形成。电解时,Ca2+形成沉淀的电极反应式为
)进行预处理,可有效防止水垢形成。电解时,Ca2+形成沉淀的电极反应式为
您最近一年使用:0次



