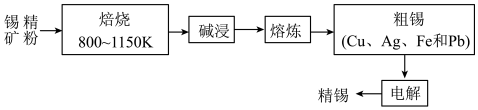
锡常用于制造保险丝等合金。工业上以锡精矿(主要含锡、铁、铜、银、铅、钨等硫化物和砷化物)为原料制备锡,其流程如下:
(1)“焙烧”中将WS2转化成WO3,用10%纯碱溶液“碱浸”将WO3转化成易溶性的Na2WO4并放出气体,写出离子方程式:___________ 。
(2)“熔炼”时使用焦炭粉,如果炭还原SnO2时生成锡和CO、CO2(体积比3:1),写出化学方程式:___________

(1)“焙烧”中将WS2转化成WO3,用10%纯碱溶液“碱浸”将WO3转化成易溶性的Na2WO4并放出气体,写出离子方程式:
(2)“熔炼”时使用焦炭粉,如果炭还原SnO2时生成锡和CO、CO2(体积比3:1),写出化学方程式:
2023高三·全国·专题练习 查看更多[1]
(已下线)05 常考题空5 工艺流程中化学(离子)方程式的书写 (解析)-备战2023年高考化学大题逐空突破系列(全国通用)
更新时间:2023-04-13 15:25:29
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
【推荐1】硫酸铅(PbSO4),制造铅蓄电池的一种原料;以废旧铅酸电池中的含铅废料(Pb、PbO、PbO2、PbSO4及炭黑等)和H2SO4为原料,制备高纯PbO,可实现铅的再生利用。
(1)铅蓄电池中需要配制5.3 mol∙L−1的H2SO4溶液,需要的仪器有玻璃棒、___________ (从下列图中选择,写出名称)。

(2)工业上以PbS为原料可以制取PbSO4,80℃时浸取,将PbS与盐酸、MnO2和饱和食盐水一起浸取,PbS反应后生成 和S。
和S。
①写出PbS反应的离子方程式:___________ 。
②浸取时应控制盐酸的浓度。其他条件一定,若盐酸浓度过大,铅元素的浸出率反而下降,原因是___________ 。
(3)用废旧铅酸电池中的含铅废料,制备高纯PbO,实现铅的再生利用的过程中,

过程Ⅰ中,Fe2+催化过程可表示为:
i:2Fe2++PbO2+4H++ =2Fe3++PbSO4+2H2O
=2Fe3++PbSO4+2H2O
ii:2Fe3++Pb+ =2Fe2++PbSO4
=2Fe2++PbSO4
下列实验方案可证实上述催化过程。请将实验方案补充完整。
a.向酸化的FeSO4溶液中加入KSCN溶液,溶液几乎无色,再加入少量PbO2,溶液变红。
b.___________ 。
(4)已知:Ksp(PbCO3)=1.5×10−13,Ksp(PbSO4)=1.8×10−8.在某制备过程中,经检测,过滤出的PbCO3沉淀中混有PbSO4,则该滤液中 =
=___________ 。
(5)以铅蓄电池为电源,电解二氧化碳酸性溶液可制得丙烯(如图)。

①Y极与电源___________ (填“正极”或“负极”)相连。
②该离子交换膜为___________ 膜。
③X极的电极反应式为___________ 。
(1)铅蓄电池中需要配制5.3 mol∙L−1的H2SO4溶液,需要的仪器有玻璃棒、

(2)工业上以PbS为原料可以制取PbSO4,80℃时浸取,将PbS与盐酸、MnO2和饱和食盐水一起浸取,PbS反应后生成
 和S。
和S。①写出PbS反应的离子方程式:
②浸取时应控制盐酸的浓度。其他条件一定,若盐酸浓度过大,铅元素的浸出率反而下降,原因是
(3)用废旧铅酸电池中的含铅废料,制备高纯PbO,实现铅的再生利用的过程中,

过程Ⅰ中,Fe2+催化过程可表示为:
i:2Fe2++PbO2+4H++
 =2Fe3++PbSO4+2H2O
=2Fe3++PbSO4+2H2Oii:2Fe3++Pb+
 =2Fe2++PbSO4
=2Fe2++PbSO4下列实验方案可证实上述催化过程。请将实验方案补充完整。
a.向酸化的FeSO4溶液中加入KSCN溶液,溶液几乎无色,再加入少量PbO2,溶液变红。
b.
(4)已知:Ksp(PbCO3)=1.5×10−13,Ksp(PbSO4)=1.8×10−8.在某制备过程中,经检测,过滤出的PbCO3沉淀中混有PbSO4,则该滤液中
 =
=(5)以铅蓄电池为电源,电解二氧化碳酸性溶液可制得丙烯(如图)。

①Y极与电源
②该离子交换膜为
③X极的电极反应式为
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
解题方法
【推荐2】现有失去标签的氯化钙、硝酸银、盐酸、碳酸钠四种无色溶液,为了确定四种溶液各是什么,将它们随意编上A、B、C、D后, 产生的现象如下表所示。根据实验现象按要求回答:
(1)A、B、C、D溶液中溶质的化学式:A_____________ ;B_____________ ;C_____________ ;D_____________ 。
(2)写出上述实验中有关反应的离子方程式:③_________ ;④ __________ 。
| 实验顺序 | 实验内容 | 实验现象 |
| ① | A+B | 没有现象发生 |
| ② | B+D | 有气体放出 |
| ③ | B+C | 有沉淀生成 |
| ④ | A+D | 有沉淀生成 |
(2)写出上述实验中有关反应的离子方程式:③
您最近一年使用:0次
【推荐3】四钼酸铵晶体[(NH4)2Mo4O13∙2H2O]微溶于水和铵盐溶液,在过量浓氨水中转化为(NH4)2MoO4溶液,是钼深加工的重要中间品,具有广泛的用途。一种以辉钼矿(主要成分是MoS2,还含有NiS、PbS、SiO2和Fe的氧化物等杂质)为原料生产四钼酸铵晶体[(NH4)2Mo4O13∙2H2O]的工艺流程如下:
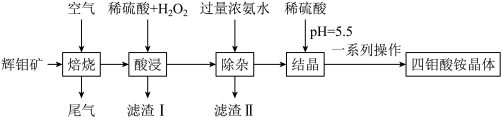
已知:Ni3+可以将H2O氧化,故不能存在于水溶液中。
回答下列问题:
(1)“焙烧”时通入过量空气的目的是_______ ,“焙烧”时将MoS2转化为MoO3,反应的化学方程式为:_______ 。
(2)“酸浸”时,MoO3转化为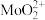 ,H2O2的作用是
,H2O2的作用是_______ ,滤渣I的成分是_______ (填化学式)。
(3)“除杂”时,主要反应的离子方程式为_______ ;加入“过量浓氨水”使溶液pH≥_______ 时剩余杂质元素完全沉淀。(已知:当溶液中某离子浓度≤10-5 mol/L时,认为其沉淀完全。常温下,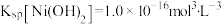 ,
,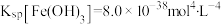 )
)
(4)“结晶”时滴加稀硫酸调节溶液的pH为5.5的目的是_______ 。

已知:Ni3+可以将H2O氧化,故不能存在于水溶液中。
回答下列问题:
(1)“焙烧”时通入过量空气的目的是
(2)“酸浸”时,MoO3转化为
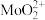 ,H2O2的作用是
,H2O2的作用是(3)“除杂”时,主要反应的离子方程式为
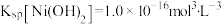 ,
,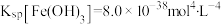 )
)(4)“结晶”时滴加稀硫酸调节溶液的pH为5.5的目的是
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐1】利用转炉烟尘(主要成分:CuO、ZnO、PbO、Sb4O6、As2O5)制备硫酸铜联产硫酸锌以及聚合硫酸铁的工艺流程如图:

已知:①酸浸后As元素以H3AsO4形式存在;
②常温下,Ksp[Cu(OH)2]≈1.0×10-20;
③聚合硫酸铁盐基度[聚合硫酸铁中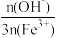 ×100%]越大,絮凝效果越好。
×100%]越大,絮凝效果越好。
回答下列问题:
(1)“酸浸渣”中所含金属化合物是______ (填化学式)。常温下,调节“酸浸液”pH为______ (保留小数点后一位)时,溶液中c(Cu2+)=0.01mol•L-1。
(2)生成Ca3(AsO4)2•Ca(OH)2的化学方程式为________ 。
(3)在一定温度下,将NaClO4加入“浓缩液”中可制取聚合硫酸铁[Fe2(OH)x(SO4)y]m。
①x和y的关系应满足:y=______ (用含x的式子表示)。
②“滤液3”中H2SO4的加入量对盐基度的影响如图所示,当n(H2SO4):n(FeSO4)>0.35时,产品的盐基度减小,其原因是________ 。

(4)①“萃余液”经______ 、______ 、过滤、洗涤,得到ZnSO4•7H2O晶体。
②加热ZnSO4•7H2O固体,固体质量保留百分数与温度的关系如图所示。将ZnSO4•7H2O(M=287g•mol-1)加热到145℃时得到ZnSO4•xH2O,其中x的值为______ ;温度为1050℃时,ZnSO4固体完全分解为ZnO以及两种气体(只有一种是氧化物),该反应的化学方程式为_______ 。


已知:①酸浸后As元素以H3AsO4形式存在;
②常温下,Ksp[Cu(OH)2]≈1.0×10-20;
③聚合硫酸铁盐基度[聚合硫酸铁中
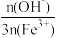 ×100%]越大,絮凝效果越好。
×100%]越大,絮凝效果越好。回答下列问题:
(1)“酸浸渣”中所含金属化合物是
(2)生成Ca3(AsO4)2•Ca(OH)2的化学方程式为
(3)在一定温度下,将NaClO4加入“浓缩液”中可制取聚合硫酸铁[Fe2(OH)x(SO4)y]m。
①x和y的关系应满足:y=
②“滤液3”中H2SO4的加入量对盐基度的影响如图所示,当n(H2SO4):n(FeSO4)>0.35时,产品的盐基度减小,其原因是

(4)①“萃余液”经
②加热ZnSO4•7H2O固体,固体质量保留百分数与温度的关系如图所示。将ZnSO4•7H2O(M=287g•mol-1)加热到145℃时得到ZnSO4•xH2O,其中x的值为

您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐2】通过下列实验探究Na2SO3溶液的性质。
(1)实验Ⅰ:将0.1mol/L Na2SO3溶液先升温后降温 过程中的pH记录如下表。实验过程中,取t1、t4时刻的溶液,加入盐酸酸化的BaCl2溶液,t4产生白色沉淀比t1多。
①用离子方程式表示t1时刻溶液呈碱性的原因:__________________________ 。
②根据t1→t4溶液的pH,结合平衡移动原理,推测t1→t3的过程中pH变化的原因____________ 。
(2)实验Ⅱ:研究Na2SO3溶液与酸性KIO3溶液的反应。按下表中用量将KIO3溶液、Na2SO3溶液(含淀粉)、H2SO4溶液和H2O混合,记录溶液变蓝色的时间t(s)。
①反应的离子方程式为_____________ 。
②通过三组实验对比,得出的结论是_____________ 。
(3)实验Ⅲ:向实验Ⅱ反应后的蓝色溶液中加入少量Na2SO3溶液,蓝色消失 ,后再次变蓝 。结合化学方程式解释产生这种现象的原因_____________ 。
(4)实验Ⅳ:将15mL 0.01mol/L KIO3溶液、1mL 0.1mol/L H2SO4溶液、8mL0.01mol/L KI溶液和_____________ 混合,混合溶液在4s后即变蓝。本实验证明了I-是Na2SO3溶液与酸性KIO3溶液反应的催化剂。
(1)实验Ⅰ:将0.1mol/L Na2SO3溶液
| 时刻 | t1 | t2 | t3 | t4 |
| 温度/℃ | 25 | 30 | 40 | 25 |
| pH | 9.66 | 9.52 | 9.37 | 9.25 |
②根据t1→t4溶液的pH,结合平衡移动原理,推测t1→t3的过程中pH变化的原因
(2)实验Ⅱ:研究Na2SO3溶液与酸性KIO3溶液的反应。按下表中用量将KIO3溶液、Na2SO3溶液(含淀粉)、H2SO4溶液和H2O混合,记录溶液变蓝色的时间t(s)。
| 编号 | 0.01mol/LKIO3(mL) | 0.01mol/LNa2SO3(含淀粉)(mL) | 0.1mol/LH2SO4(mL) | H2O(mL) | t(s) |
| 1 | 15 | 15 | 1 | 19 | 68.0 |
| 2 | 20 | 15 | 1 | 14 | 52.3 |
| 3 | 15 | 15 | 5 | 15 | 13.1 |
②通过三组实验对比,得出的结论是
(3)实验Ⅲ:向实验Ⅱ反应后的蓝色溶液中加入少量Na2SO3溶液,蓝色
(4)实验Ⅳ:将15mL 0.01mol/L KIO3溶液、1mL 0.1mol/L H2SO4溶液、8mL0.01mol/L KI溶液和
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
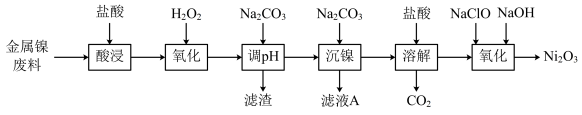
【推荐3】三氧化二镍(Ni2O3)是一种灰黑色无气味有光泽的块状物,易碎成细粉末,常用于制造高能电池。工业上以金属镍废料生产NiCl2,继而生产Ni2O3的工艺流程如下:
(1)为了提高金属镍废料浸出的速率,在“酸浸”时可采取的措施有①适当升高温度;②搅拌;③________ 等。
(2)酸浸后的酸性溶液中含有Ni2+、Cl-,另含有少量Fe2+、Fe3+、Al3+等。沉镍前需加Na2CO3控制溶液pH范围为____________________ 。
(3)从滤液A中可回收利用的主要物质是Na2CO3和________ 。
(4)“氧化”生成Ni2O3的离子方程式为__________________________________ 。
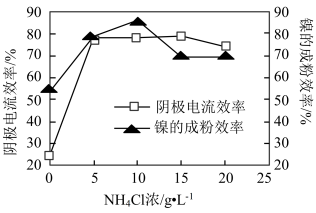
(5)工业上用镍为阳极,电解0.05~0.1 mol·L-1 NiCl2溶液与一定量NH4Cl组成的混合溶液,可得到高纯度、球形的超细镍粉。当其他条件一定时,NH4Cl的浓度对阴极电流效率及镍的成粉率的影响如图所示,则①NH4Cl的浓度最好控制为__________________________ 。________________________ 。
(6)如果在“沉镍”步骤把Na2CO3改为加草酸,则可以制得草酸镍晶体(NiC2O4·2H2O)。草酸镍晶体在热空气中干燥脱水后在高温下煅烧三小时,可以制得Ni2O3,同时获得混合气体。草酸镍晶体受热分解的化学方程式为___________________________________ 。
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 | Ni(OH)2 |
| 开始沉淀的pH | 1.8 | 5.8 | 3.0 | 7.1 |
| 沉淀完全的pH | 3.2 | 8.8 | 5.0 | 9.2 |
(2)酸浸后的酸性溶液中含有Ni2+、Cl-,另含有少量Fe2+、Fe3+、Al3+等。沉镍前需加Na2CO3控制溶液pH范围为
(3)从滤液A中可回收利用的主要物质是Na2CO3和
(4)“氧化”生成Ni2O3的离子方程式为
(5)工业上用镍为阳极,电解0.05~0.1 mol·L-1 NiCl2溶液与一定量NH4Cl组成的混合溶液,可得到高纯度、球形的超细镍粉。当其他条件一定时,NH4Cl的浓度对阴极电流效率及镍的成粉率的影响如图所示,则①NH4Cl的浓度最好控制为
(6)如果在“沉镍”步骤把Na2CO3改为加草酸,则可以制得草酸镍晶体(NiC2O4·2H2O)。草酸镍晶体在热空气中干燥脱水后在高温下煅烧三小时,可以制得Ni2O3,同时获得混合气体。草酸镍晶体受热分解的化学方程式为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
【推荐1】NaClO2常用来漂白织物,其漂白能力是漂白粉的4~5倍,NaClO2也是一种重要的杀菌消毒剂。工业上生产NaClO2的一种工艺流程如下图所示:
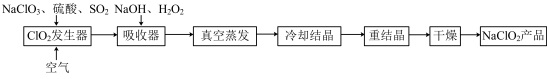
(1)ClO2发生器中的产品之一是NaHSO4,在该发生器中所发生反应的离子方程式为___________ 。
(2)反应结束后,向ClO2发生器中通入一定量空气,目的是___________ 。
(3)吸收器中发生反应的化学方程式为___________ 。吸收器中要用冷的NaOH溶液和H2O2溶液吸收CO2,原因是___________ 。
(4)将ClO2通入食盐水中,用情性电极电解,也可以制得NaClO2产品。阳极的电解产物是___________ (填化学式),阴极的电极反应式为___________ 。
(5)相同条件下,1 mol NaClO2与___________ gCl2的氧化能力相当。

(1)ClO2发生器中的产品之一是NaHSO4,在该发生器中所发生反应的离子方程式为
(2)反应结束后,向ClO2发生器中通入一定量空气,目的是
(3)吸收器中发生反应的化学方程式为
(4)将ClO2通入食盐水中,用情性电极电解,也可以制得NaClO2产品。阳极的电解产物是
(5)相同条件下,1 mol NaClO2与
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
【推荐2】毒重石的主要成分 (含
(含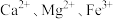 等杂质),实验室利用毒重石制备
等杂质),实验室利用毒重石制备 的流程如下:
的流程如下:
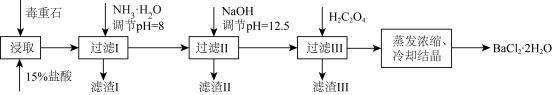
(1)毒重石用盐酸浸取,实验室用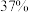 的盐酸配制
的盐酸配制 的盐酸,除量筒外还需使用下列仪器中的
的盐酸,除量筒外还需使用下列仪器中的___________ 。
a.烧杯 b.容量瓶 c.玻璃棒 d.滴定管
(2)
加入 调节
调节 可除去
可除去___________ (填离子符号),加入 时应避免过量,原因是
时应避免过量,原因是___________ 。已知: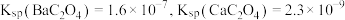
(3)利用简捷酸碱滴定法可测定 的含量,实验分两步进行。已知:
的含量,实验分两步进行。已知: ,
,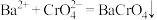 。
。
步骤Ⅰ:移取 一定浓度的
一定浓度的 溶液与锥形瓶中,加入酸碱指示剂,用
溶液与锥形瓶中,加入酸碱指示剂,用 盐酸标准液滴定至终点,测得滴加盐酸体积为
盐酸标准液滴定至终点,测得滴加盐酸体积为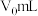 。
。
步骤Ⅱ:移取y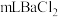 溶液于锥形瓶中,加入
溶液于锥形瓶中,加入 与步骤Ⅰ相同浓度的
与步骤Ⅰ相同浓度的 溶液,待
溶液,待 完全沉淀后,再加入酸碱指示剂,用
完全沉淀后,再加入酸碱指示剂,用 盐酸标准液滴定至终点,测得滴加盐酸的体积为
盐酸标准液滴定至终点,测得滴加盐酸的体积为 。
。
则 溶液的浓度为
溶液的浓度为___________  ,若步骤Ⅱ中滴加盐酸时有少量待测液浅出,
,若步骤Ⅱ中滴加盐酸时有少量待测液浅出, 浓度测量值将
浓度测量值将___________ (填“偏大”或“偏小”)。
 (含
(含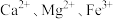 等杂质),实验室利用毒重石制备
等杂质),实验室利用毒重石制备 的流程如下:
的流程如下:
(1)毒重石用盐酸浸取,实验室用
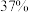 的盐酸配制
的盐酸配制 的盐酸,除量筒外还需使用下列仪器中的
的盐酸,除量筒外还需使用下列仪器中的a.烧杯 b.容量瓶 c.玻璃棒 d.滴定管
(2)
 |  |  | |
开始沉淀时的 | 11.9 | 9.1 | 1.9 |
完全沉淀时的 | 13.9 | 11.1 | 3.2 |
 调节
调节 可除去
可除去 时应避免过量,原因是
时应避免过量,原因是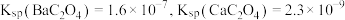
(3)利用简捷酸碱滴定法可测定
 的含量,实验分两步进行。已知:
的含量,实验分两步进行。已知: ,
,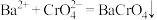 。
。步骤Ⅰ:移取
 一定浓度的
一定浓度的 溶液与锥形瓶中,加入酸碱指示剂,用
溶液与锥形瓶中,加入酸碱指示剂,用 盐酸标准液滴定至终点,测得滴加盐酸体积为
盐酸标准液滴定至终点,测得滴加盐酸体积为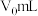 。
。步骤Ⅱ:移取y
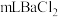 溶液于锥形瓶中,加入
溶液于锥形瓶中,加入 与步骤Ⅰ相同浓度的
与步骤Ⅰ相同浓度的 溶液,待
溶液,待 完全沉淀后,再加入酸碱指示剂,用
完全沉淀后,再加入酸碱指示剂,用 盐酸标准液滴定至终点,测得滴加盐酸的体积为
盐酸标准液滴定至终点,测得滴加盐酸的体积为 。
。则
 溶液的浓度为
溶液的浓度为 ,若步骤Ⅱ中滴加盐酸时有少量待测液浅出,
,若步骤Ⅱ中滴加盐酸时有少量待测液浅出, 浓度测量值将
浓度测量值将
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
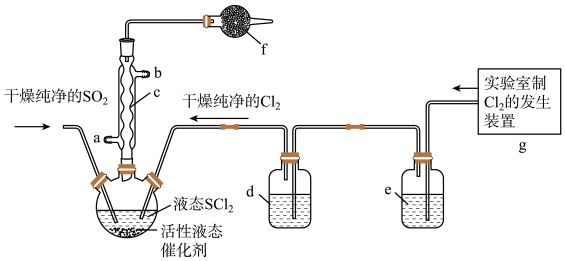
【推荐3】氯化亚砜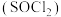 在农药、制药行业中用途广泛。某化学研究性学习小组通过查阅资料,设计了如下图所示装置来制备
在农药、制药行业中用途广泛。某化学研究性学习小组通过查阅资料,设计了如下图所示装置来制备 。
。
已知:① 是一种液态化合物,沸点为77℃
是一种液态化合物,沸点为77℃
② 遇水剧烈反应,液面上产生白雾,并有刺激性气味的气体产生
遇水剧烈反应,液面上产生白雾,并有刺激性气味的气体产生
③实验室合成 原理:
原理:
请回答以下问题:
(1)仪器c的名称是_______ ,f中的最佳试剂是_______ (填字母符号)。
A.碱石灰 B.浓硫酸 C. 溶液 D.无水氯化钙
溶液 D.无水氯化钙
(2)实验室用浓盐酸与 粉末反应制
粉末反应制 的化学方程式为
的化学方程式为________ 。
(3) 与水反应的化学方程式为
与水反应的化学方程式为_______ 。
(4)下列三种制备 的方案中最佳选择是
的方案中最佳选择是_________ .
(5)装置g中产生的 经过e、d后进入三颈烧瓶,e中的试剂为
经过e、d后进入三颈烧瓶,e中的试剂为_____ 。
(6)实验结束后,将三颈烧瓶中混合物分离开的实验操作是_____ (已知 的沸点为50℃);若反应中消耗
的沸点为50℃);若反应中消耗 的体积为
的体积为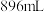 (已转化为标准状况,
(已转化为标准状况, 足量),最后得到
足量),最后得到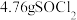 ,则
,则 的产率为
的产率为_______ (已知产率=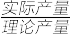 ×100%)。
×100%)。
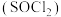 在农药、制药行业中用途广泛。某化学研究性学习小组通过查阅资料,设计了如下图所示装置来制备
在农药、制药行业中用途广泛。某化学研究性学习小组通过查阅资料,设计了如下图所示装置来制备 。
。
已知:①
 是一种液态化合物,沸点为77℃
是一种液态化合物,沸点为77℃②
 遇水剧烈反应,液面上产生白雾,并有刺激性气味的气体产生
遇水剧烈反应,液面上产生白雾,并有刺激性气味的气体产生③实验室合成
 原理:
原理:
请回答以下问题:
(1)仪器c的名称是
A.碱石灰 B.浓硫酸 C.
 溶液 D.无水氯化钙
溶液 D.无水氯化钙(2)实验室用浓盐酸与
 粉末反应制
粉末反应制 的化学方程式为
的化学方程式为(3)
 与水反应的化学方程式为
与水反应的化学方程式为(4)下列三种制备
 的方案中最佳选择是
的方案中最佳选择是方案 | 甲 | 乙 | 丙 |
| 发生装置 |
|
|
|
| 所选试剂 | 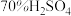 和 和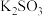 粉末 粉末 | 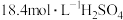 铜片 铜片 | 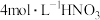 和 和 粉末 粉末 |
 经过e、d后进入三颈烧瓶,e中的试剂为
经过e、d后进入三颈烧瓶,e中的试剂为(6)实验结束后,将三颈烧瓶中混合物分离开的实验操作是
 的沸点为50℃);若反应中消耗
的沸点为50℃);若反应中消耗 的体积为
的体积为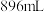 (已转化为标准状况,
(已转化为标准状况, 足量),最后得到
足量),最后得到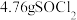 ,则
,则 的产率为
的产率为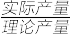 ×100%)。
×100%)。
您最近一年使用:0次