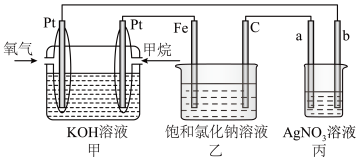
人们应用原电池原理制作了多种电池以满足不同的需要。在现代生活、生产和科学技术发展中,电池发挥着越来越重要的作用。请根据题中提供的信息,回答下列问题:
(1)直接提供电能的反应一般是放热反应,下列反应能设计成原电池的是 _______。
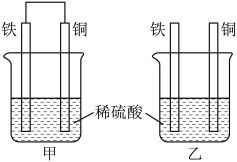
(2)将纯铁片和纯铜片按图甲、乙方式插入100 mL相同浓度的稀硫酸中一段时间,回答下列问题:_______ 。
A.甲、乙均为化学能转变为电能的装置
B.乙中铜片上没有明显变化
C.甲中铜片质量减少、乙中铁片质量减少
D.甲、乙两烧杯中c(H+)均减小
②在相同时间内,两烧杯中产生气泡的速度:甲_______ 乙(填“>”、 “<”或“=”)。
③请写出甲、乙中构成原电池的正极电极反应式:_______ 。电池工作时,溶液中 向
向_______ 极(填“正”或“负”)移动。当甲中溶液质量增重 27g时,电极上转移电子数目为_______ 。
④若将甲中的稀硫酸换为浓硝酸,则电池总反应的离子方程式为_______ 。
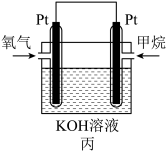
(3)图丙为甲烷氧气燃料电池的构造示意图,电解质溶液的溶质是 KOH。通甲烷一极是电池的______ 极发生_______ 反应。
(1)直接提供电能的反应一般是放热反应,下列反应能设计成原电池的是 _______。
| A.Ba(OH)2·8H2O与NH4Cl反应 | B.氢氧化钠与稀盐酸反应 |
| C.灼热的炭与 CO2反应 | D.H2与 Cl2燃烧反应 |
A.甲、乙均为化学能转变为电能的装置
B.乙中铜片上没有明显变化
C.甲中铜片质量减少、乙中铁片质量减少
D.甲、乙两烧杯中c(H+)均减小
②在相同时间内,两烧杯中产生气泡的速度:甲
③请写出甲、乙中构成原电池的正极电极反应式:
 向
向④若将甲中的稀硫酸换为浓硝酸,则电池总反应的离子方程式为
(3)图丙为甲烷氧气燃料电池的构造示意图,电解质溶液的溶质是 KOH。通甲烷一极是电池的
更新时间:2023-04-17 21:23:38
|
相似题推荐
填空题
|
适中
(0.65)
名校
【推荐1】化学反应过程中伴随着能量变化,请回答下列问题:
(1)下列反应中,属于放热反应的是___________ (填序号,下同),属于吸热反应的是___________ 。
①物质燃烧 ②二氧化碳通过炽热的碳 ③生石灰溶于水的过程 ④炸药爆炸 ⑤碳酸钙高温分解
(2)某实验小组同学进行如图所示实验,以检验化学反应中的能量变化。

实验发现,反应后①中的温度升高,②中的温度降低。由此判断铝条与盐酸的反应是___________ 反应(填“放出”或“吸收”,下同),Ba(OH)2·8H2O与NH4Cl的反应是___________ 反应。反应___________ (填①或②)的能量变化可用图(b)表示。
(3)一定量的氢气在氧气中充分燃烧并放出热量。若生成气态水放出的热量为Q1,生成液态水放出的热量为Q2,那么Q1___________ (填大于、小于或等于)Q2。
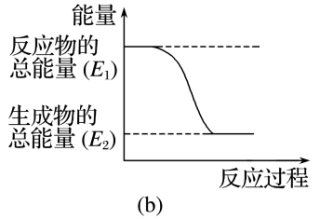
(4)在化学反应中,只有极少数能量比平均能量高得多的反应物分子发生碰撞时才可能发生化学反应,这些分子被称为活化分子。使普通分子变成活化分子所需提供的最低限度的能量叫活化能,其单位通常用kJ·mol-1表示。请认真观察下图,然后回答问题。
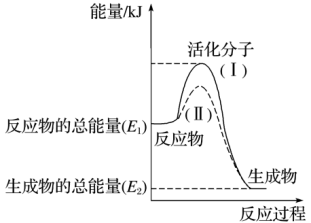
图中所示反应是___________ (填“吸热”或“放热”)反应。
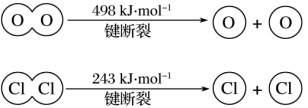
(5)已知拆开1molH-H键、1molI-I键、1molH-I键分别需要吸收的能量为436kJ、151kJ、299kJ。则反应掉1mol氢气和1mol碘,生成HI会___________ (填“放出”或“吸收”)___________ kJ的热量。
(6)已知:4HCl+O2=2Cl2+2H2O,该反应中,4 mol HCl被氧化,放出115.6 kJ的热量,则断开1 mol H—O键与断开1 mol H—Cl键所需能量相差约为___________ kJ。
(1)下列反应中,属于放热反应的是
①物质燃烧 ②二氧化碳通过炽热的碳 ③生石灰溶于水的过程 ④炸药爆炸 ⑤碳酸钙高温分解
(2)某实验小组同学进行如图所示实验,以检验化学反应中的能量变化。


实验发现,反应后①中的温度升高,②中的温度降低。由此判断铝条与盐酸的反应是
(3)一定量的氢气在氧气中充分燃烧并放出热量。若生成气态水放出的热量为Q1,生成液态水放出的热量为Q2,那么Q1
(4)在化学反应中,只有极少数能量比平均能量高得多的反应物分子发生碰撞时才可能发生化学反应,这些分子被称为活化分子。使普通分子变成活化分子所需提供的最低限度的能量叫活化能,其单位通常用kJ·mol-1表示。请认真观察下图,然后回答问题。

图中所示反应是
(5)已知拆开1molH-H键、1molI-I键、1molH-I键分别需要吸收的能量为436kJ、151kJ、299kJ。则反应掉1mol氢气和1mol碘,生成HI会
(6)已知:4HCl+O2=2Cl2+2H2O,该反应中,4 mol HCl被氧化,放出115.6 kJ的热量,则断开1 mol H—O键与断开1 mol H—Cl键所需能量相差约为

您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐2】完成下列填空:
(1)0.3 mol气态高能燃料乙硼烷(B2H6)在氧气中燃烧,生成固态三氧化二硼和液态水放出649.5 kJ热量,其热化学方程式为:___________ ;
(2)已知H-H键键能为436 kJ/mol,H-N键键能为391 kJ/mol,根据化学方程式:N2(g)+3H2(g) 2NH3(g)
2NH3(g)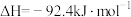 ,则N≡N键键能是
,则N≡N键键能是___________ ;
(3)1 mol氧气与足量氢气反应生成水蒸气放热483.6 kJ,若1 mol水蒸气转化成液态水放热44 kJ,写出表示氢气燃烧热的热化学方程式:___________ ;
(4)下列反应中,属于放热反应的是___________ ,属于吸热反应的是___________ ;
a.盐酸与烧碱溶液反应
b.Ba(OH)2•8H2O+2NH4Cl=BaCl2+10H2O+2NH3↑
c.氢气在氧气中燃烧生成水
d.高温煅烧石灰石使其分解
e.铝和盐酸反应
(5)已知:①
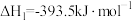
②
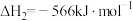
③
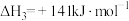
则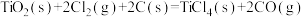 的
的 =
= ___________ 。
(1)0.3 mol气态高能燃料乙硼烷(B2H6)在氧气中燃烧,生成固态三氧化二硼和液态水放出649.5 kJ热量,其热化学方程式为:
(2)已知H-H键键能为436 kJ/mol,H-N键键能为391 kJ/mol,根据化学方程式:N2(g)+3H2(g)
 2NH3(g)
2NH3(g)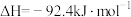 ,则N≡N键键能是
,则N≡N键键能是(3)1 mol氧气与足量氢气反应生成水蒸气放热483.6 kJ,若1 mol水蒸气转化成液态水放热44 kJ,写出表示氢气燃烧热的热化学方程式:
(4)下列反应中,属于放热反应的是
a.盐酸与烧碱溶液反应
b.Ba(OH)2•8H2O+2NH4Cl=BaCl2+10H2O+2NH3↑
c.氢气在氧气中燃烧生成水
d.高温煅烧石灰石使其分解
e.铝和盐酸反应
(5)已知:①

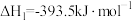
②

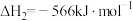
③

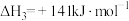
则
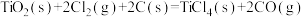 的
的 =
=
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐3】反应Fe+H2SO4=FeSO4+H2↑的能量变化如图所示:
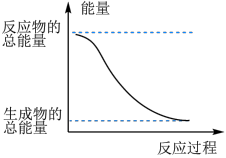
(1)该反应为___________ 反应(填“吸热”或“放热”)。
(2)若将上述反应设计成原电池,铜为原电池某一极材料,则铜为___________ (填“正”或“负”)极;其电极反应式为:___________ ,外电路中电流由___________ 流出。(填电极材料名称)。
(3)若要使该反应的反应速率加快,下列措施可行的是 。

(1)该反应为
(2)若将上述反应设计成原电池,铜为原电池某一极材料,则铜为
(3)若要使该反应的反应速率加快,下列措施可行的是 。
| A.增加铁的量 | B.改稀硫酸为98%的硫酸 |
| C.增大压强 | D.滴加几滴CuSO4溶液 |
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐1】(1) ①如图1所示的HCOOH燃料电池放电的本质是通过HCOOH与 的反应,将化学能转化为电能,其反应的离子方程式为
的反应,将化学能转化为电能,其反应的离子方程式为___________ 。
②两电极区间用允许 、
、 通过的半透膜隔开。电池负极电极反应式为
通过的半透膜隔开。电池负极电极反应式为___________ ;
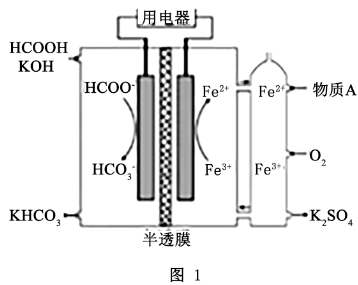
(2)电解熔融 Al2O3,电解过程中作阳极的石墨易消耗,原因是___________ 。
(3)电解Na2CO3溶液,原理如图所示。
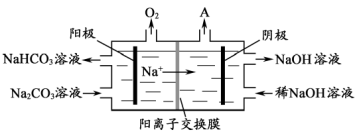
阳极的电极反应式为___________ ,
(4) 与盐酸、氧气构成燃料电池,则燃料电池的负极反应式为
与盐酸、氧气构成燃料电池,则燃料电池的负极反应式为 ___________ 。
 的反应,将化学能转化为电能,其反应的离子方程式为
的反应,将化学能转化为电能,其反应的离子方程式为②两电极区间用允许
 、
、 通过的半透膜隔开。电池负极电极反应式为
通过的半透膜隔开。电池负极电极反应式为
(2)电解熔融 Al2O3,电解过程中作阳极的石墨易消耗,原因是
(3)电解Na2CO3溶液,原理如图所示。

阳极的电极反应式为
(4)
 与盐酸、氧气构成燃料电池,则燃料电池的负极反应式为
与盐酸、氧气构成燃料电池,则燃料电池的负极反应式为
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】Ⅰ、某实验小组同学进行如下实验,以检验化学反应中的能量变化。请回答下列问题:
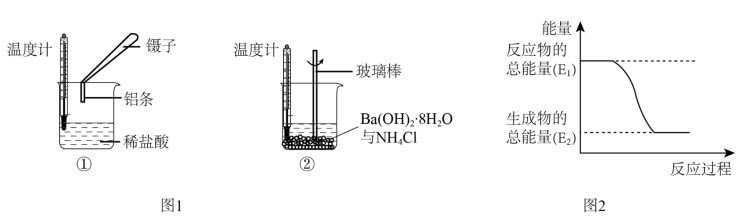
(1)实验中发现,反应后①中的温度升高;②中的温度降低.由此判断铝条与盐酸的反应是________ ,Ba(OH)2•8H2O与NH4Cl的反应是________ .反应过程________ (填“①”或“②”)的能量变化可用图2表示。
(2)现有如下两个反应:A、NaOH+HCl=NaCl+H2O;B、2FeCl3+Cu=2FeCl2+CuCl2,以上两个反应能设计成原电池的是________ ,负极材料为:________ ,电解质溶液为:________ ,负极的电极反应式为:________ 。
Ⅱ、某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验。利用如图装置可验证同主族元素非金属性的变化规律

(1)仪器A的名称为________ ,干燥管D的作用为________ 。
(2)若要证明非金属性:Cl>I,则A中加浓盐酸,B中加KMnO4(KMnO4与浓盐酸常温下反应生成氯气),C中加淀粉碘化钾混合溶液,观察到C中溶液________ (填现象)即可证明。从环境保护的观点考虑,此装置缺少尾气处理装置,可用NaOH溶液吸收尾气。
(3)若要证明非金属性:C>Si,则在A中加盐酸、B中加CaCO3、C中可加________ 溶液,观察到C中溶液________ (填现象),即可证明,反应的离子方程式为:________ ,但有的同学认为该实验不严谨,应在两装置间添加装有________ 溶液的洗气瓶,目的是________ 。

(1)实验中发现,反应后①中的温度升高;②中的温度降低.由此判断铝条与盐酸的反应是
(2)现有如下两个反应:A、NaOH+HCl=NaCl+H2O;B、2FeCl3+Cu=2FeCl2+CuCl2,以上两个反应能设计成原电池的是
Ⅱ、某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验。利用如图装置可验证同主族元素非金属性的变化规律

(1)仪器A的名称为
(2)若要证明非金属性:Cl>I,则A中加浓盐酸,B中加KMnO4(KMnO4与浓盐酸常温下反应生成氯气),C中加淀粉碘化钾混合溶液,观察到C中溶液
(3)若要证明非金属性:C>Si,则在A中加盐酸、B中加CaCO3、C中可加
您最近一年使用:0次
【推荐3】(1)肼(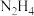 )-空气燃料电池是一种碱性电池,该电池放电时,负极的反应式为
)-空气燃料电池是一种碱性电池,该电池放电时,负极的反应式为_____________________ 。
(2)科研人员新近开发一种由甲醇和氧气为燃料,强碱溶液作电解质溶液的新型手机电池,可供手机连续使用一个月。则通入甲醇的是_______ 填(“正”或“负”)极,写出该电池的负极反应式:_____________________ 。
(3)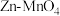 干电池应用广泛,电解质溶液是
干电池应用广泛,电解质溶液是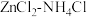 混合溶液。
混合溶液。
①该电池的负极材料是______ 。电池工作时,电子流向__________ 填(“正”或“负”)极。
②若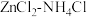 混合溶液中含有杂质
混合溶液中含有杂质 ,会加速某电极的腐蚀,其主要原因是
,会加速某电极的腐蚀,其主要原因是_______ 。
③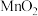 的生产方法之一是以石墨为电极,电解酸化的
的生产方法之一是以石墨为电极,电解酸化的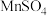 溶液。阳极的主要电极反应式是
溶液。阳极的主要电极反应式是_____________________ 。若电路中通过4mol电子,标准状况下产生气体的物质的量为_________ 。
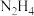 )-空气燃料电池是一种碱性电池,该电池放电时,负极的反应式为
)-空气燃料电池是一种碱性电池,该电池放电时,负极的反应式为(2)科研人员新近开发一种由甲醇和氧气为燃料,强碱溶液作电解质溶液的新型手机电池,可供手机连续使用一个月。则通入甲醇的是
(3)
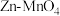 干电池应用广泛,电解质溶液是
干电池应用广泛,电解质溶液是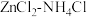 混合溶液。
混合溶液。①该电池的负极材料是
②若
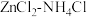 混合溶液中含有杂质
混合溶液中含有杂质 ,会加速某电极的腐蚀,其主要原因是
,会加速某电极的腐蚀,其主要原因是③
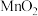 的生产方法之一是以石墨为电极,电解酸化的
的生产方法之一是以石墨为电极,电解酸化的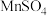 溶液。阳极的主要电极反应式是
溶液。阳极的主要电极反应式是
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐1】物质发生化学反应时,常常伴随有能量变化。某学习小组用如图所示装置A、B分别探究金属锌与稀硫酸的反应,实验过程中A烧杯内的溶液温度升高,B烧杯的电流计指针发生偏转,请回答以下问题。
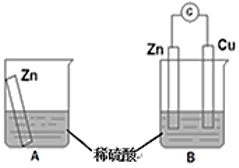
(1)A烧杯中反应的离子方程式为___________ 。
(2)B中Zn板是___________ 极,发生反应的电极反应式是___________ 。
(3)从能量转化的角度来看,A、B中反应物的总能量___________ (填“大于”、“小于”或“等于”)生成物总能量,A中是将化学能转变为___________ ,B中是将化学能转变为___________ 。
(4)该小组同学反思原电池的原理,其中观点正确的是___________(填字母序号)。

(1)A烧杯中反应的离子方程式为
(2)B中Zn板是
(3)从能量转化的角度来看,A、B中反应物的总能量
(4)该小组同学反思原电池的原理,其中观点正确的是___________(填字母序号)。
| A.原电池反应的过程中一定有电子转移 |
| B.原电池装置需要2个电极 |
| C.电极一定都参加反应 |
| D.氧化反应和还原反应可以拆开在两极发生 |
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐2】由锌片、铜片和200mL稀H2SO4组成的原电池如下图所示:
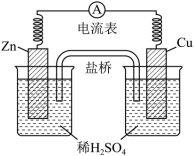
(1)原电池的负极反应式为___________ ,正极反应式为___________ ,盐桥中的K+向___________ (填“铜”或“锌”)电极移动。
(2)一段时间后,当在铜片上放出5.6L(标准状况)气体时,H2SO4恰好消耗一半,则产生这些气体的同时,共消耗___________ g锌,有___________ mol电子通过了导线,原硫酸的物质的量浓度是___________ 。
(3)在碱性锌电池中,用高铁酸钾作为正极材料,电池反应为2K2FeO4+3Zn=Fe2O3+ZnO+2K2ZnO2,该电池正极发生的反应的电极反应式为___________ 。

(1)原电池的负极反应式为
(2)一段时间后,当在铜片上放出5.6L(标准状况)气体时,H2SO4恰好消耗一半,则产生这些气体的同时,共消耗
(3)在碱性锌电池中,用高铁酸钾作为正极材料,电池反应为2K2FeO4+3Zn=Fe2O3+ZnO+2K2ZnO2,该电池正极发生的反应的电极反应式为
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐1】现代社会的一切活动都离不开能量,化学反应在发生物质变化的同时伴随能量变化,能量、速率与限度是认识和研究化学反应的重要视角。
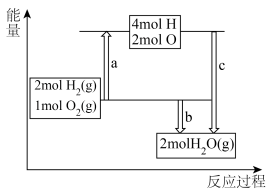
(1)已知破坏1 mol H-H、1 mol O=O、1 mol H-O时分别需要吸收436 kJ、498 kJ、465kJ的能量。H2、O2转化为H2O(g)反应过程的能量变化如图,则b表示的能量为________ 。_______________________________ 。
②电池工作一段时间后电解质溶液的pH___________ (填“增大”“减小”或“不变”)。
(3)CO2可通过反应 转化成有机物,实现碳循环。一定条件下,在体积为2L的恒容密闭容器中,充入2mol CO2(g)和6mol H2(g),测得CO2(g)和CH3OH(g)的浓度随时间的变化如图所示。
转化成有机物,实现碳循环。一定条件下,在体积为2L的恒容密闭容器中,充入2mol CO2(g)和6mol H2(g),测得CO2(g)和CH3OH(g)的浓度随时间的变化如图所示。___________ 。
a.气体密度不再改变
b.混合气体的平均相对分子质量不再改变
c.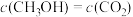
d.单位时间CO2和CH3OH(g)的消耗速率相等
②反应进行到3min时,正反应速率________ (填“>”“<”或“=”)逆反应速率。
③0 min~9 min 内,v(H2)=________ mol/(L·min)。
④平衡时CO2的转化率为________ 。
(1)已知破坏1 mol H-H、1 mol O=O、1 mol H-O时分别需要吸收436 kJ、498 kJ、465kJ的能量。H2、O2转化为H2O(g)反应过程的能量变化如图,则b表示的能量为
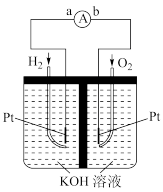
②电池工作一段时间后电解质溶液的pH
(3)CO2可通过反应
 转化成有机物,实现碳循环。一定条件下,在体积为2L的恒容密闭容器中,充入2mol CO2(g)和6mol H2(g),测得CO2(g)和CH3OH(g)的浓度随时间的变化如图所示。
转化成有机物,实现碳循环。一定条件下,在体积为2L的恒容密闭容器中,充入2mol CO2(g)和6mol H2(g),测得CO2(g)和CH3OH(g)的浓度随时间的变化如图所示。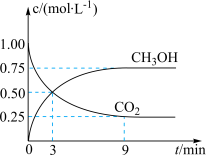
a.气体密度不再改变
b.混合气体的平均相对分子质量不再改变
c.
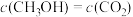
d.单位时间CO2和CH3OH(g)的消耗速率相等
②反应进行到3min时,正反应速率
③0 min~9 min 内,v(H2)=
④平衡时CO2的转化率为
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】原电池原理在生产、生活中应用广泛。
(1)市场上出售的“热敷袋”主要成分是铁屑、碳粉和少量氯化钠、水等。在“热敷袋”使用前,用塑料袋使之与空气隔绝:使用时打开塑料袋轻轻揉搓,就会放出热量;使用完后,会发现袋内有许多铁锈生成。
①与正常铁生锈相比,“热敷袋”内铁生锈明显更快,原因是_______ 。
②碳粉的作用是_______ ,氯化钠的作用是_______ 。
(2)一种处理垃圾渗透液并用其发电的装置工作示意图如图所示:
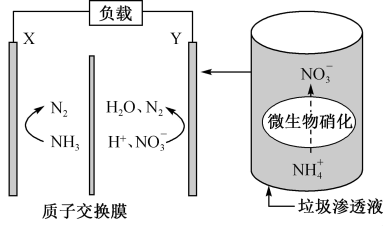
①在空气里,微生物将垃圾渗透液硝化,写出该反应的离子方程式:_______ 。
②电极X是该电池的_______ (填“正”或“负”)极,另一电极的电极反应式为_______ 。
③当转移0.15mol电子时,生成标准状况下N2的体积为_______ 。
(1)市场上出售的“热敷袋”主要成分是铁屑、碳粉和少量氯化钠、水等。在“热敷袋”使用前,用塑料袋使之与空气隔绝:使用时打开塑料袋轻轻揉搓,就会放出热量;使用完后,会发现袋内有许多铁锈生成。
①与正常铁生锈相比,“热敷袋”内铁生锈明显更快,原因是
②碳粉的作用是
(2)一种处理垃圾渗透液并用其发电的装置工作示意图如图所示:

①在空气里,微生物将垃圾渗透液硝化,写出该反应的离子方程式:
②电极X是该电池的
③当转移0.15mol电子时,生成标准状况下N2的体积为
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐3】结合所学知识,按要求回答问题。
(1)按要求写出电极反应式
①碱性锌锰电池的总反应为Zn+2MnO2+2H2O=2MnO(OH)+Zn(OH)2,写出正极反应式___________ 。
②将2FeCl3+2KI=I2+2FeCl2+2KCl设计成双液电池:正极烧杯中盛放的溶液为___________ ,电池负极的电极反应式为___________ 。
(2)如图是以石墨为电极,电解MgCl2溶液的装置:
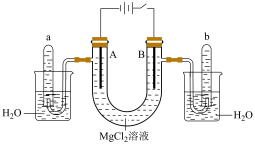
①电解时,A电极发生的电极反应为___________ 。
②检验b管中气体的方法是___________ 。
(3)某同学设计了如下图所示装置,用氢氧燃料电池作为电源探究粗铜精炼原理,根据要求回答问题:
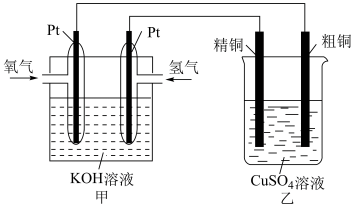
①甲装置中通入氧气的电极为___________ (填“正极”或“负极”),氧气发生的电极反应式___________ 。
②如果粗铜中含有铁、银等杂质,粗铜电极发生的电极反应式有___________ 。乙装置中反应一段时间后,CuSO4溶液的浓度___________ (填“增大”、“减小”或“不变”)。
③已知NA为阿伏加德罗常数的值。若在标准状况下,甲装置有2.24L氧气参加反应,则乙装置中阴极析出铜的质量理论上为___________ g。
(1)按要求写出电极反应式
①碱性锌锰电池的总反应为Zn+2MnO2+2H2O=2MnO(OH)+Zn(OH)2,写出正极反应式
②将2FeCl3+2KI=I2+2FeCl2+2KCl设计成双液电池:正极烧杯中盛放的溶液为
(2)如图是以石墨为电极,电解MgCl2溶液的装置:

①电解时,A电极发生的电极反应为
②检验b管中气体的方法是
(3)某同学设计了如下图所示装置,用氢氧燃料电池作为电源探究粗铜精炼原理,根据要求回答问题:

①甲装置中通入氧气的电极为
②如果粗铜中含有铁、银等杂质,粗铜电极发生的电极反应式有
③已知NA为阿伏加德罗常数的值。若在标准状况下,甲装置有2.24L氧气参加反应,则乙装置中阴极析出铜的质量理论上为
您最近一年使用:0次