反应Fe+H2SO4=FeSO4+H2↑的能量变化如图所示:
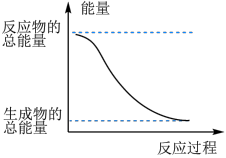
(1)该反应为___________ 反应(填“吸热”或“放热”)。
(2)若将上述反应设计成原电池,铜为原电池某一极材料,则铜为___________ (填“正”或“负”)极;其电极反应式为:___________ ,外电路中电流由___________ 流出。(填电极材料名称)。
(3)若要使该反应的反应速率加快,下列措施可行的是 。

(1)该反应为
(2)若将上述反应设计成原电池,铜为原电池某一极材料,则铜为
(3)若要使该反应的反应速率加快,下列措施可行的是 。
| A.增加铁的量 | B.改稀硫酸为98%的硫酸 |
| C.增大压强 | D.滴加几滴CuSO4溶液 |
更新时间:2024-01-09 19:48:07
|
相似题推荐
填空题
|
适中
(0.65)
解题方法
【推荐1】放热反应
(1)把___________ 热量的化学反应称为放热反应。如___________ 金属与酸的反应,___________ 反应,中和反应等。
(2)某化学反应,设反应物的总能量为E1,生成物的总能量为E2,若该反应为放热反应,则E1___________ E2。
(1)把
(2)某化学反应,设反应物的总能量为E1,生成物的总能量为E2,若该反应为放热反应,则E1
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐2】(1)以下反应:①木炭与水制备水煤气,②氯酸钾分解,③炸药爆炸,④酸与碱的中和反应,⑤生石灰与水作用制熟石灰,⑥Ba(OH)2•H2O 与 NH4Cl ,⑦浓硫酸溶于水, 属于放热反应__________ .(填序号)
(2)Mg-Al-NaOH 电池中的负极反应:___________ .
(3)FeCl3 溶液常用于腐蚀印刷电路铜板,发生 2FeCl3+Cu=2FeCl2+CuCl2,若将 此反应设计成原电池,则负极所用电极材料为___________ ,当线路中转移 0.2mol 电 子时,则被腐蚀铜的质量为___________ g.
(4)已知拆开 1mol H-H 键、1mol N≡N、1mol N-H 键分别需要吸收的能量为 436kJ、946k J、391k J.则由 N2 和 H2 反应生成 1mol NH3 需要放出___________ 的热量。
(5)用序号回答:①HCl ②NaOH ③Cl2 ④H2O ⑤NH4Cl ⑥P4 ⑦NH3•H2O ⑧Na2O2 ⑨HClO⑩CaO⑪HF⑫MgCl2
属于共价化合物的是___________ ,存在非极性键的是___________ 。
(2)Mg-Al-NaOH 电池中的负极反应:
(3)FeCl3 溶液常用于腐蚀印刷电路铜板,发生 2FeCl3+Cu=2FeCl2+CuCl2,若将 此反应设计成原电池,则负极所用电极材料为
(4)已知拆开 1mol H-H 键、1mol N≡N、1mol N-H 键分别需要吸收的能量为 436kJ、946k J、391k J.则由 N2 和 H2 反应生成 1mol NH3 需要放出
(5)用序号回答:①HCl ②NaOH ③Cl2 ④H2O ⑤NH4Cl ⑥P4 ⑦NH3•H2O ⑧Na2O2 ⑨HClO⑩CaO⑪HF⑫MgCl2
属于共价化合物的是
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐3】研究化学反应中的能量转化是科研工作者的重要课题。回答下列问题:
(1)现有反应:①C+CO2 2CO;
2CO;
②Ba(OH)2•8H2O+2NH4Cl=BaCl2+10H2O+2NH3↑;
③Fe+H2SO4=FeSO4+H2↑;
④2Al+Fe2O3 2Fe+Al2O3。
2Fe+Al2O3。
以上四个反应中属于吸热反应的是____ (填序号)。
(2)如图,某课外兴趣小组设计了甲、乙、丙三个装置:
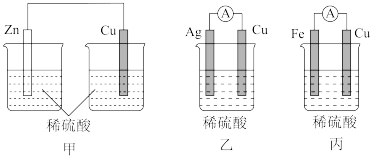
①能构成原电池的装置是____ 。
②能构成原电池的装置中,负极材料是____ (填化学式);负极的电极方程式为____ ;正极产生的现象是____ 。
③若原电池反应中有0.2mol电子转移,则生成的气体在标准状况下的体积为____ L。
(1)现有反应:①C+CO2
 2CO;
2CO;②Ba(OH)2•8H2O+2NH4Cl=BaCl2+10H2O+2NH3↑;
③Fe+H2SO4=FeSO4+H2↑;
④2Al+Fe2O3
 2Fe+Al2O3。
2Fe+Al2O3。以上四个反应中属于吸热反应的是
(2)如图,某课外兴趣小组设计了甲、乙、丙三个装置:

①能构成原电池的装置是
②能构成原电池的装置中,负极材料是
③若原电池反应中有0.2mol电子转移,则生成的气体在标准状况下的体积为
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐1】工业上用CO生产燃料甲醇。一定条件下发生反应:CO(g) +2H2(g) CH3OH(g) 。
CH3OH(g) 。

(1)甲图是反应时CO和CH3OH(g)的浓度随时间变化情况。从反应开始到平衡,用CO浓度变化表示平均反应速率v(CO)=________ mol•L-1•1min-1。
(2)乙图表示该反应进行过程中能量的变化。曲线a表示不使用催化剂时反应的能量变化,曲线b表示使用催化剂后的能量变化。反应的焓变是__________ (填“△H<0”或“△H>0”)反应,写出该反应的热化学方程式:__________ ;
(3)该反应平衡常数K的表达式为____ ,温度升高,平衡常数K________ (填“增大”、“不变”或“减小”)。
(4)下列措施能加快反应速率的是__________ 。
A 升高温度 B 增大容器的容积 C 再充入0.1molCO D 及时分离出CH3OH
(5)下列能说明反应达到平衡状态的是__________ 。
A 体系压强保持不变 B 混合气体总质量保持不变
C H2和CO的浓度相等 D 每消耗1 mol CO的同时生成1 mol CH3OH
 CH3OH(g) 。
CH3OH(g) 。
(1)甲图是反应时CO和CH3OH(g)的浓度随时间变化情况。从反应开始到平衡,用CO浓度变化表示平均反应速率v(CO)=
(2)乙图表示该反应进行过程中能量的变化。曲线a表示不使用催化剂时反应的能量变化,曲线b表示使用催化剂后的能量变化。反应的焓变是
(3)该反应平衡常数K的表达式为
(4)下列措施能加快反应速率的是
A 升高温度 B 增大容器的容积 C 再充入0.1molCO D 及时分离出CH3OH
(5)下列能说明反应达到平衡状态的是
A 体系压强保持不变 B 混合气体总质量保持不变
C H2和CO的浓度相等 D 每消耗1 mol CO的同时生成1 mol CH3OH
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】某化学反应2A B+D在四种不同条件下进行,B、D起始浓度为0.反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表:
B+D在四种不同条件下进行,B、D起始浓度为0.反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表:
根据上述数据,完成下列填空:
(1)在实验1,反应在10至20分钟时间内平均速率为______ 。
(2)在实验2,A的初始浓度c2=______ ,反应经20分钟就达到平衡,可推测实验2中还隐含的条件是______ 。
(3)设实验3的反应速率为v3,实验1的反应速率为v1,则v3______ v1(填“>”“<”“=”),且c3______ 1.0mol/L(填“>”“<”“=”)。
 B+D在四种不同条件下进行,B、D起始浓度为0.反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表:
B+D在四种不同条件下进行,B、D起始浓度为0.反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表:| 实验 序号 |  | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
| 1 | 800℃ | 1.0 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50 | 0.50 |
| 2 | 800℃ | c2 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 |
| 3 | 800℃ | c3 | 0.92 | 0.75 | 0.63 | 0.63 | 0.60 | 0.60 |
| 4 | 820℃ | 1.0 | 0.40 | 0.25 | 0.20 | 0.20 | 0.20 | 0.20 |
(1)在实验1,反应在10至20分钟时间内平均速率为
(2)在实验2,A的初始浓度c2=
(3)设实验3的反应速率为v3,实验1的反应速率为v1,则v3
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐3】化学是一门实用性很强的科学。根据题意填空:
(1)反应3Fe(s)+4H2O(g) Fe3O4(s)+4H2(g),在一可变容积的密闭容器中进行,试回答:
Fe3O4(s)+4H2(g),在一可变容积的密闭容器中进行,试回答:
①保持体积不变,充入N2使体系压强增大,其正反应速率____ ,逆反应速率____ 。
②保持压强不变,充入N2使容器的体积增大,其正反应速率____ ,逆反应速率____ 。
(2)海水提镁的重要步骤之一是用沉淀剂将海水中的Mg2+沉淀。该沉淀剂是____ (填“生石灰”或“盐酸”)。
(3)盛有浓硫酸的烧杯敞口放置一段时间,质量增加,则浓硫酸表现出_____ (填“吸水性”或“脱水性”)。
(4)浓硫酸与碳共热时发生反应2H2SO4(浓)+C CO2↑+2SO2↑+2H2O,在该反应中,浓硫酸表现出
CO2↑+2SO2↑+2H2O,在该反应中,浓硫酸表现出____ ,氧化产物是____ 。
(5)足量的Fe和稀硝酸反应的离子方程式为____ 。
(1)反应3Fe(s)+4H2O(g)
 Fe3O4(s)+4H2(g),在一可变容积的密闭容器中进行,试回答:
Fe3O4(s)+4H2(g),在一可变容积的密闭容器中进行,试回答:①保持体积不变,充入N2使体系压强增大,其正反应速率
②保持压强不变,充入N2使容器的体积增大,其正反应速率
(2)海水提镁的重要步骤之一是用沉淀剂将海水中的Mg2+沉淀。该沉淀剂是
(3)盛有浓硫酸的烧杯敞口放置一段时间,质量增加,则浓硫酸表现出
(4)浓硫酸与碳共热时发生反应2H2SO4(浓)+C
 CO2↑+2SO2↑+2H2O,在该反应中,浓硫酸表现出
CO2↑+2SO2↑+2H2O,在该反应中,浓硫酸表现出(5)足量的Fe和稀硝酸反应的离子方程式为
您最近一年使用:0次
【推荐1】有关电化学示意图如下。回答下列问题:
(1)图中正极的电极反应是______ ;当Zn片的质量减少0.65g时,外电路中有_____ mol电子通过。
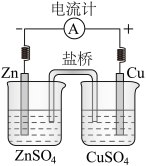
(2)预测图中U形管的实验现象是______ ;结合化学用语解释产生现象的原因____ 。
(3)用石墨电极电解滴加紫色石蕊溶液的稀Na2SO4溶液,通电后A、B两极均有无色气体生成,装置如图所示:
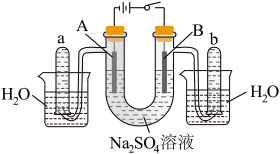
①NaOH在______ 极生成(填“A”或“B”)。
②B极发生反应的类型为______ 反应(填“氧化”或“还原”)。
(1)图中正极的电极反应是

(2)预测图中U形管的实验现象是

(3)用石墨电极电解滴加紫色石蕊溶液的稀Na2SO4溶液,通电后A、B两极均有无色气体生成,装置如图所示:

①NaOH在
②B极发生反应的类型为
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐2】(1)Li-SOCl2电池可用于心脏起搏器。该电池的电极材料分锂和碳,电解液是LiAlCl4-SOCl2,电池的总反应可表示为4Li+2SOCl2=4LiCl+S+SO2。请回答下列问题:
①正极发生的电极反应为___ 。
②SOCl2易挥发,实验室中常用NaOH溶液吸收SOCl2,有Na2SO3和NaCl生成。如果把少量水滴到SOCl2中,实验现象是___ 。
(2)用铂作电极电解某金属的氯化物(XCl2)溶液,当收集到1.12L氯气时(标准状况下),阴极增重3.2g。
①该金属的相对原子质量为___ 。
②电路中通过___ 个电子。
①正极发生的电极反应为
②SOCl2易挥发,实验室中常用NaOH溶液吸收SOCl2,有Na2SO3和NaCl生成。如果把少量水滴到SOCl2中,实验现象是
(2)用铂作电极电解某金属的氯化物(XCl2)溶液,当收集到1.12L氯气时(标准状况下),阴极增重3.2g。
①该金属的相对原子质量为
②电路中通过
您最近一年使用:0次



