氨基甲酸铵(H2NCOONH4)为尿素生产过程的中间产物,易分解。某小组对氨基甲酸铵的分解实验进行探究
已知:Ⅰ.N2(g)+3H2(g) ⇌2NH3(g) ΔH1=-92.4 kJ·mol-1
Ⅱ.C(s)+O2(g) ⇌CO2(g) ΔH2=-393.8 kJ·mol-1
Ⅲ.N2(g)+3H2(g)+C(s)+O2(g) ⇌H2NCOONH4(s) ΔH3=-645.7 kJ·mol-1
(1)写出H2NCOONH4分解生成NH3与CO2气体的热化学方程式:_______
(2)已知:R ln Kp=- +C(C为常数)。根据表中实验数据得到图像(如图所示),则该反应的反应热ΔH=
+C(C为常数)。根据表中实验数据得到图像(如图所示),则该反应的反应热ΔH=_______ kJ·mol-1

已知:Ⅰ.N2(g)+3H2(g) ⇌2NH3(g) ΔH1=-92.4 kJ·mol-1
Ⅱ.C(s)+O2(g) ⇌CO2(g) ΔH2=-393.8 kJ·mol-1
Ⅲ.N2(g)+3H2(g)+C(s)+O2(g) ⇌H2NCOONH4(s) ΔH3=-645.7 kJ·mol-1
(1)写出H2NCOONH4分解生成NH3与CO2气体的热化学方程式:
(2)已知:R ln Kp=-
 +C(C为常数)。根据表中实验数据得到图像(如图所示),则该反应的反应热ΔH=
+C(C为常数)。根据表中实验数据得到图像(如图所示),则该反应的反应热ΔH=
2023高三·全国·专题练习 查看更多[3]
(已下线)题型一 反应热的计算-备战2024年高考化学答题技巧与模板构建(已下线)题型14 盖斯定律与热化学方程式(已下线)01 常考题空1 热化学方程式及反应热的计算 (解析)-备战2023年高考化学大题逐空突破系列(全国通用)
更新时间:2023-05-06 18:21:47
|
相似题推荐
填空题
|
较易
(0.85)
名校
解题方法
【推荐1】已知下列热化学方程式:
①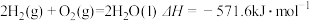
②
(1)氢气的摩尔燃烧焓是______________ 。
(2)已知: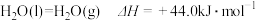 。写出丙烷
。写出丙烷 燃烧生成二氧化碳和液态水的热化学方程式:
燃烧生成二氧化碳和液态水的热化学方程式:___________________________ 。
(3)实验测得 和
和 的混合气体共
的混合气体共 ,完全燃烧生成液态水时放热
,完全燃烧生成液态水时放热 ,则混合气体中
,则混合气体中 和
和 的体积比是
的体积比是__________ 。
(4)当反应②中转移10mol电子时,燃烧的丙烷 的质量是
的质量是_________ g,生成的CO2在标准状况下的体积是_________ L。
①
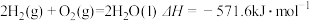
②

(1)氢气的摩尔燃烧焓是
(2)已知:
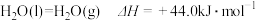 。写出丙烷
。写出丙烷 燃烧生成二氧化碳和液态水的热化学方程式:
燃烧生成二氧化碳和液态水的热化学方程式:(3)实验测得
 和
和 的混合气体共
的混合气体共 ,完全燃烧生成液态水时放热
,完全燃烧生成液态水时放热 ,则混合气体中
,则混合气体中 和
和 的体积比是
的体积比是(4)当反应②中转移10mol电子时,燃烧的丙烷
 的质量是
的质量是
您最近一年使用:0次
填空题
|
较易
(0.85)
名校
【推荐2】25℃、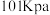 、
、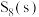 和
和 发生反应依次转化为
发生反应依次转化为 和
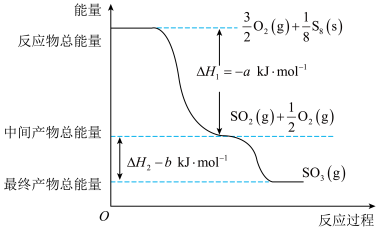
和 。反应过程和能量关系可用如图简单表示(图中的
。反应过程和能量关系可用如图简单表示(图中的 表示生成
表示生成 产物的数据),已知:
产物的数据),已知:
①
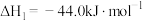 ;
;
②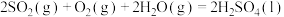
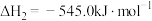 ;
;
(1)结合能量图,书写 与
与 反应生成
反应生成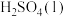 的热化学方程式是
的热化学方程式是___________ 。
(2)计算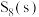 的燃烧热值为
的燃烧热值为___________ 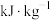 。
。
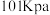 、
、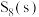 和
和 发生反应依次转化为
发生反应依次转化为 和
和 。反应过程和能量关系可用如图简单表示(图中的
。反应过程和能量关系可用如图简单表示(图中的 表示生成
表示生成 产物的数据),已知:
产物的数据),已知:
①

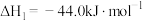 ;
;②
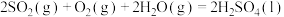
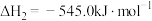 ;
;(1)结合能量图,书写
 与
与 反应生成
反应生成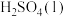 的热化学方程式是
的热化学方程式是(2)计算
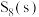 的燃烧热值为
的燃烧热值为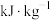 。
。
您最近一年使用:0次
填空题
|
较易
(0.85)
名校
解题方法
【推荐3】我国正式公布实现碳达峰、碳中和的时间和目标后,使含碳化合物的综合利用更受关注和重视。回答下列问题:
(1)通过 插入单氢钌配合物反应可制备甲酸盐。我国学者结合实验和计算机模拟结果,研究了在无水体系和有水体系中形成甲酸盐中间体的反应历程,如图1所示(TS表示过渡态):
插入单氢钌配合物反应可制备甲酸盐。我国学者结合实验和计算机模拟结果,研究了在无水体系和有水体系中形成甲酸盐中间体的反应历程,如图1所示(TS表示过渡态):

下列说法正确的是_______(填选项字母)。
(2)二氧化碳与氢气重整体系中涉及的主要反应如下:
Ⅰ. ;
;
Ⅱ. 。
。
①二氧化碳与甲烷反应生成一氧化碳和氢气的热化学方程式为_______ ;恒温恒容密闭容器中进行该反应,下列事实能说明反应达到平衡状态的是_______ (填选项字母)。
A. 与
与 的有效碰撞几率不变
的有效碰撞几率不变
B.相同时间内形成C-H键和H-H键的数目相等
C.混合气体的密度不再改变
D.氢原子数不再改变
②一定温度下,向10L恒容密闭容器中充入 和
和 ,发生反应Ⅰ和反应Ⅱ,5min末达到平衡时测得
,发生反应Ⅰ和反应Ⅱ,5min末达到平衡时测得 的转化率为50%,
的转化率为50%, 与CO的分压之比为1∶4,
与CO的分压之比为1∶4, 的分压为p0。则
的分压为p0。则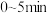 内,平均反应速率
内,平均反应速率
_______  ;反应Ⅱ的平衡常数Kp=
;反应Ⅱ的平衡常数Kp=_______ (Kp是用分压表示的平衡常数)。
③向恒容密闭容器中以物质的量之比为1∶4充入 和
和 ,发生反应Ⅰ和反应Ⅱ,实验测得平衡体系中各组分的体积分数与温度的关系如图2所示。其中表示
,发生反应Ⅰ和反应Ⅱ,实验测得平衡体系中各组分的体积分数与温度的关系如图2所示。其中表示 的体积分数与温度关系的曲线为
的体积分数与温度关系的曲线为_______ (填“L1”“L2”或“L3”);T1℃之后, 平衡体积分数随温度的变化程度小于
平衡体积分数随温度的变化程度小于 平衡体积分数随温度的变化程度,原因为
平衡体积分数随温度的变化程度,原因为_______ ;T1℃时CO的平衡分压_______ (填“>”“<”或“=”) T2℃时CO的平衡分压,理由为_______ 。

(1)通过
 插入单氢钌配合物反应可制备甲酸盐。我国学者结合实验和计算机模拟结果,研究了在无水体系和有水体系中形成甲酸盐中间体的反应历程,如图1所示(TS表示过渡态):
插入单氢钌配合物反应可制备甲酸盐。我国学者结合实验和计算机模拟结果,研究了在无水体系和有水体系中形成甲酸盐中间体的反应历程,如图1所示(TS表示过渡态):
下列说法正确的是_______(填选项字母)。
| A.水分子对插入反应有促进作用 |
| B.稳定性:TS>TS′ |
| C.无水体系中反应的活化能为127.9kJ/mol |
| D.两个体系中均存在极性键的断裂和形成 |
Ⅰ.
 ;
;Ⅱ.
 。
。①二氧化碳与甲烷反应生成一氧化碳和氢气的热化学方程式为
A.
 与
与 的有效碰撞几率不变
的有效碰撞几率不变B.相同时间内形成C-H键和H-H键的数目相等
C.混合气体的密度不再改变
D.氢原子数不再改变
②一定温度下,向10L恒容密闭容器中充入
 和
和 ,发生反应Ⅰ和反应Ⅱ,5min末达到平衡时测得
,发生反应Ⅰ和反应Ⅱ,5min末达到平衡时测得 的转化率为50%,
的转化率为50%, 与CO的分压之比为1∶4,
与CO的分压之比为1∶4, 的分压为p0。则
的分压为p0。则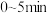 内,平均反应速率
内,平均反应速率
 ;反应Ⅱ的平衡常数Kp=
;反应Ⅱ的平衡常数Kp=③向恒容密闭容器中以物质的量之比为1∶4充入
 和
和 ,发生反应Ⅰ和反应Ⅱ,实验测得平衡体系中各组分的体积分数与温度的关系如图2所示。其中表示
,发生反应Ⅰ和反应Ⅱ,实验测得平衡体系中各组分的体积分数与温度的关系如图2所示。其中表示 的体积分数与温度关系的曲线为
的体积分数与温度关系的曲线为 平衡体积分数随温度的变化程度小于
平衡体积分数随温度的变化程度小于 平衡体积分数随温度的变化程度,原因为
平衡体积分数随温度的变化程度,原因为
您最近一年使用:0次
填空题
|
较易
(0.85)
【推荐1】催化还原CO2是解决温室效应及能源问题的重要手段之一。研究表明,在Cu/ZnO催化剂存在下,CO2和H2可发生两个平行反应,分别生成CH3OH和CO。反应的热化学方程式如下:
CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)ΔH1=-53.7kJ·mol-1 I
CO2(g)+H2(g)⇌CO(g)+H2O(g)ΔH2 II
已知:①CO和H2的标准燃烧热分别为-283.0kJ·mol-1和-285.8kJ·mol-1
②H2O(l)=H2O(g)ΔH3=44.0kJ·mol-1
反应II的ΔH2=_______ kJ·mol-1。
CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)ΔH1=-53.7kJ·mol-1 I
CO2(g)+H2(g)⇌CO(g)+H2O(g)ΔH2 II
已知:①CO和H2的标准燃烧热分别为-283.0kJ·mol-1和-285.8kJ·mol-1
②H2O(l)=H2O(g)ΔH3=44.0kJ·mol-1
反应II的ΔH2=
您最近一年使用:0次
填空题
|
较易
(0.85)
名校
解题方法
【推荐2】工业上,裂解丁烷可以获得乙烯、丙烯等化工原料。
反应1:C4H10(g,正丁烷) CH4(g)+C3H6(g) △H1
CH4(g)+C3H6(g) △H1
反应2:C4H10(g,正丁烷) C2H6(g)+C2H4(g) △H2
C2H6(g)+C2H4(g) △H2
已知几种烃的燃烧热如下:
回答下列问题:
(1)根据上述数据计算,△H1=___ kJ∙mol−1。
(2)稳定性:正丁烷___ 异丁烷(填“大于”“小于”或“等于”)。
(3)在密闭容器中投入一定量的正丁烷,发生上述反应1和2,测定丁烷的平衡转化率(α)与压强(p)、温度(T)关系如图所示。

①在相同压强下,升高温度,丁烷的平衡转化率增大的原因是___ 。
②比较压强大小:p1___ p2___ p3(填“>”“<”或“=”)。
(4)某温度下,向2L恒容密闭容器中投入2mol正丁烷.假设控制反应条件,只发生反应1,达到平衡时测得CH4的体积分数为 。
。
①下列情况表明上述反应达到平衡的是___ (填字母,双选)。
A.混合气体的密度保持不变 B.甲烷、丙烯的生成速率相等
C.混合气体压强保持不变 D.丙烯体积分数保持不变
②该温度下,反应1的平衡常数K=___ 。
反应1:C4H10(g,正丁烷)
 CH4(g)+C3H6(g) △H1
CH4(g)+C3H6(g) △H1反应2:C4H10(g,正丁烷)
 C2H6(g)+C2H4(g) △H2
C2H6(g)+C2H4(g) △H2已知几种烃的燃烧热如下:
| 烃 | 正丁烷 | 异丁烷 | 甲烷 | 乙烷 | 乙烯 | 丙烯 |
| 燃烧热(△H)/( kJ∙mol−1) | −2878 | −2869 | −890.3 | −1559.8 | −1411 | −2058.3 |
回答下列问题:
(1)根据上述数据计算,△H1=
(2)稳定性:正丁烷
(3)在密闭容器中投入一定量的正丁烷,发生上述反应1和2,测定丁烷的平衡转化率(α)与压强(p)、温度(T)关系如图所示。

①在相同压强下,升高温度,丁烷的平衡转化率增大的原因是
②比较压强大小:p1
(4)某温度下,向2L恒容密闭容器中投入2mol正丁烷.假设控制反应条件,只发生反应1,达到平衡时测得CH4的体积分数为
 。
。①下列情况表明上述反应达到平衡的是
A.混合气体的密度保持不变 B.甲烷、丙烯的生成速率相等
C.混合气体压强保持不变 D.丙烯体积分数保持不变
②该温度下,反应1的平衡常数K=
您最近一年使用:0次
填空题
|
较易
(0.85)
解题方法
【推荐3】以CO2、H2为原料合成CH3OH涉及的主要反应如下:
I.CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H1=-49.5kJ·mol-1
CH3OH(g)+H2O(g) △H1=-49.5kJ·mol-1
II.CO(g)+2H2(g) CH3OH(g) △H2=-90.4kJ·mol-1
CH3OH(g) △H2=-90.4kJ·mol-1
III.CO2(g)+H2(g)=CO(g)+H2O(g) △H3
△H3=_____ kJ·mol-1。
(2)乙烷在一定条件可发生如下反应:C2H6(g)=C2H4(g)+H2(g) △H1,相关物质的燃烧热数据如表所示:
△H1=______ kJ·mol-1。
I.CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) △H1=-49.5kJ·mol-1
CH3OH(g)+H2O(g) △H1=-49.5kJ·mol-1II.CO(g)+2H2(g)
 CH3OH(g) △H2=-90.4kJ·mol-1
CH3OH(g) △H2=-90.4kJ·mol-1III.CO2(g)+H2(g)=CO(g)+H2O(g) △H3
△H3=
(2)乙烷在一定条件可发生如下反应:C2H6(g)=C2H4(g)+H2(g) △H1,相关物质的燃烧热数据如表所示:
| 物质 | C2H6(g) | C2H4(g) | H2(g) |
| 燃烧热△H/(kJ·mol-1) | -1560 | -1411 | -286 |
△H1=
您最近一年使用:0次
填空题
|
较易
(0.85)
【推荐1】在火箭推进器中装有还原剂肼(N2H4)和强氧化剂H2O2,当它们混合时,即产生大量的氮气和水蒸气,并放出大量的热。已知0.4 mol 液态肼和足量液态H2O2反应生成氮气和水蒸气时放出256.64 kJ的热量。
(1)写出液态肼和液态H2O2反应的热化学方程式_________________________________ 。
(2)已知H2O(l)=== H2O(g);△H=+44kJ/mol,则16 g液态肼与足量液态H2O2反应生成氮气和液态水时,放出的热量是_____________________ 。
(3)上述反应应用于火箭推进器,除释放出大量热量和快速产生大量气体外,还有一个很突出的优点是_________________________ 。
(1)写出液态肼和液态H2O2反应的热化学方程式
(2)已知H2O(l)=== H2O(g);△H=+44kJ/mol,则16 g液态肼与足量液态H2O2反应生成氮气和液态水时,放出的热量是
(3)上述反应应用于火箭推进器,除释放出大量热量和快速产生大量气体外,还有一个很突出的优点是
您最近一年使用:0次
填空题
|
较易
(0.85)
名校
解题方法
【推荐2】一般在火箭推进器中装有还原剂肼( )和强氧化剂
)和强氧化剂 ,当它们混合时,即产生大量的氮气和水蒸气,并放出大量的热。已知
,当它们混合时,即产生大量的氮气和水蒸气,并放出大量的热。已知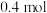 液态肼和足量
液态肼和足量 反应生成氮气和水蒸气时放出
反应生成氮气和水蒸气时放出 的热量。
的热量。
(1)写出液态肼和 反应生成氮气和水蒸气的热化学方程式:
反应生成氮气和水蒸气的热化学方程式:_________ 。
(2)已知 则
则 液态肼与足量
液态肼与足量 反应生成氮气和液态水时,放出的热量是
反应生成氮气和液态水时,放出的热量是____________ 。
(3)上述反应应用于火箭推进器时,除释放出大量热量和快速产生大量气体外,还有一个很突出的优点是__________ 。
(4)向次氯酸钠溶液中通入一定物质的量的氨气可生成肼,写出该反应的离子方程式:________ ,该反应的还原产物是________________ 。
 )和强氧化剂
)和强氧化剂 ,当它们混合时,即产生大量的氮气和水蒸气,并放出大量的热。已知
,当它们混合时,即产生大量的氮气和水蒸气,并放出大量的热。已知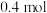 液态肼和足量
液态肼和足量 反应生成氮气和水蒸气时放出
反应生成氮气和水蒸气时放出 的热量。
的热量。(1)写出液态肼和
 反应生成氮气和水蒸气的热化学方程式:
反应生成氮气和水蒸气的热化学方程式:(2)已知
 则
则 液态肼与足量
液态肼与足量 反应生成氮气和液态水时,放出的热量是
反应生成氮气和液态水时,放出的热量是(3)上述反应应用于火箭推进器时,除释放出大量热量和快速产生大量气体外,还有一个很突出的优点是
(4)向次氯酸钠溶液中通入一定物质的量的氨气可生成肼,写出该反应的离子方程式:
您最近一年使用:0次
填空题
|
较易
(0.85)
解题方法
【推荐3】氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。
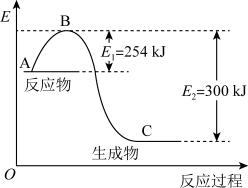
(1)如图是 和
和 反应生成
反应生成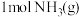 过程中能量的变化示意图,该化学反应属于
过程中能量的变化示意图,该化学反应属于___________ (放热或吸热)反应,正反应的活化能为___________ ,写出该反应的热化学方程式:___________ 。
(2)上述反应用到的氢气是一种清洁燃料,已知氢气的燃烧热为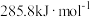 ,请写出氢气燃烧热的热化学方程式:
,请写出氢气燃烧热的热化学方程式:________ 。已知 转化成
转化成 吸收
吸收 的热量,
的热量,________ 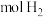 完全燃烧生成气态水可以放出
完全燃烧生成气态水可以放出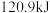 的热量(不可虑热量损失)。
的热量(不可虑热量损失)。

(1)如图是
 和
和 反应生成
反应生成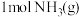 过程中能量的变化示意图,该化学反应属于
过程中能量的变化示意图,该化学反应属于(2)上述反应用到的氢气是一种清洁燃料,已知氢气的燃烧热为
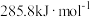 ,请写出氢气燃烧热的热化学方程式:
,请写出氢气燃烧热的热化学方程式: 转化成
转化成 吸收
吸收 的热量,
的热量,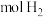 完全燃烧生成气态水可以放出
完全燃烧生成气态水可以放出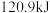 的热量(不可虑热量损失)。
的热量(不可虑热量损失)。
您最近一年使用:0次



