Ⅰ.温度为T时,某容积为 的密闭容器内,A、B两种气态物质的物质的量随时间变化的曲线如图所示,回答下列问题:
的密闭容器内,A、B两种气态物质的物质的量随时间变化的曲线如图所示,回答下列问题:
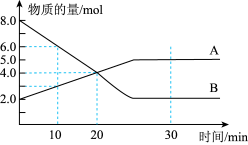
(1)该反应的化学方程式为___________ 。
(2)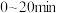 ,用B表示的平均反应速率
,用B表示的平均反应速率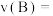
___________  。
。
(3)下列措施能增大反应速率的是___________(填字母)。
Ⅱ.纸电池是未来电池发展的重要研究方向。某学生在课外活动时,根据如图纸电池结构示意图,利用实验室中的稀硫酸、蒸馏水和滤纸制作电解液,用铜片与镁片作为电极材料。

(4)电池工作时 向
向___________ (填a或b)极作定向移动。
(5)某学生用硫酸铜溶液替代稀硫酸,正极发生的电极反应式为___________ 。
 的密闭容器内,A、B两种气态物质的物质的量随时间变化的曲线如图所示,回答下列问题:
的密闭容器内,A、B两种气态物质的物质的量随时间变化的曲线如图所示,回答下列问题:
(1)该反应的化学方程式为
(2)
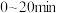 ,用B表示的平均反应速率
,用B表示的平均反应速率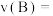
 。
。(3)下列措施能增大反应速率的是___________(填字母)。
| A.升高温度 | B.减小A的浓度 |
| C.缩小容器体积 | D.恒温恒容条件下充入氦气 |
Ⅱ.纸电池是未来电池发展的重要研究方向。某学生在课外活动时,根据如图纸电池结构示意图,利用实验室中的稀硫酸、蒸馏水和滤纸制作电解液,用铜片与镁片作为电极材料。

(4)电池工作时
 向
向(5)某学生用硫酸铜溶液替代稀硫酸,正极发生的电极反应式为
22-23高一下·浙江·期中 查看更多[1]
(已下线)【2023】【高一下】【期中考】【源清】【高中化学】【刘尼尼收集】
更新时间:2023/05/12 11:22:02
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐1】氮及其化合物在工业生产等方面有重要的应用。工业合成氨是煤化工产业链中非常重要的一部分,发射卫星时可用肼(N2H4)作燃料。
(1)已知:17g NH3(g)在一定条件下分解生成N2(g)和H2(g),吸收46.1kJ的热量。则反应N2(g)+3H2(g)=2NH3(g) △H=_______________ kJ·mol-1
(2)在一定条件下,向容积为5L的恒容密闭容器中充入1mol N2、3molH2,10min后,测得容器内NH3为1mol,则用N2表示的平均反应速率为______________________ 。
(3)已知在298K时1g肼气体燃烧生成N2和水蒸气,放出16.7kJ的热量。下列热化学方程式书写正确的是__________ (填字母序号)
A.N2H4+O2=N2+2H2O △H=-534.4kJ·mol—1
B.N2H4(g)+O2(g)=N2(g)+2H2O(l) △H=-534.4kJ·mol—1
C.N2H4(g)+O2(g)=N2(g)+2H2O(g) △H=-534.4kJ·mol—1
D.N2H4(g)+O2(g)= N2(g)+2H2O(g) △H=-16.7kJ·mol—1
(4)N2H4、O2和KOH溶液组成的燃料电池生成水和氮气。
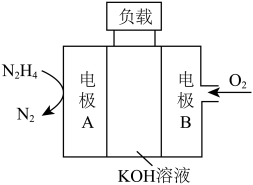
①负极反应式为_____________ 。
②放电时,溶液中的阴离子向_______ 极移动(填“正”或“负”)。
③放电时,正极区溶液的碱性___________ (填“增强”、“减弱”或“不变”)。
(1)已知:17g NH3(g)在一定条件下分解生成N2(g)和H2(g),吸收46.1kJ的热量。则反应N2(g)+3H2(g)=2NH3(g) △H=
(2)在一定条件下,向容积为5L的恒容密闭容器中充入1mol N2、3molH2,10min后,测得容器内NH3为1mol,则用N2表示的平均反应速率为
(3)已知在298K时1g肼气体燃烧生成N2和水蒸气,放出16.7kJ的热量。下列热化学方程式书写正确的是
A.N2H4+O2=N2+2H2O △H=-534.4kJ·mol—1
B.N2H4(g)+O2(g)=N2(g)+2H2O(l) △H=-534.4kJ·mol—1
C.N2H4(g)+O2(g)=N2(g)+2H2O(g) △H=-534.4kJ·mol—1
D.N2H4(g)+O2(g)= N2(g)+2H2O(g) △H=-16.7kJ·mol—1
(4)N2H4、O2和KOH溶液组成的燃料电池生成水和氮气。

①负极反应式为
②放电时,溶液中的阴离子向
③放电时,正极区溶液的碱性
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐2】中国政府承诺,到2020年,单位GDP二氧化碳排放比2005年下降40%~50%。CO2可转化成有机物实现碳循环。在体积为1L的密闭容器中,充入1molCO2和3molH2,一定条件下反应:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g),测得CO2和CH3OH(g)的浓度随时间变化如下图所示。
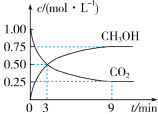
(1)从3min到9min,v(H2)=_______ 。
(2)能说明上述反应达到平衡状态的是_______(填编号)。
(3)平衡时CO2的转化率为_______ 。
(4)平衡时混合气体中CH3OH(g)的体积分数是_______ 。
(5)一定温度下,第9分钟时v逆(CH3OH)_______ (填“大于”、“小于”或“等于”)第3分钟时v正(CH3OH)。
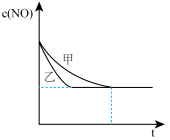
(6)如图所示,某同学在其它条件一定的情况下,分别用甲、乙两种催化剂完成该反应,绘出CO2浓度随时间变化关系如图所示,催化剂_______ 。(选填“甲”或“乙”)的催化效果更好。
(7)如图是银锌原电池装置的示意图,以硫酸铜为电解质溶液。可答下列问题:
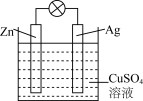
银电极上发生_______ 反应(“氧化”或“还原”),电极反应式为_______ ,电路中每转移1mol电子,理论上电解质溶液_______ (填“增加”或“减少”)质量_______ g。

(1)从3min到9min,v(H2)=
(2)能说明上述反应达到平衡状态的是_______(填编号)。
| A.反应中CO2与CH3OH的物质的量浓度之比为1:1(即图中交叉点) |
| B.混合气体的密度不随时间的变化而变化CO2 |
| C.单位时间内消耗3molH2,同时生成1molH₂O |
| D.CO2的体积分数在混合气体中保持不变 |
(4)平衡时混合气体中CH3OH(g)的体积分数是
(5)一定温度下,第9分钟时v逆(CH3OH)
(6)如图所示,某同学在其它条件一定的情况下,分别用甲、乙两种催化剂完成该反应,绘出CO2浓度随时间变化关系如图所示,催化剂

(7)如图是银锌原电池装置的示意图,以硫酸铜为电解质溶液。可答下列问题:

银电极上发生
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐3】甲醇(CH3OH)在化工生产中应用广泛。其中利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,可能发生的反应如下:
I.CO(g)+H2O(g)⇌CO2(g)+H2(g) ΔH1=-41.0kJ·mol-1
Ⅱ.CO(g)+2H2(g)⇌CH3OH(g) ΔH2=-90.0kJ·mol-1
Ⅲ.CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g) ΔH3
(1)ΔH3=___________ ,在上述制备甲醇的两个反应中,反应Ⅱ与反应Ⅲ比较,优点为___________ 。
(2)在一恒温恒容密闭容器中充入1molCO2和3molH2进行反应Ⅲ,测得CO2和CH3OH浓度随时间变化如下图所示。___________ v逆(填“<”、“>”或“=”)。0~10min内,用H2表示的平均反应速率v=___________ 。
(3)使用不同方法制得的Cu2O(Ⅰ)和Cu2O(Ⅱ)可用于CH3OH的催化脱氢:CH3OH(g)⇌HCHO(g)+H2(g)。在相同的密闭容器中,利用控制变量法进行实验,测得CH3OH的浓度c(mol·L-1)随时间t(min)的变化如下表:
可以判断:实验温度T1___________ T2(填“>”、“<”,下同);催化剂的催化效果Cu2O(Ⅰ)___________ Cu2O(Ⅱ)。
(4)CO与H2反应可制备CH3OH,由CH3OH和O2构成的质子交换膜燃料电池的结构示意如下图所示。电池总反应为2CH3OH+3O2=2CO2+4H2O,则c电极是___________ (填“正极”或“负极”),c电极的电极反应式为___________ 。若外电路中转移2mol电子,则上述燃料电池所消耗的O2在标准状况下的体积为___________ L。
I.CO(g)+H2O(g)⇌CO2(g)+H2(g) ΔH1=-41.0kJ·mol-1
Ⅱ.CO(g)+2H2(g)⇌CH3OH(g) ΔH2=-90.0kJ·mol-1
Ⅲ.CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g) ΔH3
(1)ΔH3=
(2)在一恒温恒容密闭容器中充入1molCO2和3molH2进行反应Ⅲ,测得CO2和CH3OH浓度随时间变化如下图所示。

(3)使用不同方法制得的Cu2O(Ⅰ)和Cu2O(Ⅱ)可用于CH3OH的催化脱氢:CH3OH(g)⇌HCHO(g)+H2(g)。在相同的密闭容器中,利用控制变量法进行实验,测得CH3OH的浓度c(mol·L-1)随时间t(min)的变化如下表:
| 序号 | 温度 | 催化剂 | 0 | 10 | 20 | 30 | 40 | 50 |
| ① | T1 | Cu2O(Ⅰ) | 0.050 | 0.0492 | 0.0486 | 0.0482 | 0.0480 | 0.0480 |
| ② | T1 | Cu2O(Ⅱ) | 0.050 | 0.0490 | 0.0483 | 0.0480 | 0.0480 | 0.0480 |
| ③ | T2 | Cu2O(Ⅲ) | 0.050 | 0.044 | 0.040 | 0.040 | 0.040 | 0.040 |
(4)CO与H2反应可制备CH3OH,由CH3OH和O2构成的质子交换膜燃料电池的结构示意如下图所示。电池总反应为2CH3OH+3O2=2CO2+4H2O,则c电极是

您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐1】已知锌与稀盐酸反应放热,某学生为了探究反应过程中的速率变化,用排水集气法收集反应放出的氢气。所用稀盐酸浓度有 、
、 两种浓度,每次实验稀盐酸的用量为
两种浓度,每次实验稀盐酸的用量为 ,锌有细颗粒与粗颗粒两种规格,用量为
,锌有细颗粒与粗颗粒两种规格,用量为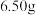 。实验温度为
。实验温度为 、
、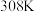 。
。
(1)完成以下实验设计(填写表格中空白项),并在实验目的一栏中填出对应的实验编号:
(2)实验①记录如下(换算成标况):
①计算在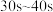 范围内盐酸的平均反应速率
范围内盐酸的平均反应速率
_______ (忽略溶液体积变化)。
②反应速率最大的时间段(如 )为
)为_______ ,可能原因是_______ ;
(3)另一学生也做同样的实验,由于反应太快,测量氢气的体积时不好控制,事先在盐酸溶液中分别加入等体积的下列溶液以减慢反应速率,在不影响产生气体总量的情况下,你认为他选择的溶液可以是_______(填相应字母);
(4)某化学研究小组的同学为比较 和
和 对
对 分解的催化效果,设计了图所示的实验。
分解的催化效果,设计了图所示的实验。
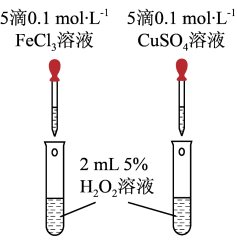
①如图可通过观察_______ 现象,比较得出比较 和
和 对
对 分解的催化效果结论。
分解的催化效果结论。
②该实验存在明显不合理的地方,你认为不合理的地方是_______ 。
 、
、 两种浓度,每次实验稀盐酸的用量为
两种浓度,每次实验稀盐酸的用量为 ,锌有细颗粒与粗颗粒两种规格,用量为
,锌有细颗粒与粗颗粒两种规格,用量为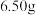 。实验温度为
。实验温度为 、
、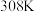 。
。(1)完成以下实验设计(填写表格中空白项),并在实验目的一栏中填出对应的实验编号:
| 编号 |  | 锌规格 | 盐酸浓度/ | 实验目的 |
| ① | 298 | 粗颗粒 | 2.00 | (Ⅰ)实验①和②探究盐酸浓度对该反应速率的影响; (Ⅱ)实验①和 (Ⅲ)实验①和实验④探究锌规格(粗、细)对该反应速率的影响。 |
| ② | 298 | 粗颗粒 | 1.00 | |
| ③ | 308 | 粗颗粒 | 2.00 | |
| ④ | 298 | 细颗粒 | 2.00 |
| 时间(s) | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 | 100 |
氢气体积( ) ) | 16.8 | 39.2 | 67.2 | 224 | 420 | 492.8 | 520.8 | 543.2 | 554.4 | 560 |
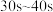 范围内盐酸的平均反应速率
范围内盐酸的平均反应速率
②反应速率最大的时间段(如
 )为
)为(3)另一学生也做同样的实验,由于反应太快,测量氢气的体积时不好控制,事先在盐酸溶液中分别加入等体积的下列溶液以减慢反应速率,在不影响产生气体总量的情况下,你认为他选择的溶液可以是_______(填相应字母);
A. 溶液 溶液 | B. 溶液 溶液 | C. 溶液 溶液 | D. |
 和
和 对
对 分解的催化效果,设计了图所示的实验。
分解的催化效果,设计了图所示的实验。
①如图可通过观察
 和
和 对
对 分解的催化效果结论。
分解的催化效果结论。②该实验存在明显不合理的地方,你认为不合理的地方是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐2】为了探究外界条件对过氧化氢分解速率的影响,某化学兴趣小组的同学做了以下实验。请回答下列问题:
(1)实验①的目的是其它条件相同时,探究______ 条件对H2O2分解速率的影响。
(2)实验②未观察到预期的实验现象,为了帮助该组同学达到实验目的,请你用实验中所提供的几种试剂,对上述操作进行的改进是____________________________________ 。
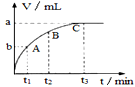
(3)某同学在50mL一定浓度的H2O2溶液中加入适量的二氧化锰,放出气体的体积(标准状况下)与反应时间的关系如图所示,则A、B、C三点所表示的瞬时反应速率最慢的是____ (填字母代号)。
(4)对于H2O2分解反应,Cu2+也有一定的催化作用。为比较Fe3+和Cu2+对H2O2分解的催化效果,该化学兴趣小组的同学分别设计了如图甲、乙所示的实验。请回答相关问题:
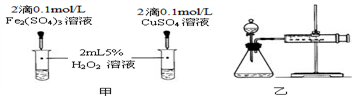
①定性分析:如图甲可通过观察________________________ ,定性比较得出结论;该实验中将FeCl3溶液改为Fe2(SO4)3溶液的原因是______________________ 。
②定量分析:用图乙所示装置做对照试验,实验时均以3min时间为准,其它可能影响实验的因素均已忽略。实验中需要测量的数据是________________ ,所需仪器为_______ 。
(5)通过对上述实验过程的分析,在实验设计时,要考虑_________ 思想方法的应用。
| 编号 | 实验操作 | 实验现象 |
| ① | 分别在试管A、B中加入5mL5%H2O2溶液,各滴入2滴1mol/LFeCl3溶液。待试管中均有适量气泡出现时,将试管A放入盛有5℃左右冷水的烧杯中浸泡;将试管B放入盛有40℃左右热水的烧杯中浸泡。 | 试管A中不再产生气泡; 试管B中产生的气泡量增多。 |
| ② | 另取两支试管分别加入5mL5%H2O2溶液和5mL10%H2O2溶液。 | 两支试管中均未明显见到有气泡产生。 |
(1)实验①的目的是其它条件相同时,探究
(2)实验②未观察到预期的实验现象,为了帮助该组同学达到实验目的,请你用实验中所提供的几种试剂,对上述操作进行的改进是
(3)某同学在50mL一定浓度的H2O2溶液中加入适量的二氧化锰,放出气体的体积(标准状况下)与反应时间的关系如图所示,则A、B、C三点所表示的瞬时反应速率最慢的是

(4)对于H2O2分解反应,Cu2+也有一定的催化作用。为比较Fe3+和Cu2+对H2O2分解的催化效果,该化学兴趣小组的同学分别设计了如图甲、乙所示的实验。请回答相关问题:

①定性分析:如图甲可通过观察
②定量分析:用图乙所示装置做对照试验,实验时均以3min时间为准,其它可能影响实验的因素均已忽略。实验中需要测量的数据是
(5)通过对上述实验过程的分析,在实验设计时,要考虑
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐3】某同学在用稀硫酸与锌制取氢气的实验中,发现加入少量硫酸铜溶液可加快氢气的生成速率。请回答下列问题:
(1)上述实验中发生反应的化学方程式有______ ;
(2)硫酸铜溶液可以加快氢气生成速率的原因是_____ ;
(3)要加快上述实验中气体产生的速率,还可采取的措施有__________ 。
(4)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列实验。将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需时间。
①请完成此实验设计,其中:V1=___ ,V6=___ ,V9=___ ;
②反应一段时间后,实验A中的金属呈___ 色,实验E中的金属呈___ 色;
③该同学最后得出的结论为:当加入少量CuSO4溶液时,生成氢气的速率会大大提高。但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降。请分析氢气生成速率下降的主要原因____ 。
(1)上述实验中发生反应的化学方程式有
(2)硫酸铜溶液可以加快氢气生成速率的原因是
(3)要加快上述实验中气体产生的速率,还可采取的措施有
(4)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列实验。将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需时间。
| 实验 混合溶液 | A | B | C | D | E | F |
| 4 mol·L-1 H2SO4/mL | 30 | V1 | V2 | V3 | V4 | V5 |
| 饱和CuSO4溶液/mL | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
| H2O/mL | V7 | V8 | V9 | V10 | 10 | 0 |
①请完成此实验设计,其中:V1=
②反应一段时间后,实验A中的金属呈
③该同学最后得出的结论为:当加入少量CuSO4溶液时,生成氢气的速率会大大提高。但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降。请分析氢气生成速率下降的主要原因
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐1】I.在锌与某浓度的盐酸反应的实验中,实验员得到下面的结果:
(1)写出基态Zn2+的核外电子排布式:_____ ,该反应是_____ 反应(填“放热”或“吸热”);
(2)仔细观察A~F的实验数据对比,你可以得到关于温度影响反应速率结论,用此结论,计算:55℃时,2g锌薄片溶解于酸中需花_____ s。
II.某可逆反应在某体积为5 L的密闭容器中进行,在从0~4分钟各物质的量的变化情况如图所示(X、Y、Z均为气体)。
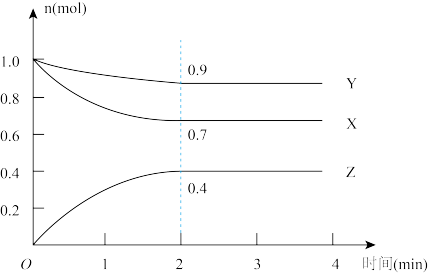
(3)该反应的的化学方程式为__________________ ;
(4)反应开始至2分钟时,X的平均反应速率为__ ;
(5)能说明该反应已达到平衡状态的是_________ ;
a.每消耗1molX,同时生成1.33molZ b.容器内压强保持不变
c.Z的浓度不再变化 d.容器内混合气体的密度保持不变
(6)由下图求得平衡时Y的转化率为__________________ 。
(7)若保持容器体积不变,充入He,容器内反应速率将_______ 。(填“增大”“减小”或“不变”)
锌的质量(g) | 锌的形状 | 温度(℃) | 溶解于酸花的时间(s) | |
A | 2 | 薄片 | 5 | 400 |
B | 2 | 薄片 | 15 | 200 |
C | 2 | 薄片 | 25 | 100 |
D | 2 | 薄片 | 35 | 50 |
E | 2 | 薄片 | 45 | 25 |
F | 2 | 粉末 | 15 | 5 |
(1)写出基态Zn2+的核外电子排布式:
(2)仔细观察A~F的实验数据对比,你可以得到关于温度影响反应速率结论,用此结论,计算:55℃时,2g锌薄片溶解于酸中需花
II.某可逆反应在某体积为5 L的密闭容器中进行,在从0~4分钟各物质的量的变化情况如图所示(X、Y、Z均为气体)。

(3)该反应的的化学方程式为
(4)反应开始至2分钟时,X的平均反应速率为
(5)能说明该反应已达到平衡状态的是
a.每消耗1molX,同时生成1.33molZ b.容器内压强保持不变
c.Z的浓度不再变化 d.容器内混合气体的密度保持不变
(6)由下图求得平衡时Y的转化率为
(7)若保持容器体积不变,充入He,容器内反应速率将
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
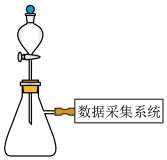
【推荐2】某实验小组利用压强传感器,数据采集器和计算机等数字化实验设备组成数据采集系统,探究外界条件对双氧水分解速率的影响。实验装置(下图)和所完成实验编号如下。请回答下列问题。
资料显示:通常情况下, 较稳定,不易分解。
较稳定,不易分解。
实验药品: ,热水、冰水。
,热水、冰水。
(1)用化学方程式表示实验原理_______ 。
(2)编号①和②的实验目的是_______ 。
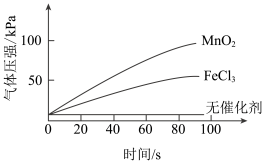
(3)编号③④⑤探究的是不同催化剂条件下双氧水的分解速率,实验结果如图所示。说明图中曲线的含义_______ 。结合实验条件,分析三条曲线的区别_______ 。
(4)模仿上述设计,完成“温度对化学反应速率的影响”的实验方案设计。
资料显示:通常情况下,
 较稳定,不易分解。
较稳定,不易分解。
实验药品:
 ,热水、冰水。
,热水、冰水。| 实验编号 | 实验药品 | 催化剂 |
| ① | 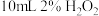 溶液 溶液 | 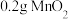 |
| ② | 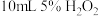 溶液 溶液 | 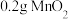 |
| ③ | 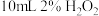 溶液 溶液 | 无催化剂 |
| ④ | 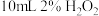 溶液 溶液 | 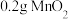 |
| ⑤ | 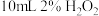 溶液 溶液 | 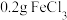 |
(2)编号①和②的实验目的是
(3)编号③④⑤探究的是不同催化剂条件下双氧水的分解速率,实验结果如图所示。说明图中曲线的含义

(4)模仿上述设计,完成“温度对化学反应速率的影响”的实验方案设计。
| 实验编号 | 实验药品 | 反应条件 |
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐3】课本永远是我们最重要的学习资料之一。以下是课本中出现的重要实验,请回答相关问题。
(一)实验室制备乙酸乙酯

(1)写出实验室制备乙酸乙酯的化学方程式___________ 。
(2)下列说法中,正确的是___________ (填字母序号)
a、反应试剂的添加顺序:在试管里加入浓硫酸,然后边振荡试管边慢慢加入乙醇和乙酸,再加入几片碎瓷片。
b、乙醇和乙酸乙酯在储存时应置于密闭容器,存放在阴凉、通风处,并与氧化剂等分开存放,注意远离火种和热源。
c、由于酯化反应是可逆反应,该条件下不能反应完全,因此在右边试管里收集到的乙酸乙酯里会混有乙酸和乙醇。
d、为了提高酯化反应的速率,一般需要加热,并加入浓硫酸等催化剂,且浓硫酸可以吸水,起到促进反应正向进行的作用。
e、若乙酸乙酯中混有少量乙醇,可以加入适量的乙酸和浓硫酸,小心加热,充分反应,以除去乙醇。
f、反应前在碳酸钠溶液中加1~2滴酚酞,溶液变成红色,实验后振荡试管,没有气泡,溶液红色消失,说明一定是挥发出的乙酸蒸气消耗了碳酸钠。
(二)中和反应反应热的测定
(3)用50mL0.50mol·L-1的盐酸与50mL0.55mol·L-1的NaOH溶液做此实验。已知反应后生成的溶液的比热容c≈4.18J/(g·℃),反应前后体系的温度差为△t℃。若计算出该反应放出的热量为1.43kJ,则温度差△t=___________ ℃。(为简便起见,计算结果保留一位小数)
(4)结合上题的数据,写出生成1molH2O(l)的热化学方程式___________ 。
(三)定性与定量研究影响化学反应速率的因素
(5)写出硫代硫酸钠溶液与稀硫酸反应的离子方程式___________ 。
(6)若要研究温度对化学反应速率的影响,实验步骤如下:①取两支试管各加入2mL0.1mol/L的硫代硫酸钠溶液,另取两支试管各加入2mL0.1mol/L的稀硫酸;②将四支试管分成两组(各有一支盛有硫代硫酸钠溶液和稀硫酸的试管);③___________ (填字母序号);④记录出现浑浊的时间。
A.一组放入冷水中,另一组放入热水中,一段时间后,分别混合并振荡均匀
B.分别混合并振荡均匀,然后迅速将一组放入冷水中,另一组放入热水中
(四)探究影响化学平衡移动的因素
在CuCl2溶液中存在如下平衡:[Cu(H2O)4]2+(蓝色)+4Cl-⇌[CuCl4]2-(黄色)+4H2O △H>0
(7)写出该反应的平衡常数表达式___________ 。
(8)对CuCl2溶液进行如下操作,平衡正向移动的有___________(填字母序号)
(一)实验室制备乙酸乙酯

(1)写出实验室制备乙酸乙酯的化学方程式
(2)下列说法中,正确的是
a、反应试剂的添加顺序:在试管里加入浓硫酸,然后边振荡试管边慢慢加入乙醇和乙酸,再加入几片碎瓷片。
b、乙醇和乙酸乙酯在储存时应置于密闭容器,存放在阴凉、通风处,并与氧化剂等分开存放,注意远离火种和热源。
c、由于酯化反应是可逆反应,该条件下不能反应完全,因此在右边试管里收集到的乙酸乙酯里会混有乙酸和乙醇。
d、为了提高酯化反应的速率,一般需要加热,并加入浓硫酸等催化剂,且浓硫酸可以吸水,起到促进反应正向进行的作用。
e、若乙酸乙酯中混有少量乙醇,可以加入适量的乙酸和浓硫酸,小心加热,充分反应,以除去乙醇。
f、反应前在碳酸钠溶液中加1~2滴酚酞,溶液变成红色,实验后振荡试管,没有气泡,溶液红色消失,说明一定是挥发出的乙酸蒸气消耗了碳酸钠。
(二)中和反应反应热的测定
(3)用50mL0.50mol·L-1的盐酸与50mL0.55mol·L-1的NaOH溶液做此实验。已知反应后生成的溶液的比热容c≈4.18J/(g·℃),反应前后体系的温度差为△t℃。若计算出该反应放出的热量为1.43kJ,则温度差△t=
(4)结合上题的数据,写出生成1molH2O(l)的热化学方程式
(三)定性与定量研究影响化学反应速率的因素
(5)写出硫代硫酸钠溶液与稀硫酸反应的离子方程式
(6)若要研究温度对化学反应速率的影响,实验步骤如下:①取两支试管各加入2mL0.1mol/L的硫代硫酸钠溶液,另取两支试管各加入2mL0.1mol/L的稀硫酸;②将四支试管分成两组(各有一支盛有硫代硫酸钠溶液和稀硫酸的试管);③
A.一组放入冷水中,另一组放入热水中,一段时间后,分别混合并振荡均匀
B.分别混合并振荡均匀,然后迅速将一组放入冷水中,另一组放入热水中
(四)探究影响化学平衡移动的因素
在CuCl2溶液中存在如下平衡:[Cu(H2O)4]2+(蓝色)+4Cl-⇌[CuCl4]2-(黄色)+4H2O △H>0
(7)写出该反应的平衡常数表达式
(8)对CuCl2溶液进行如下操作,平衡正向移动的有___________(填字母序号)
| A.加热 | B.加水稀释 |
| C.滴加少量AgNO3溶液 | D.加入少量CuCl2固体 |
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐1】I.在一定温度下,体积为2 L的密闭容器中,NO2和N2O4之间发生反应:2NO2(g) (红棕色) N2O4(无色),反应过程中各组分的物质的量随时间变化如图所示。回答下列问题:
N2O4(无色),反应过程中各组分的物质的量随时间变化如图所示。回答下列问题:
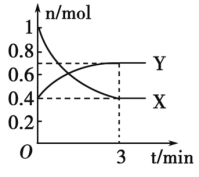
(1)曲线_______ (填“X”或“Y”)表示NO2的物质的量随时间的变化曲线。
(2)下列叙述能说明该反应已达到化学平衡状态的是_______ (填写序号)。
A.容器内气体的总物质的量不再发生变化
B.容器内NO2的体积分数不再发生变化
C.v(NO2)=2v(N2O4)
D.c(NO2):c(N2O4)=2:1
E.容器内NO2消耗速率与生成速率相等
(3)4 min时若降低温度,则v(正)_______ ,v(逆)_______ (填“增大”、“减小”或“不变”);此时容器内气体颜色变浅,说明该反应为_______ (填“吸热”或“放热”)反应。
(4)若上述反应保持初始物质的量不变,容器体积改为1 L,则达到平衡所用时间_______ (填“>”、“<”或“=”)3 min,反应达到平衡时,此时反应进行的限度_______ (填“>”、“<”或“=”)容器体积为2 L时反应进行的限度。
II.氢氧燃料电池具有无污染、无噪音、高效率的特点。如图为氢氧燃料电池的结构示意图,回答下列问题:
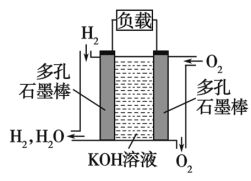
(5)O2进入的电极为_______ (填“正极”或“负极”),其电极反应式为_______ 。
(6)电池工作时,溶液中的OH-向_______ (填“正极”或“负极”)迁移。
(7)若电池工作时转移0.04 mol电子,理论上消耗标准状况下H2_______ mL。
 N2O4(无色),反应过程中各组分的物质的量随时间变化如图所示。回答下列问题:
N2O4(无色),反应过程中各组分的物质的量随时间变化如图所示。回答下列问题:
(1)曲线
(2)下列叙述能说明该反应已达到化学平衡状态的是
A.容器内气体的总物质的量不再发生变化
B.容器内NO2的体积分数不再发生变化
C.v(NO2)=2v(N2O4)
D.c(NO2):c(N2O4)=2:1
E.容器内NO2消耗速率与生成速率相等
(3)4 min时若降低温度,则v(正)
(4)若上述反应保持初始物质的量不变,容器体积改为1 L,则达到平衡所用时间
II.氢氧燃料电池具有无污染、无噪音、高效率的特点。如图为氢氧燃料电池的结构示意图,回答下列问题:

(5)O2进入的电极为
(6)电池工作时,溶液中的OH-向
(7)若电池工作时转移0.04 mol电子,理论上消耗标准状况下H2
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐2】Ⅰ.在1.0 L密闭容器中放入0.10molA(g),在一定温度进行如下反应:A(g) 2B(g)+C(g)+D(s) △H= +85.1kJ·mol-1,容器内气体总压强(P)与起始压强P0的比值随反应时间(t)数据见下表:
2B(g)+C(g)+D(s) △H= +85.1kJ·mol-1,容器内气体总压强(P)与起始压强P0的比值随反应时间(t)数据见下表:
回答下列问题:
(1)下列能提高A的转化率的是____ 。
A 升高温度 B 体系中通入A气体
C 将D的浓度减小 D 通入稀有气体He,使体系压强增大到原来的5倍
E 若体系中的C为HCl,其它物质均难溶于水,滴入少许水
(2)该反应的平衡常数表达式K=___ ;前2小时C的反应速率是____ ;计算平衡时A的转化率_____ 。
(3)若将容器改为恒压容器,改变条件,使反应达到与上述相同的转化率,则达到平衡时B浓度为____ 。(保留两位有效数字)
Ⅱ.锂的化合物用途广泛。Li3N是非常有前途的储氢材料;LiFePO4、Li2FeSiO4等可以作为电池的正极材料。请回答下列问题:
(4)氮化锂在氢气中加热时可得到氨基锂(LiNH2),其反应的化学方程式为:Li3N+2H2 LiNH2+2LiH,在270℃时,该反应可逆向发生放出H2,因而氮化锂可作为储氢材料,储存氢气最多可达Li3N质量的
LiNH2+2LiH,在270℃时,该反应可逆向发生放出H2,因而氮化锂可作为储氢材料,储存氢气最多可达Li3N质量的____ %(精确到0.1%)。
(5)将Li2CO3、FeC2O4·2H2O和SiO2粉末均匀混合,在800℃的氩气中烧结6小时制得Li2FeSiO4,写出该反应的化学方程式______ 。
(6)磷酸亚铁锂电池稳定性高、安全、对环境友好,该电池在充放电过程中,发生LiFePO4与Li1-xFePO4之间的转化,电池放电时负极发生的反应为LiXC6-xe- =xLi++6C,写出电池放电时的化学方程式____ 。
 2B(g)+C(g)+D(s) △H= +85.1kJ·mol-1,容器内气体总压强(P)与起始压强P0的比值随反应时间(t)数据见下表:
2B(g)+C(g)+D(s) △H= +85.1kJ·mol-1,容器内气体总压强(P)与起始压强P0的比值随反应时间(t)数据见下表:| 时间t/ h | 0 | 1 | 2 | 4 | 8 | 16 | 20 | 25 |
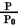 | 1.00 | 1.50 | 1.80 | 2.20 | 2.30 | 2.38 | 2.40 | 2.40 |
回答下列问题:
(1)下列能提高A的转化率的是
A 升高温度 B 体系中通入A气体
C 将D的浓度减小 D 通入稀有气体He,使体系压强增大到原来的5倍
E 若体系中的C为HCl,其它物质均难溶于水,滴入少许水
(2)该反应的平衡常数表达式K=
(3)若将容器改为恒压容器,改变条件,使反应达到与上述相同的转化率,则达到平衡时B浓度为
Ⅱ.锂的化合物用途广泛。Li3N是非常有前途的储氢材料;LiFePO4、Li2FeSiO4等可以作为电池的正极材料。请回答下列问题:
(4)氮化锂在氢气中加热时可得到氨基锂(LiNH2),其反应的化学方程式为:Li3N+2H2
 LiNH2+2LiH,在270℃时,该反应可逆向发生放出H2,因而氮化锂可作为储氢材料,储存氢气最多可达Li3N质量的
LiNH2+2LiH,在270℃时,该反应可逆向发生放出H2,因而氮化锂可作为储氢材料,储存氢气最多可达Li3N质量的(5)将Li2CO3、FeC2O4·2H2O和SiO2粉末均匀混合,在800℃的氩气中烧结6小时制得Li2FeSiO4,写出该反应的化学方程式
(6)磷酸亚铁锂电池稳定性高、安全、对环境友好,该电池在充放电过程中,发生LiFePO4与Li1-xFePO4之间的转化,电池放电时负极发生的反应为LiXC6-xe- =xLi++6C,写出电池放电时的化学方程式
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐3】I.某实验小组同学利用如图装置对电化学原理进行了一系列探究活动。
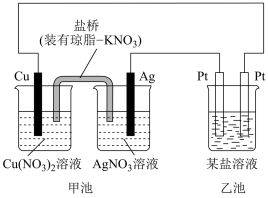
(1)甲池装置为_______ (填“原电池”或“电解池”)。
(2)甲池反应前两电极质量相等,一段时间后,两电极质量相差14g,导线中通过_______ mol电子。
(3)实验过程中,甲池左侧烧杯中 的浓度
的浓度_______ (填“增大”、“减小”或“不变”)。
(4)若乙池中溶液为足量的硝酸银溶液,工作一段时间后,若要使乙池中溶液恢复原浓度,可向溶液中加入_______ 。(填化学式)
(5)若把乙池改为精炼铜装置(粗铜含Al、Zn、Ag、Pt、Au等杂质),电解质溶液为 溶液,则下列说法正确的是_______。
溶液,则下列说法正确的是_______。
II.氯碱工业是高耗能产业,一种将电解池与燃料电池相组合的新工艺,节能超过30%,在此工艺中,物料传输和转化关系如图,其中电极未标出,所用离子交换膜只允许阳离子通过。

(6)电解池A中发生的电解化学方程式是_______ 。
(7)图中Y是_______ (填化学式),若电解产生11.2L(标准状况)该物质,则至少转移电子_______ mol;
(8)分析图可知:氢氧化钠的质量分数为a%、b%、c%,由大到小的顺序为_______ 。

(1)甲池装置为
(2)甲池反应前两电极质量相等,一段时间后,两电极质量相差14g,导线中通过
(3)实验过程中,甲池左侧烧杯中
 的浓度
的浓度(4)若乙池中溶液为足量的硝酸银溶液,工作一段时间后,若要使乙池中溶液恢复原浓度,可向溶液中加入
(5)若把乙池改为精炼铜装置(粗铜含Al、Zn、Ag、Pt、Au等杂质),电解质溶液为
 溶液,则下列说法正确的是_______。
溶液,则下列说法正确的是_______。| A.电解过程中,阳极减少的质量与阴极增加的质量相等 |
| B.乙池左侧电极为粗铜,发生氧化反应 |
C. 溶液的浓度保持不变 溶液的浓度保持不变 |
| D.杂质都将以单质的形式沉淀到池底 |
II.氯碱工业是高耗能产业,一种将电解池与燃料电池相组合的新工艺,节能超过30%,在此工艺中,物料传输和转化关系如图,其中电极未标出,所用离子交换膜只允许阳离子通过。

(6)电解池A中发生的电解化学方程式是
(7)图中Y是
(8)分析图可知:氢氧化钠的质量分数为a%、b%、c%,由大到小的顺序为
您最近一年使用:0次



