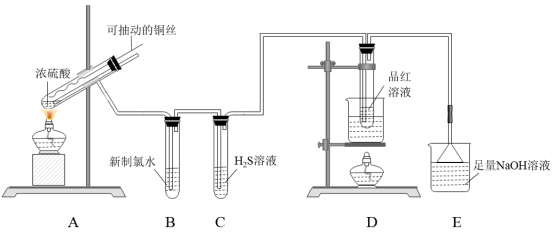
某研究性小组同学完成了下列任务。
任务一:探究铁与浓硫酸反应,设计了图1、图2所示装置进行实验。
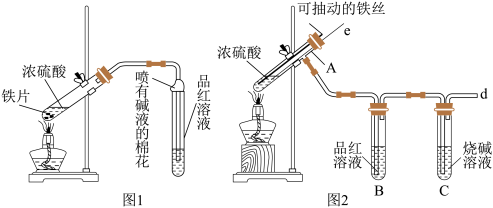
(1)比较两实验装置,图2装置的优点是:①能更好的吸收有毒气体SO2,防止其污染环境;②___________ 。
(2)导气管e有两个主要作用:一是在反应过程中,因导管插入液面下,可起到“液封”作用阻止SO2气体逸出而防止污染环境;二是___________ 。
(3)能说明图2有SO2气体产生的实验现象是___________ 。
(4)反应一段时间后,用滴管吸取(图2)A试管中的溶液滴入适量水中,其中所含金属离子的成分有三种可能:
I:只含有Fe3+;II:只含有Fe2+;III:既有Fe3+又有Fe2+。
为验证III的可能性,选用如下试剂,填写下列空格:
A.K3[Fe(CN)6]溶液 B.NaOH溶液 C.KSCN溶液 D.酸性KMnO4溶液 E.氯水。
取试样,滴加少量的___________ (填试剂序号),观察现象可确定是否含有Fe3+;
再取适量的试样滴加少量的___________ (填试剂序号),观察现象可确定是否含有Fe2+。
任务二:测定空气中SO2的含量
(5)某课外小组的同学将空气样品经过管道通入密闭容器中的300mL0.1mo/L的酸性KMnO4溶液。写出SO2与该溶液反应的离子方程式为:___________ 。若管道中空气流量为aL/min,经过bmin溶液恰好褪色,假定样品中的SO2被溶液完全吸收,则该空气样品中SO2的含量是___________ g/L(用含a、b的代数式表示)。
任务一:探究铁与浓硫酸反应,设计了图1、图2所示装置进行实验。

(1)比较两实验装置,图2装置的优点是:①能更好的吸收有毒气体SO2,防止其污染环境;②
(2)导气管e有两个主要作用:一是在反应过程中,因导管插入液面下,可起到“液封”作用阻止SO2气体逸出而防止污染环境;二是
(3)能说明图2有SO2气体产生的实验现象是
(4)反应一段时间后,用滴管吸取(图2)A试管中的溶液滴入适量水中,其中所含金属离子的成分有三种可能:
I:只含有Fe3+;II:只含有Fe2+;III:既有Fe3+又有Fe2+。
为验证III的可能性,选用如下试剂,填写下列空格:
A.K3[Fe(CN)6]溶液 B.NaOH溶液 C.KSCN溶液 D.酸性KMnO4溶液 E.氯水。
取试样,滴加少量的
再取适量的试样滴加少量的
任务二:测定空气中SO2的含量
(5)某课外小组的同学将空气样品经过管道通入密闭容器中的300mL0.1mo/L的酸性KMnO4溶液。写出SO2与该溶液反应的离子方程式为:
更新时间:2023-05-05 08:04:26
|
相似题推荐
解答题-实验探究题
|
适中
(0.65)
【推荐1】某研究小组用如图装置进行SO2与FeCl3溶液反应的相关实验。
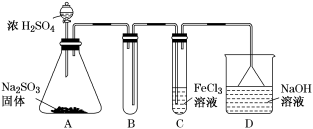
(1)通入足量SO2时C中观察到的现象为_______ 。
(2)根据以上现象,该小组同学认为SO2与FeCl3溶液发生了氧化还原反应。
①写出SO2与FeCl3溶液反应的离子方程式:_______ 。
②请设计实验方案检验有Fe2+生成:_______ 。
③该小组同学向C试管反应后的溶液中加入盐酸,没有明显现象。再加入BaCl2溶液,若出现白色沉淀,即可证明反应生成了_______ 。
(3)为了验证SO2具有还原性,实验中可以代替FeCl3的试剂有_______ (填字母)。
A.浓硫酸 B.酸性KMnO4溶液 C.NaCl溶液

(1)通入足量SO2时C中观察到的现象为
(2)根据以上现象,该小组同学认为SO2与FeCl3溶液发生了氧化还原反应。
①写出SO2与FeCl3溶液反应的离子方程式:
②请设计实验方案检验有Fe2+生成:
③该小组同学向C试管反应后的溶液中加入盐酸,没有明显现象。再加入BaCl2溶液,若出现白色沉淀,即可证明反应生成了
(3)为了验证SO2具有还原性,实验中可以代替FeCl3的试剂有
A.浓硫酸 B.酸性KMnO4溶液 C.NaCl溶液
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐2】为探究 H2O2、SO2、Br2 氧化性强弱,某小组同学设计如下实验(夹持及尾气处理装置已略去,气密性已检验)

(1)A 中发生反应的化学方程式是_____ 。
(2)B 中红棕色褪色的离子方程式是_____ 。
(3)甲同学通过 C 中产生白色沉淀,得出结论,氧化性:H2O2>SO2。C 中产生白色沉淀的离子方程式是_____ 。
①乙同学认为不能得出此结论, 认为在滴加浓硫酸之前应增加一步操作, 该操作是_____ 。
②丙同学认为还应该在 B 和 C 之间增加洗气瓶 D,D 中盛放的试剂是_____ 。
③将乙和丙同学改进后的方案进行实验,C 中产生白色沉淀,得出结论:氧化性 H2O2>SO2。
(4)iii 中滴入少量 H2O2 没有明显变化。提出假设:
观点 1:H2O2 的量少不能氧化溴离子
观点 2:B 中有未反应 SO2
为验证观点 2,应进行的实验操作及现象是_____ 。
(5)通过上述全部实验,得出结论:H2O2、SO2、Br2 氧化性由强到弱的顺序是_____ 。

| 实验操作 | 实验现象 |
| i. 打开 A 中分液漏斗活塞,滴加浓硫酸 | A 中有气泡产生,B 中红棕色褪色,C 中有白色沉淀 |
| ii. 取 C 中沉淀加入盐酸 | C 中白色沉淀不溶解 |
| iii. 打开B 中分液漏斗活塞,逐滴滴加H2O2 | 开始时颜色无明显变化;继续滴加 H2O2 溶液,一段时间后,混合液逐渐变成红棕色 |
(1)A 中发生反应的化学方程式是
(2)B 中红棕色褪色的离子方程式是
(3)甲同学通过 C 中产生白色沉淀,得出结论,氧化性:H2O2>SO2。C 中产生白色沉淀的离子方程式是
①乙同学认为不能得出此结论, 认为在滴加浓硫酸之前应增加一步操作, 该操作是
②丙同学认为还应该在 B 和 C 之间增加洗气瓶 D,D 中盛放的试剂是
③将乙和丙同学改进后的方案进行实验,C 中产生白色沉淀,得出结论:氧化性 H2O2>SO2。
(4)iii 中滴入少量 H2O2 没有明显变化。提出假设:
观点 1:H2O2 的量少不能氧化溴离子
观点 2:B 中有未反应 SO2
为验证观点 2,应进行的实验操作及现象是
(5)通过上述全部实验,得出结论:H2O2、SO2、Br2 氧化性由强到弱的顺序是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐3】二氧化硫是国内外允许使用的一种食品添加剂,可用于食物的增白、防腐等,但必须严格遵守国家有关标准使用。某学习小组设计了如图装置用于制取SO2并验证其性质。
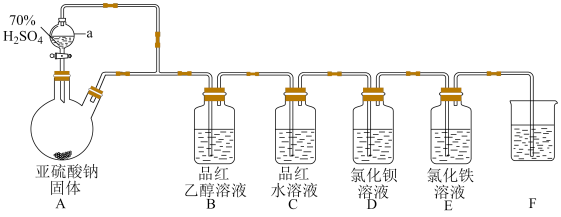
(1)仪器a的名称为___________ 。
(2)烧杯F中的试剂可以是___________。(填序号)
(3)实验时装置E中溶液变为浅绿色,只用一种试剂检验该离子,该试剂化学式为___________ 。
(4)实验时观察到装置B中无明显现象,装置C中溶液红色褪去,则使品红的水溶液褪色的微粒一定不是___________ 。(填化学式)
(5)学生甲预测装置D中没有白色沉淀产生,但随着反应的进行,发现装置D中产生了少量白色沉淀。为进一步探究产生沉淀的原因,分别用煮沸和未煮沸过的蒸馏水配制的Ba(NO3)2和BaCl2溶液,进行下图实验:
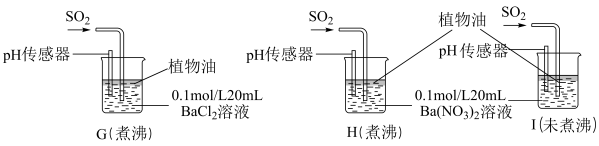
实验中G、H、I烧杯中观察到的现象如下表:
①据G中现象得出的结论是___________ 。
②H中发生反应的离子方程式___________ 。
③I中出现白色沉淀的速率比H中快很多的原因可能是___________ 。

(1)仪器a的名称为
(2)烧杯F中的试剂可以是___________。(填序号)
| A.饱和NaHSO3溶液 | B.饱和Na2CO3溶液 | C.饱和NaCl溶液 | D.NaOH溶液 |
(4)实验时观察到装置B中无明显现象,装置C中溶液红色褪去,则使品红的水溶液褪色的微粒一定不是
(5)学生甲预测装置D中没有白色沉淀产生,但随着反应的进行,发现装置D中产生了少量白色沉淀。为进一步探究产生沉淀的原因,分别用煮沸和未煮沸过的蒸馏水配制的Ba(NO3)2和BaCl2溶液,进行下图实验:

实验中G、H、I烧杯中观察到的现象如下表:
| 烧杯 | 实验现象 |
| G | 无白色沉淀产生,pH传感器测得溶液pH=5.3 |
| H | 有白色沉淀产生 |
| I | 有白色沉淀产生,I中出现白色沉淀比H中快很多 |
②H中发生反应的离子方程式
③I中出现白色沉淀的速率比H中快很多的原因可能是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
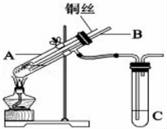
【推荐1】用如图所示实验装置探究铜丝与过量浓硫酸的反应。
(1)写出A中发生反应的化学方程式___ 。
(2)装置D通入产生的气体后(未加热)的现象是___ ,点燃酒精灯加热后的现象是___ 。
(3)为验证SO2和Cl2发生了反应,小组同学进行如下实验。
①甲同学认为若SO2和Cl2反应,生成了Cl-,只要检验到生成的Cl-即可,甲取适量B中样品于试管中,向其中滴加少量___ (写化学式)溶液,有白色沉淀生成。
②乙同学认为甲同学的结论不合理,理由是___ 。他认为若验证SO2和Cl2反应,需要检验到生成的___ (写化学式)。
③一段时间后,观察到B中溶液黄绿色褪去,B中反应的离子方程式为___ 。
(4)C中反应的化学方程式为___ 。
(5)装置E的作用是___ ,发生反应的离子方程式是___ 。

(1)写出A中发生反应的化学方程式
(2)装置D通入产生的气体后(未加热)的现象是
(3)为验证SO2和Cl2发生了反应,小组同学进行如下实验。
①甲同学认为若SO2和Cl2反应,生成了Cl-,只要检验到生成的Cl-即可,甲取适量B中样品于试管中,向其中滴加少量
②乙同学认为甲同学的结论不合理,理由是
③一段时间后,观察到B中溶液黄绿色褪去,B中反应的离子方程式为
(4)C中反应的化学方程式为
(5)装置E的作用是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐2】(1)用铜与浓硫酸反应制取硫酸铜,实验装置如图所示.
A中装置体现了浓硫酸的哪些性质?______ ;
(2)为符合绿色化学的要求,某同学进行如下设计:将铜粉在______ (填仪器名称)中反复灼烧,使铜与空气充分反应生成氧化铜,再将氧化铜与稀硫酸反应,反应后溶液经过______ 、______ 、过滤、洗涤、干燥,即可得到产品CuSO45H2O晶体,干燥时需要控制温度小于100℃,若温度过高,则会导致______ .
(3)探究小组用滴定法测定某胆矾晶体中CuSO4的含量.取ag样品配成100mL溶液,每次取20.00mL,消除干扰离子后,用c molL﹣1的EDTA(H2Y2﹣)标准溶液滴定至终点,平均消耗EDTA溶液6mL.滴定反应如下:Cu2++H2Y2﹣=CuY2﹣+2H+.
①写出计算CuSO4质量分数的计算式ω=______ ;
②下列操作会导致CuSO4含量的测定结果偏低的是______ .
a.用样品溶液润洗锥形瓶
b.滴定终点时俯视读数
c.滴定终点时滴定管尖嘴中有气泡

A中装置体现了浓硫酸的哪些性质?
(2)为符合绿色化学的要求,某同学进行如下设计:将铜粉在
(3)探究小组用滴定法测定某胆矾晶体中CuSO4的含量.取ag样品配成100mL溶液,每次取20.00mL,消除干扰离子后,用c molL﹣1的EDTA(H2Y2﹣)标准溶液滴定至终点,平均消耗EDTA溶液6mL.滴定反应如下:Cu2++H2Y2﹣=CuY2﹣+2H+.
①写出计算CuSO4质量分数的计算式ω=
②下列操作会导致CuSO4含量的测定结果偏低的是
a.用样品溶液润洗锥形瓶
b.滴定终点时俯视读数
c.滴定终点时滴定管尖嘴中有气泡
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐3】现有某铁碳合金(可看作铁和碳两种单质的混合物),某化学兴趣小组为了测定铁碳合金中碳的质量分数,设计了如图所示的实验装置(夹持仪器已省略)。
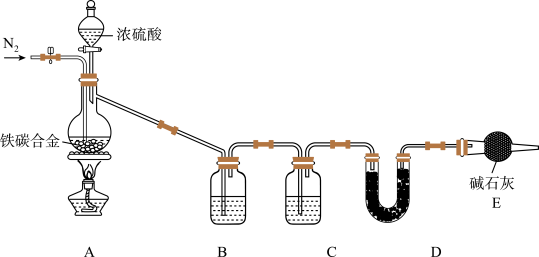
(1)装置A中发生的反应除外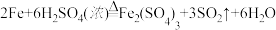 ,还有
,还有________________ 。
(2)请完成下列表格:
(3)若铁碳合金的质量为5.00g,充分反应后称得D装置增重0.66g,则合金中碳的质量分数为_______ ,若缺少E装置,则所测碳的质量分数_________ (填“偏高”“偏低”或“无影响”)。

(1)装置A中发生的反应除外
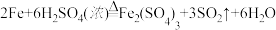 ,还有
,还有(2)请完成下列表格:
| 装置代号 | B | C | D |
| 所盛试剂 | 酸性 溶液 溶液 | ① | ② |
| 装置作用 | ③ | 干燥气体 | ④ |
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
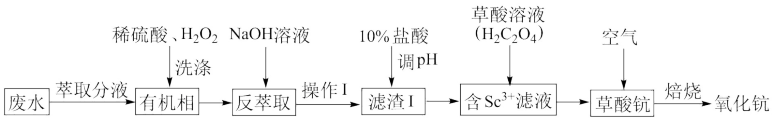
【推荐1】钪(Sc)是一种稀土金属。从钛白酸性废水(主要含Ti、Fe2+,微量Sc)中富集钪,并制备氧化钪(Sc2O3)的工艺流程如下。
回答下列问题:
(1)“有机相”中主要含有Ti4+、Fe2+、Sc3+,酸洗时加入H2O2的目的是___________ ;
(2)在实验室中,“操作1”需要的玻璃仪器有烧杯、___________ ,“滤渣1”的主要成分是Ti(OH)4、___________
(3)调pH的目的是___________ ;检验“含Sc3+“滤液”中是否含Fe3+的操作为___________ 。
(4)写出草酸钪焙烧时反应的化学方程式___________
(5)钛白酸性废水中Sc3+含量10.0~20.0mg·L-1,该工艺日处理钛白酸性废水50.0m3,理论上能生产含85%氧化钪的产品最多___________ kg。

回答下列问题:
(1)“有机相”中主要含有Ti4+、Fe2+、Sc3+,酸洗时加入H2O2的目的是
(2)在实验室中,“操作1”需要的玻璃仪器有烧杯、
(3)调pH的目的是
(4)写出草酸钪焙烧时反应的化学方程式
(5)钛白酸性废水中Sc3+含量10.0~20.0mg·L-1,该工艺日处理钛白酸性废水50.0m3,理论上能生产含85%氧化钪的产品最多
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
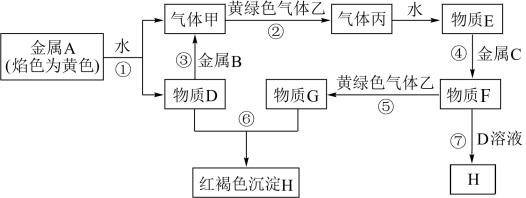
【推荐2】现有金属单质A、B、C和气体甲、乙、丙及物质D、E、F、G、H,它们之间能发生如下反应(图中有些反应的产物和反应的条件没有全部标出)。
请根据以上信息回答下列问题:
(1)写出下列物质的化学式:丙___________ ;
(2)反应③是D物质的水溶液与金属B反应,金属B失去电子被___________ 物质氧化(填氧化剂的化学式)。
(3)生成H沉淀在空气中颜色会发生变化,其变化的现象为:___________ ,化学方程式为: ___________ 。
(4)检验G中所含的金属离子时,在G的溶液中加入硫氰化钾溶液,化学方程式为:_____________________________________________________________ 。

请根据以上信息回答下列问题:
(1)写出下列物质的化学式:丙
(2)反应③是D物质的水溶液与金属B反应,金属B失去电子被
(3)生成H沉淀在空气中颜色会发生变化,其变化的现象为:
(4)检验G中所含的金属离子时,在G的溶液中加入硫氰化钾溶液,化学方程式为:
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐3】甲、乙同学对Fe及其化合物的相关性质与用途进行探究。
(1)实验I:甲、乙两同学分别用下图装置进行Fe粉与水蒸气反应的实验。
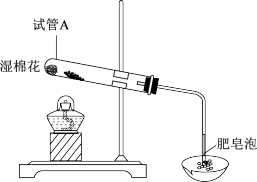
①证明生成的气体是氢气,依据的现象是_______ 。
②该反应的化学方程式是_______ 。
(2)实验II:甲、乙同学分别对各自实验I反应后的黑色固体进行研究。冷却取试管A中冷却后的固体加入过量稀HCl,充分反应后将溶液分成两份(如图)。请将下表中的现象或结论补充完整。
已知: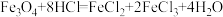
(1)实验I:甲、乙两同学分别用下图装置进行Fe粉与水蒸气反应的实验。

①证明生成的气体是氢气,依据的现象是
②该反应的化学方程式是
(2)实验II:甲、乙同学分别对各自实验I反应后的黑色固体进行研究。冷却取试管A中冷却后的固体加入过量稀HCl,充分反应后将溶液分成两份(如图)。请将下表中的现象或结论补充完整。
已知:
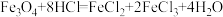
| 操作过程 | 现象及结论 | |
| 甲同学 | 乙同学 | |
 | 试管B中固体全部溶解,得到溶液M | 试管B固体全部溶解,同时有大量气泡产生,得到溶液N |
| 试管C溶液变红 | 试管C溶液没有变红,用离子方程式解释原因② | |
| 试管D开始有红褐色和灰绿色沉淀生成,最终全部变为红褐色。则溶液M中存在的阳离子有① | 试管D实验现象是③ 产生该现象发生的氧化还原反应的化学方程式是④ | |
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐1】某小组实验探究不同条件下 溶液与
溶液与 溶液的反应。
溶液的反应。
已知: 在一定条件下可被还原为:
在一定条件下可被还原为: (绿色)、
(绿色)、 (无色)、
(无色)、 (棕黑色);
(棕黑色); 在性条件下很稳定,但在中性或酸性条件下不稳定,易分解为
在性条件下很稳定,但在中性或酸性条件下不稳定,易分解为 和
和 。
。
(1)实验Ⅰ~Ⅲ的操作过程中,加入 溶液和物质a时,应先加
溶液和物质a时,应先加_____________ 。
(2)实验中Ⅰ, 的还原产物为
的还原产物为_____________ 。
(3)实验Ⅱ中发生反应的离子方程式为______________________________ 。
(4)解释实验Ⅲ中“一段时间后绿色消失,产生棕黑色沉淀”的原因为_______________________ (用离子方程式表示)。
 溶液与
溶液与 溶液的反应。
溶液的反应。已知:
 在一定条件下可被还原为:
在一定条件下可被还原为: (绿色)、
(绿色)、 (无色)、
(无色)、 (棕黑色);
(棕黑色); 在性条件下很稳定,但在中性或酸性条件下不稳定,易分解为
在性条件下很稳定,但在中性或酸性条件下不稳定,易分解为 和
和 。
。实验 | 序号 | 物质a | 实验现象 |
4滴物质a,0.6mL 0.1  溶液 溶液
2mL 0.01   溶液 溶液 | Ⅰ | 3 | 紫色溶液变浅至几乎无色 |
Ⅱ |
| 紫色褪去,产生棕黑色沉淀 | |
Ⅲ | 6 | 溶液变绿,一段时间后绿色消失,产生棕黑色沉淀 |
(1)实验Ⅰ~Ⅲ的操作过程中,加入
 溶液和物质a时,应先加
溶液和物质a时,应先加(2)实验中Ⅰ,
 的还原产物为
的还原产物为(3)实验Ⅱ中发生反应的离子方程式为
(4)解释实验Ⅲ中“一段时间后绿色消失,产生棕黑色沉淀”的原因为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
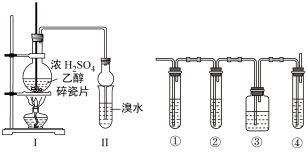
【推荐2】Ⅰ.某化学兴趣小组用如图所示装置进行探究实验。以验证产物中有乙烯生成且乙烯具有不饱和性。当温度迅速上升后,可观察到试管中溴水褪色,烧瓶中浓H2SO4与乙醇的混合液体变为棕黑色。
(1)写出该实验中生成乙烯的化学方程式_______ 。
(2)甲同学认为:考虑到该混合液体反应的复杂性,溴水褪色的现象不能证明反应中有乙烯生成且乙烯具有不饱和性,其理由正确的是_______ 。
A.烯与溴水易发生取代反应
B.使溴水褪色的物质,未必是加成反应
C.使溴水褪色的物质,未必是乙烯
(3)乙同学经过细致观察后认为:试管中另一现象可证明反应中有乙烯生成,这个现象是_______ 。为验证这一反应是加成而不是取代,可用pH试纸来测试反应后溶液的酸性,理由是_______ 。
Ⅱ.实验室制取乙烯,常因温度过高而使乙醇和浓H2SO4生成少量的SO2,有人设计下列实验以确认上述混合气体中有乙烯和SO2,试回答下列问题:
(4)图中①②③④装置可盛放的试剂是:
①_______ ;
②_______ ;
③_______ ;
④_______ (将下列有关试剂的序号填入空格内)。
A.品红溶液 B.NaOH溶液 C.浓硫酸 D.酸性高锰酸钾溶液
(5)装置①中的现象是_______ 。
(6)使用装置②的目的是_______ 。
(7)使用装置③的目的是_______ 。
(8)确证含有乙烯的现象是_______ 。

(1)写出该实验中生成乙烯的化学方程式
(2)甲同学认为:考虑到该混合液体反应的复杂性,溴水褪色的现象不能证明反应中有乙烯生成且乙烯具有不饱和性,其理由正确的是
A.烯与溴水易发生取代反应
B.使溴水褪色的物质,未必是加成反应
C.使溴水褪色的物质,未必是乙烯
(3)乙同学经过细致观察后认为:试管中另一现象可证明反应中有乙烯生成,这个现象是
Ⅱ.实验室制取乙烯,常因温度过高而使乙醇和浓H2SO4生成少量的SO2,有人设计下列实验以确认上述混合气体中有乙烯和SO2,试回答下列问题:
(4)图中①②③④装置可盛放的试剂是:
①
②
③
④
A.品红溶液 B.NaOH溶液 C.浓硫酸 D.酸性高锰酸钾溶液
(5)装置①中的现象是
(6)使用装置②的目的是
(7)使用装置③的目的是
(8)确证含有乙烯的现象是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐3】某研究性学习小组为探究铜、锌与浓盐酸的反应,设计实验探究方案如下:
实验用品:纯锌片、铜片、37%的浓盐酸、蒸馏水、氯化钾溶液、稀硝酸溶液
实验记录:
背影资料:
请你参与以下探究:
(1)实验A反应速度明显比B小,原因是____________________ 。
(2)根据“铜位于金属活动顺序表氢之后,与稀盐酸不反应,而在实验中加热时又产生气体”的事实,作出如下推断:
①有同学认为“实验C中加热时产生的气体是溶解在溶液中的H2”,你认为是否有道理,理由是____________________ 。
②某同学作了如下猜想:是否成立?请你设计实验方案加入验证。
(3)某同学对实验D中的白色沉淀进行分析:“不可能是CuCl2,因为CuCl2能溶于水且溶液显蓝色;也不可能是ZnCl2,因为稀释后溶液更稀,不会析出ZnCl2晶体。若利用资源卡片资料大胆猜想,白色沉淀可能是CuCl。请你帮他设计验证方案(若有多处方案,只设计两个)。
(4)指导老师肯定了实验D中的白色沉淀是CuCl;并指出生成沉淀的原因,实际上是[CuCl4]2-等离子与CuCl(s)、Cl三者之间所形成的沉淀溶解平衡移动的结果。请写出这一平衡关系式(用离子方程式表示):_______________________ 。
实验用品:纯锌片、铜片、37%的浓盐酸、蒸馏水、氯化钾溶液、稀硝酸溶液
实验记录:
背影资料:
|
|
(1)实验A反应速度明显比B小,原因是
(2)根据“铜位于金属活动顺序表氢之后,与稀盐酸不反应,而在实验中加热时又产生气体”的事实,作出如下推断:
①有同学认为“实验C中加热时产生的气体是溶解在溶液中的H2”,你认为是否有道理,理由是
②某同学作了如下猜想:是否成立?请你设计实验方案加入验证。
| 猜想 | 验证方法 | 预测现象及结论 |
| 认为铜片中可能含有锌等杂质 |
| 猜想 | 预计验证方法 | 猜想的现象与结论 |
| 白色沉淀是氯化亚铜 | ||
您最近一年使用:0次


 溶液
溶液
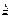 2Cu2O+O2↑
2Cu2O+O2↑

