焦亚硫酸钠( )常作食品防腐剂、漂白剂、疏松剂。某小组回收以辉铜矿为原料火法治铜的尾气中的
)常作食品防腐剂、漂白剂、疏松剂。某小组回收以辉铜矿为原料火法治铜的尾气中的 ,制备焦亚硫酸钠,流程如下:
,制备焦亚硫酸钠,流程如下:
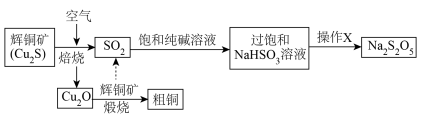
回答下列问题:
(1)焙烧、煅烧之前,辉铜矿要粉碎过筛,其目的是________ 。
(2)“煅烧”中发生反应的化学方程式为________ ,其中 ,还原产物和氧化产物的物质的量之比为________ 。
(3) 转化成
转化成 的离子方程式为
的离子方程式为________ 。
(4)操作X包括蒸发浓缩、________ 、过滤、洗涤、干燥。
(5)探究 的性质。取少量
的性质。取少量 产品溶于水,滴加酸性
产品溶于水,滴加酸性 溶液,振荡,溶液褪色,表明
溶液,振荡,溶液褪色,表明 具有的性质有________(填字母)。
具有的性质有________(填字母)。
(6)为了探究 溶液在空气中的变化情况,小组展开如下研究:
溶液在空气中的变化情况,小组展开如下研究:
查阅资料:常温下,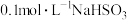 溶液
溶液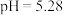 ,
,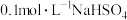 溶液
溶液 ,
, 溶液
溶液 。常温下,取
。常温下,取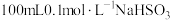 溶液放置某环境下空气中,用pH计测定pH与时间关系如图所示(体积变化忽略不计)。
溶液放置某环境下空气中,用pH计测定pH与时间关系如图所示(体积变化忽略不计)。
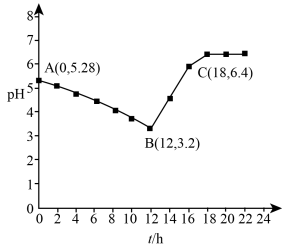
AB段pH降低的主要原因是________ 。B点pH不能降至1.0的主要原因可能是________ (用离子方程式表示)。
 )常作食品防腐剂、漂白剂、疏松剂。某小组回收以辉铜矿为原料火法治铜的尾气中的
)常作食品防腐剂、漂白剂、疏松剂。某小组回收以辉铜矿为原料火法治铜的尾气中的 ,制备焦亚硫酸钠,流程如下:
,制备焦亚硫酸钠,流程如下:
回答下列问题:
(1)焙烧、煅烧之前,辉铜矿要粉碎过筛,其目的是
(2)“煅烧”中发生反应的化学方程式为
(3)
 转化成
转化成 的离子方程式为
的离子方程式为(4)操作X包括蒸发浓缩、
(5)探究
 的性质。取少量
的性质。取少量 产品溶于水,滴加酸性
产品溶于水,滴加酸性 溶液,振荡,溶液褪色,表明
溶液,振荡,溶液褪色,表明 具有的性质有________(填字母)。
具有的性质有________(填字母)。| A.氧化性 | B.还原性 | C.不稳定性 | D.碱性 |
 溶液在空气中的变化情况,小组展开如下研究:
溶液在空气中的变化情况,小组展开如下研究:查阅资料:常温下,
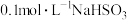 溶液
溶液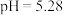 ,
,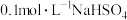 溶液
溶液 ,
, 溶液
溶液 。常温下,取
。常温下,取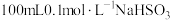 溶液放置某环境下空气中,用pH计测定pH与时间关系如图所示(体积变化忽略不计)。
溶液放置某环境下空气中,用pH计测定pH与时间关系如图所示(体积变化忽略不计)。
AB段pH降低的主要原因是
更新时间:2023-06-02 21:50:47
|
相似题推荐
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐1】硫酸锌是制造锌钡白和锌盐的主要原料,也可用作木材的防腐剂等。用氧化锌烟尘(主要成分为ZnO,还含有少量PbO、CuO、Fe2O3、FeO、SiO2等)生产ZnSO4·7H2O的流程如下:

有关金属离子[c(Mn+)=0.1 mol·L-1]形成氢氧化物沉淀的pH范围如下:
(1)“酸浸”时用的稀酸是____ ;加入锌粉除杂这一步的反应类型为_____ (填四种基本反应类型)。
(2)滤渣1的主要成分是_________ 。
(3)“氧化”时的离子方程式为____________________ 。
(4)根据题中的有关数据可求得上述条件下Fe(OH)3的Ksp为________ 。
(5)由滤液得到ZnSO4·7H2O的操作是______ 、______ 、过滤、洗涤、干燥。
(6)取14.35 g ZnSO4·7H2O加热至不同温度,剩余固体的质量如下表:
则680 ℃时剩余固体的化学式为 (填序号)。
(7)工业上可用电解含ZnSO4 、MnSO4 的混合溶液制得Zn和MnO2,该电解反应的化学方程式为_______________ 。

有关金属离子[c(Mn+)=0.1 mol·L-1]形成氢氧化物沉淀的pH范围如下:
| 金属离子 | Fe3+ | Fe2+ | Zn2+ | Cu2+ |
| 开始沉淀的pH | 1.5 | 6.3 | 6.2 | 5.0 |
| 沉淀完全的pH | 2.8 | 8.3 | 8.2 | 6.7 |
(1)“酸浸”时用的稀酸是
(2)滤渣1的主要成分是
(3)“氧化”时的离子方程式为
(4)根据题中的有关数据可求得上述条件下Fe(OH)3的Ksp为
(5)由滤液得到ZnSO4·7H2O的操作是
(6)取14.35 g ZnSO4·7H2O加热至不同温度,剩余固体的质量如下表:
| 温度/℃ | 100 | 250 | 680 | 930 |
| 质量/g | 8.95 | 8.05 | 6.72 | 4.05 |
则680 ℃时剩余固体的化学式为 (填序号)。
| A.ZnO | B.ZnSO4·H2O | C.ZnSO4 | D.Zn3O(SO4) 2 |
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
【推荐2】(Ⅰ)已知A为常见的金属单质。B俗称磁性氯化铁。根据如图所示的关系:
B:_______ D:_______ 。
(2)写出③的离子方程式:_______ 。
(3)写出④的化学方程式:_______ 。
(4)写出⑤的化学方程式:_______ 。
(5)写出E→F的现象_______ 。
写出E→F的化学方程式_______ 。
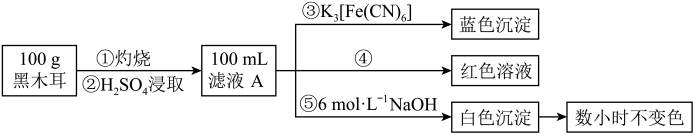
(Ⅱ)某兴趣小组同学为探究黑木耳中的含铁量,进行如下实验。已知:
ⅰ.黑木耳富含蛋白质、糖类、卵磷脂、铁及一些还原性物质等。每100克黑木耳含铁高达185毫克。
ⅱ.紫色的 溶液在酸性条件下有强氧化性,其还原产物是无色的
溶液在酸性条件下有强氧化性,其还原产物是无色的 。
。
ⅲ. 与铁氰化钾(
与铁氰化钾(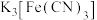 )溶液反应生成蓝色沉淀。
)溶液反应生成蓝色沉淀。
为确定黑木耳中含有铁元素,甲同学设计实验方案如图。_______ 。
(7)步骤④检验 所用试剂是
所用试剂是_______ 溶液。
(8)下列有关上述实验得出的结论正确的是_______ (填字母符号)。
a.黑木耳中一定含 和
和
b.滤液A中一定含 和
和
c.白色沉淀中一定含
为测定黑木耳中铁元素的含量,乙同学设计实验方案如下。
(10)步骤⑦中观察到的实验现象是_______ ,反应的离子方程式是_______ 。

B:
(2)写出③的离子方程式:
(3)写出④的化学方程式:
(4)写出⑤的化学方程式:
(5)写出E→F的现象
写出E→F的化学方程式
(Ⅱ)某兴趣小组同学为探究黑木耳中的含铁量,进行如下实验。已知:
ⅰ.黑木耳富含蛋白质、糖类、卵磷脂、铁及一些还原性物质等。每100克黑木耳含铁高达185毫克。
ⅱ.紫色的
 溶液在酸性条件下有强氧化性,其还原产物是无色的
溶液在酸性条件下有强氧化性,其还原产物是无色的 。
。ⅲ.
 与铁氰化钾(
与铁氰化钾(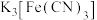 )溶液反应生成蓝色沉淀。
)溶液反应生成蓝色沉淀。为确定黑木耳中含有铁元素,甲同学设计实验方案如图。
(7)步骤④检验
 所用试剂是
所用试剂是(8)下列有关上述实验得出的结论正确的是
a.黑木耳中一定含
 和
和
b.滤液A中一定含
 和
和
c.白色沉淀中一定含

为测定黑木耳中铁元素的含量,乙同学设计实验方案如下。
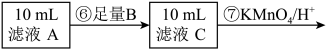
| A.Na | B.Zn | C.Fe | D.Cu |
(10)步骤⑦中观察到的实验现象是
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
【推荐3】从海水中可以提取很多有用的物质,例如从海水制盐所得到的卤水中可以提取碘。活性炭吸附法是工业提取碘的方法之一,其流程如下:
Ⅰ.pH=2时, 溶液只能将
溶液只能将 氧化为
氧化为 ,同时生成NO;
,同时生成NO;
Ⅱ.
Ⅲ. 在碱性溶液中反应生成
在碱性溶液中反应生成 和
和 。
。
(1)反应①的离子方程式___________ 。
(2)方案甲中,根据 的特性,分离操作X应为
的特性,分离操作X应为___________ 。
(3) 、酸性
、酸性 等都是常用的强氧化剂,但该工艺中氧化卤水中的
等都是常用的强氧化剂,但该工艺中氧化卤水中的 却选择了价格较高的
却选择了价格较高的 ,原因是
,原因是___________ 。
(4)写出反应②的离子反应方程式___________ 。
(5)方案乙中,已知反应③过滤后,滤液中仍存在少量的 、
、 。若检验滤液中的
。若检验滤液中的 ,需要选择下列哪些试剂完成检验(填序号)
,需要选择下列哪些试剂完成检验(填序号)___________ 。
可供选择的试剂:①无水乙醇② ③氢氧化钠溶液④稀
③氢氧化钠溶液④稀 ⑤淀粉溶液⑥
⑤淀粉溶液⑥ 溶液。
溶液。

Ⅰ.pH=2时,
 溶液只能将
溶液只能将 氧化为
氧化为 ,同时生成NO;
,同时生成NO;Ⅱ.

Ⅲ.
 在碱性溶液中反应生成
在碱性溶液中反应生成 和
和 。
。(1)反应①的离子方程式
(2)方案甲中,根据
 的特性,分离操作X应为
的特性,分离操作X应为(3)
 、酸性
、酸性 等都是常用的强氧化剂,但该工艺中氧化卤水中的
等都是常用的强氧化剂,但该工艺中氧化卤水中的 却选择了价格较高的
却选择了价格较高的 ,原因是
,原因是(4)写出反应②的离子反应方程式
(5)方案乙中,已知反应③过滤后,滤液中仍存在少量的
 、
、 。若检验滤液中的
。若检验滤液中的 ,需要选择下列哪些试剂完成检验(填序号)
,需要选择下列哪些试剂完成检验(填序号)可供选择的试剂:①无水乙醇②
 ③氢氧化钠溶液④稀
③氢氧化钠溶液④稀 ⑤淀粉溶液⑥
⑤淀粉溶液⑥ 溶液。
溶液。
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐1】Ⅰ.工业上用氨催化氧化制硝酸。
(1)由氨氧化制备硝酸的第一步反应的化学方程式:______________
(2)由于二氧化氮不能被水完全吸收,因此生成的气体须经过多次氧化、吸收的循环操作,使其充分转化为硝酸(如果不考虑生产过程中的其它损失).
①从理论上分析,要使氨气完全转化为硝酸,则原料氨气和氧气物质的量的投料比至少为____ .
②如果按理论上的原料比将原料放在一个具有反应条件的密闭容器中进行,所有物质不与外界交换,则最后所得溶液的质量分数为______ .
Ⅱ.某学习小组为了模拟工业上氨氧化制硝酸,用下列仪器进行实验:
C装置可以加热,回答下列问题:
(3)装置图中虚线方框内必要仪器的名称和所盛试剂分别为_________
(4)A处的玻璃导管设置成可上下抽动的原因__________________
(5)实验中在D中观察到的实验现象是____________
(6)E的作用是___________ ,E中倒置漏斗可防倒吸,能防倒吸的原因是__________
(1)由氨氧化制备硝酸的第一步反应的化学方程式:
(2)由于二氧化氮不能被水完全吸收,因此生成的气体须经过多次氧化、吸收的循环操作,使其充分转化为硝酸(如果不考虑生产过程中的其它损失).
①从理论上分析,要使氨气完全转化为硝酸,则原料氨气和氧气物质的量的投料比至少为
②如果按理论上的原料比将原料放在一个具有反应条件的密闭容器中进行,所有物质不与外界交换,则最后所得溶液的质量分数为
Ⅱ.某学习小组为了模拟工业上氨氧化制硝酸,用下列仪器进行实验:

C装置可以加热,回答下列问题:
(3)装置图中虚线方框内必要仪器的名称和所盛试剂分别为
(4)A处的玻璃导管设置成可上下抽动的原因
(5)实验中在D中观察到的实验现象是
(6)E的作用是
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐2】高纯四氧化三锰是电子工业生产锰锌氧软磁材料重要原料之一,以菱锰矿(主要成分为 ,含
,含 和少量
和少量 等元素)为原料制备四氧化三锰工艺流程如图所示。
等元素)为原料制备四氧化三锰工艺流程如图所示。
(1)酸浸时 发生反应的离子方程式为
发生反应的离子方程式为___________ 。
(2)滤渣2的主要成分为___________ (填化学式)。
(3)福美钠的化学式为 生成福美镍沉淀的结构为
生成福美镍沉淀的结构为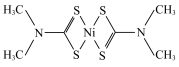 。则各原子之间的结合方式有下列中的
。则各原子之间的结合方式有下列中的___________ (填标号)。
A.离子键 B.金属键 C.氢键 D.配位键 E.极性键
(4)除钙镁时,若使 沉淀完全(浓度小于
沉淀完全(浓度小于 ),溶液中
),溶液中 最小为
最小为___________  。[已知:
。[已知:
(5)除硅时,絮凝剂为阳离子型聚丙烯酰胺,可通过“吸附—电中和—架桥”使硅酸胶体絮凝沉淀,硅酸胶体粒子带___________ 电荷(填“正”或“负”)。
(6) 在空气中被氧化生成
在空气中被氧化生成 的化学方程式为
的化学方程式为___________ 。
(7) 可表示为
可表示为 ,温度高于
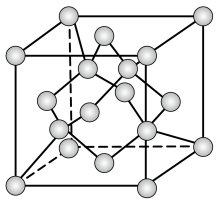
,温度高于 时属于立方晶体,其中
时属于立方晶体,其中 占据晶胞的顶点、面心及内部交错的4个小立方体的体心,与金刚石晶胞中碳原子占据的位置相似(金刚石晶胞如图所示)。若
占据晶胞的顶点、面心及内部交错的4个小立方体的体心,与金刚石晶胞中碳原子占据的位置相似(金刚石晶胞如图所示)。若 晶体的密度为
晶体的密度为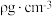 ,则晶胞棱长a=
,则晶胞棱长a=___________  (列出计算式,阿伏加德罗常数的值为
(列出计算式,阿伏加德罗常数的值为 )。
)。
 ,含
,含 和少量
和少量 等元素)为原料制备四氧化三锰工艺流程如图所示。
等元素)为原料制备四氧化三锰工艺流程如图所示。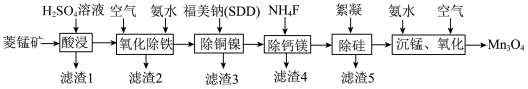
(1)酸浸时
 发生反应的离子方程式为
发生反应的离子方程式为(2)滤渣2的主要成分为
(3)福美钠的化学式为
 生成福美镍沉淀的结构为
生成福美镍沉淀的结构为 。则各原子之间的结合方式有下列中的
。则各原子之间的结合方式有下列中的A.离子键 B.金属键 C.氢键 D.配位键 E.极性键
(4)除钙镁时,若使
 沉淀完全(浓度小于
沉淀完全(浓度小于 ),溶液中
),溶液中 最小为
最小为 。[已知:
。[已知:
(5)除硅时,絮凝剂为阳离子型聚丙烯酰胺,可通过“吸附—电中和—架桥”使硅酸胶体絮凝沉淀,硅酸胶体粒子带
(6)
 在空气中被氧化生成
在空气中被氧化生成 的化学方程式为
的化学方程式为(7)
 可表示为
可表示为 ,温度高于
,温度高于 时属于立方晶体,其中
时属于立方晶体,其中 占据晶胞的顶点、面心及内部交错的4个小立方体的体心,与金刚石晶胞中碳原子占据的位置相似(金刚石晶胞如图所示)。若
占据晶胞的顶点、面心及内部交错的4个小立方体的体心,与金刚石晶胞中碳原子占据的位置相似(金刚石晶胞如图所示)。若 晶体的密度为
晶体的密度为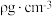 ,则晶胞棱长a=
,则晶胞棱长a= (列出计算式,阿伏加德罗常数的值为
(列出计算式,阿伏加德罗常数的值为 )。
)。
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐3】苯甲酸乙酯用于配制香水香精和人造精油,也大量用于食品中。实验室可通过反应 +CH3CH2OH
+CH3CH2OH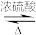
 +H2O制备。实验装置如图所示:
+H2O制备。实验装置如图所示:

所用试剂的性质如下表所示:
环己烷、乙醇和水可形成三元共沸物,其沸点为62.1℃(即此温度下,水、乙醇、环己烷以一定比例成为蒸汽逸出)。
实验步骤:
①向50mL圆底烧瓶中依次加入4g苯甲酸、10mL乙醇(过量)、8mL环己烷和3mL浓硫酸,摇匀,加入几粒沸石。按照图1所示实验装置组装好仪器,加热烧瓶,开始回流。开始时回流要慢,随着回流的进行,分水器中出现上下两层。当下层接近分水器支管时将下层液体放入量筒中。
②继续加热,至烧瓶内有白烟或回流下来液体无滴状(约2h),停止加热。
③将反应液倒入盛有30ml水的烧杯中,分批加入碳酸钠粉末至溶液呈中性(或弱碱性)。
④用分液漏斗分出有机层,水层用25mL乙醚萃取,然后合并至有机层。加入物质X干燥,粗产物利用图2所示装置进行蒸馏。
回答下列问题:
(1)仪器a的名称为_______ ,图2装置中冷却水的出口为_______ (填“m”或“n”)。
(2)加入环己烷的目的为_______ 。
(3)加入碳酸钠可除去的物质为_______ (填名称)。
(4)物质X应选择_______ (填选项字母)。
A.碱石灰 B.MgSO4 C.P2O5
(5)水层用25mL乙醚萃取,然后合并至有机层的目的为_______ 。
(6)蒸馏时优先蒸出的物质为_______ (填名称);若蒸馏后所得产品的质量为2.350g,则该实验的产率为_______ %(保留四位有效数字)。
 +CH3CH2OH
+CH3CH2OH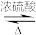
 +H2O制备。实验装置如图所示:
+H2O制备。实验装置如图所示:
所用试剂的性质如下表所示:
| 名称 | 相对分子质量 | 熔点、沸点/℃ | 溶解性 | ||
| 水 | 醇 | 醚 | |||
| 苯甲酸 | 122 | 122.1、249 | 微溶 | 溶 | 溶 |
| 苯甲酸乙酯 | 150 | -34.6、212.6 | 微溶 | 溶 | 溶 |
| 乙醇 | 46 | -114.1、78.3 | 混溶 | 溶 | 溶 |
| 环己烷 | 84 | 6.5、80.7 | 不溶 | 溶 | 溶 |
| 乙醚 | 74 | -116.2、34.5 | 微溶 | 溶 | 溶 |
实验步骤:
①向50mL圆底烧瓶中依次加入4g苯甲酸、10mL乙醇(过量)、8mL环己烷和3mL浓硫酸,摇匀,加入几粒沸石。按照图1所示实验装置组装好仪器,加热烧瓶,开始回流。开始时回流要慢,随着回流的进行,分水器中出现上下两层。当下层接近分水器支管时将下层液体放入量筒中。
②继续加热,至烧瓶内有白烟或回流下来液体无滴状(约2h),停止加热。
③将反应液倒入盛有30ml水的烧杯中,分批加入碳酸钠粉末至溶液呈中性(或弱碱性)。
④用分液漏斗分出有机层,水层用25mL乙醚萃取,然后合并至有机层。加入物质X干燥,粗产物利用图2所示装置进行蒸馏。
回答下列问题:
(1)仪器a的名称为
(2)加入环己烷的目的为
(3)加入碳酸钠可除去的物质为
(4)物质X应选择
A.碱石灰 B.MgSO4 C.P2O5
(5)水层用25mL乙醚萃取,然后合并至有机层的目的为
(6)蒸馏时优先蒸出的物质为
您最近一年使用:0次



