利用浊度计探究一定条件下反应物浓度对硫代硫酸钠( )溶液与硫酸溶液反应速率的影响。浊度计用于测量浑浊度的变化,产生的沉淀越多,浑浊度(单位为NTU)值越大。
)溶液与硫酸溶液反应速率的影响。浊度计用于测量浑浊度的变化,产生的沉淀越多,浑浊度(单位为NTU)值越大。
反应原理: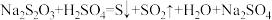
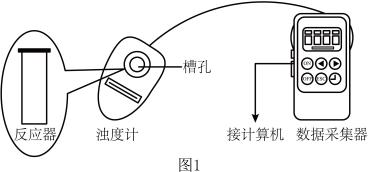
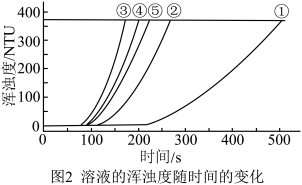
用图1所示装置进行如下表所示的5个实验,分别测量混合后溶液达到浑浊度为375NTU的过程中,浑浊度随时间变化情况。实验①~⑤所得数据如图2曲线①~⑤所示。
(1)
______ 。
(2)实验①③的目的是__________________ 。
(3)分析数据可得以下三个结论:
结论1:其它条件相同时, 浓度越大,反应速率越大;
浓度越大,反应速率越大;
①结论2:______________________________ ;
②结论3:其它条件相同时, 浓度改变对反应速率的影响程度大于
浓度改变对反应速率的影响程度大于 浓度改变对反应速率的影响程度。证据是
浓度改变对反应速率的影响程度。证据是________________________ 。
(4)已知浑浊度为375NTU时,产生S的质量为 g,则实验①反应开始到500s,用
g,则实验①反应开始到500s,用 浓度变化表示的平均反应速率为
浓度变化表示的平均反应速率为______  。
。
 )溶液与硫酸溶液反应速率的影响。浊度计用于测量浑浊度的变化,产生的沉淀越多,浑浊度(单位为NTU)值越大。
)溶液与硫酸溶液反应速率的影响。浊度计用于测量浑浊度的变化,产生的沉淀越多,浑浊度(单位为NTU)值越大。反应原理:
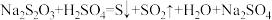
用图1所示装置进行如下表所示的5个实验,分别测量混合后溶液达到浑浊度为375NTU的过程中,浑浊度随时间变化情况。实验①~⑤所得数据如图2曲线①~⑤所示。


| 实验编号 |  溶液 溶液 |  溶液 溶液 | 蒸馏水 | ||
 | V/mL |  | V/mL | V/mL | |
| ① | 0.1 | 1.5 | 0.1 | V1 | 10 |
| ② | 0.1 | 2.5 | 0.1 | V2 | 9 |
| ③ | 0.1 | 3.5 | 0.1 | 3.5 | 8 |
| ④ | 0.1 | V3 | 0.1 | 2.5 | 9 |
| ⑤ | 0.1 | V4 | 0.1 | 1.5 | 10 |

(2)实验①③的目的是
(3)分析数据可得以下三个结论:
结论1:其它条件相同时,
 浓度越大,反应速率越大;
浓度越大,反应速率越大;①结论2:
②结论3:其它条件相同时,
 浓度改变对反应速率的影响程度大于
浓度改变对反应速率的影响程度大于 浓度改变对反应速率的影响程度。证据是
浓度改变对反应速率的影响程度。证据是(4)已知浑浊度为375NTU时,产生S的质量为
 g,则实验①反应开始到500s,用
g,则实验①反应开始到500s,用 浓度变化表示的平均反应速率为
浓度变化表示的平均反应速率为 。
。
更新时间:2023-06-27 17:13:25
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
名校
【推荐1】回答下列问题
(1)在微生物作用的条件下,NH 经过两步反应被氧化成NO
经过两步反应被氧化成NO 。两步反应的能量变化示意图如图:
。两步反应的能量变化示意图如图:
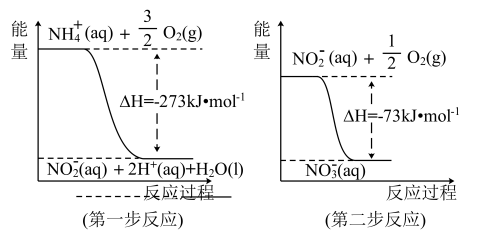
①第一步反应是_______ (填“放热”或“吸热”)反应,判断依据是_______ 。
②1 mol NH (aq)全部氧化成NO
(aq)全部氧化成NO (aq)的热化学方程式是
(aq)的热化学方程式是_______ 。
(2)在80℃时,将0.4mol的N2O4(无色)气体充入2L已抽空的固定容积的密闭容器中,隔一段时间对该容器内的物质进行分析,得到如表数据:
反应进行至100s后将反应混合物的温度降低,发现气体的颜色变浅。该反应的化学方程式为N2O4⇌2NO2。
①0~20s内N2O4的平均反应速率为_______ 。
②在80℃时N2O4的转化率为_______ 。
③写出恒温恒容下,能判断该反应达到平衡状态的依据_______ 。(写出1条即可)
(1)在微生物作用的条件下,NH
 经过两步反应被氧化成NO
经过两步反应被氧化成NO 。两步反应的能量变化示意图如图:
。两步反应的能量变化示意图如图:
①第一步反应是
②1 mol NH
 (aq)全部氧化成NO
(aq)全部氧化成NO (aq)的热化学方程式是
(aq)的热化学方程式是(2)在80℃时,将0.4mol的N2O4(无色)气体充入2L已抽空的固定容积的密闭容器中,隔一段时间对该容器内的物质进行分析,得到如表数据:
| 时间(s) | 0 | 20 | 40 | 60 | 80 | 100 |
| c(N2O4) | 0.20 | a | 0.10 | c | d | e |
| c(NO2) | 0.00 | 0.12 | b | 0.22 | 0.22 | 0.22 |
①0~20s内N2O4的平均反应速率为
②在80℃时N2O4的转化率为
③写出恒温恒容下,能判断该反应达到平衡状态的依据
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐2】向一个容积为2 L的密闭容器中充入4 mol/LA和6 mol/LB,在恒温恒容下发生反应:4A(g)+6B(g) 4C(g)+xD(g),经5 min后达到平衡状态,测得A的浓度为2 mol/L、测得D的化学反应速率为0.4 mol/(L•min)。
4C(g)+xD(g),经5 min后达到平衡状态,测得A的浓度为2 mol/L、测得D的化学反应速率为0.4 mol/(L•min)。
(1)到达平衡前v正_____ v逆(填“>”或者“<”),到达平衡后v正_____ v逆(填“>”、“<”或者“=”)。
(2)增大压强反应速率_____ (填“加快”或者“减慢”),降低温度反应速率_____ (填“加快”或者“减慢”)。
(3)反应开始至平衡时,C的浓度增加了_____ ,以B的浓度变化表示该反应的平均速率v(B)=_____ 。
(4)到达平衡后A的转化率为_____ 。
(5)D的化学计量数x为_____ 。
(6)该条件下反应一段时间,下列能说明反应达到平衡状态的是_____ 。
(7)随着反应的进行发现正反应速率逐渐减小,其原因是_____ 。
(8)反应前与到达平衡后的压强之比为_____ 。
 4C(g)+xD(g),经5 min后达到平衡状态,测得A的浓度为2 mol/L、测得D的化学反应速率为0.4 mol/(L•min)。
4C(g)+xD(g),经5 min后达到平衡状态,测得A的浓度为2 mol/L、测得D的化学反应速率为0.4 mol/(L•min)。(1)到达平衡前v正
(2)增大压强反应速率
(3)反应开始至平衡时,C的浓度增加了
(4)到达平衡后A的转化率为
(5)D的化学计量数x为
(6)该条件下反应一段时间,下列能说明反应达到平衡状态的是
| A.气体的密度保持不变 | B.气体的压强保持不变的状态 |
| C.4v正(A)=6v逆(B) | D.B与C浓度保持不变的状态 |
(8)反应前与到达平衡后的压强之比为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐3】根据《化学反应原理》知识,按要求作答。
(1)一定温度下,在容积为2L的密闭容器里进行反应:aN(g)⇌bM(g)ΔH=-QkJ•mol-1。M、N的物质的量随时间的变化曲线如图所示:

①此反应的化学方程式中 =
=___ ,判断该反应属于___ (填“吸热”或“放热”)反应。
②0到t2时刻,以M的浓度变化表示的平均反应速率为:___ mol•L-1•min-1。
③下列叙述能说明上述反应达到平衡状态的是(填序号)____ 。
A.反应中M与N的物质的量之比为1:1
B.混合气体的总质量不随时间的变化而变化
C.混合气体的总物质的量不随时间的变化而变化
D.单位时间内每消耗amolN,同时生成bmolM
E.混合气体的压强不随时间的变化而变化
(2)在下列四支试管中,进行如下反应的实验:Zn+2HCl=ZnCl2+H2↑,开始反应产生H2的速率最大的是___ 。
(3)有一处于平衡状态的反应A(s)+2B(g)⇌2C(g)△H<0,为了使平衡向生成C的方向移动,应选择的条件是___ 。
①升高温度②增加A的质量③增大压强④增大B的浓度⑤加入催化剂⑥分离出C
(4)原电池的装置如图所示(电极不参与反应):

①锌片是___ (填“正极”或“负极”),电子从___ 流出(填“锌片”或“铜片”)。
②写出铜电极的电极反应式:___ ,此电极发生___ (填“氧化反应”或“还原反应”)。
(1)一定温度下,在容积为2L的密闭容器里进行反应:aN(g)⇌bM(g)ΔH=-QkJ•mol-1。M、N的物质的量随时间的变化曲线如图所示:

①此反应的化学方程式中
 =
=②0到t2时刻,以M的浓度变化表示的平均反应速率为:
③下列叙述能说明上述反应达到平衡状态的是(填序号)
A.反应中M与N的物质的量之比为1:1
B.混合气体的总质量不随时间的变化而变化
C.混合气体的总物质的量不随时间的变化而变化
D.单位时间内每消耗amolN,同时生成bmolM
E.混合气体的压强不随时间的变化而变化
(2)在下列四支试管中,进行如下反应的实验:Zn+2HCl=ZnCl2+H2↑,开始反应产生H2的速率最大的是
| 试管 | 温度/℃ | 等质量锌的形状 | 盐酸浓度/mol•L-1 |
| A | 35 | 块状 | 2.0 |
| B | 35 | 小颗粒 | 2.0 |
| C | 20 | 小颗粒 | 1.0 |
| D | 20 | 块状 | 1.0 |
①升高温度②增加A的质量③增大压强④增大B的浓度⑤加入催化剂⑥分离出C
(4)原电池的装置如图所示(电极不参与反应):

①锌片是
②写出铜电极的电极反应式:
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐1】某研究性学习小组为探究锌与盐酸反应,取同质量、同体积大小的锌片、同浓度盐酸(过量)做了下列平行实验:
实验①:把纯锌片投入到盛有稀盐酸的试管中,发现氢气发生的速率变化如图所示:
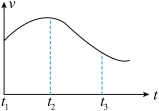
实验②:把纯锌片投入到含FeCl3的同浓度工业稀盐酸中,发现放出氢气的量减少。
实验③:在盐酸中滴入几滴CuCl2溶液,生成氢气速率加快。
试回答下列问题:
(1)试分析实验①中t1~t2速率变化的主要原因是_______ ,t2~t3速率变化的主要原因是________ 。
(2)实验②放出氢气的量减少的原因是_______ 。
实验①:把纯锌片投入到盛有稀盐酸的试管中,发现氢气发生的速率变化如图所示:

实验②:把纯锌片投入到含FeCl3的同浓度工业稀盐酸中,发现放出氢气的量减少。
实验③:在盐酸中滴入几滴CuCl2溶液,生成氢气速率加快。
试回答下列问题:
(1)试分析实验①中t1~t2速率变化的主要原因是
(2)实验②放出氢气的量减少的原因是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐2】根据下列实验设计,回答问题:

(1)利用实验(I)探究锌与 硫酸和
硫酸和 硫酸反应的速率,可以测定收集一定体积氢气所用的时间。此方法需要控制的变量有(写出1项):
硫酸反应的速率,可以测定收集一定体积氢气所用的时间。此方法需要控制的变量有(写出1项):___________ 。
(2)实验(II)探究浓度对化学化学平衡影响。已知重铬酸钾溶液存在: (橙色)和
(橙色)和 (黄色)的平衡,如图操作,C中溶液颜色变深,D中溶液颜色变浅,
(黄色)的平衡,如图操作,C中溶液颜色变深,D中溶液颜色变浅,
①依据题意写出其中的离子方程式___________ ,
②用平衡移动原理解释D颜色变浅的原因:___________ ;
③加水稀释,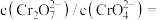
___________ (答“变大”、“变小”或“不变”)
(3)实验(III)目的是探究浓度对反应速率的影响,实验中发生反应: 。某小组也用酸性
。某小组也用酸性 溶液和草酸
溶液和草酸 溶液进行实验,实验操作及现象如下表:
溶液进行实验,实验操作及现象如下表:
①由实验i、实验ii可得出的结论是___________ 。
②关于实验i中 后溶液颜色迅速变浅的原因,该小组提出了猜想:该反应中生成的
后溶液颜色迅速变浅的原因,该小组提出了猜想:该反应中生成的 对反应有催化作用。利用提供的试剂设计实验ⅲ,验证猜想。
对反应有催化作用。利用提供的试剂设计实验ⅲ,验证猜想。
提供的试剂: 酸性
酸性 溶液,
溶液, 草酸溶液,
草酸溶液, 硫酸,
硫酸, 溶波,
溶波, 固体,蒸馏水。
固体,蒸馏水。
补全实验ⅲ的操作:向试管中先加入 酸性
酸性 溶液,
溶液,___________ ,最后加入 草酸溶液。
草酸溶液。
③基于以上实验与分析,推测实验(III)设计___________ (填“能”或“不能”)达到实验目的。

(1)利用实验(I)探究锌与
 硫酸和
硫酸和 硫酸反应的速率,可以测定收集一定体积氢气所用的时间。此方法需要控制的变量有(写出1项):
硫酸反应的速率,可以测定收集一定体积氢气所用的时间。此方法需要控制的变量有(写出1项):(2)实验(II)探究浓度对化学化学平衡影响。已知重铬酸钾溶液存在:
 (橙色)和
(橙色)和 (黄色)的平衡,如图操作,C中溶液颜色变深,D中溶液颜色变浅,
(黄色)的平衡,如图操作,C中溶液颜色变深,D中溶液颜色变浅,①依据题意写出其中的离子方程式
②用平衡移动原理解释D颜色变浅的原因:
③加水稀释,
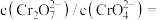
(3)实验(III)目的是探究浓度对反应速率的影响,实验中发生反应:
 。某小组也用酸性
。某小组也用酸性 溶液和草酸
溶液和草酸 溶液进行实验,实验操作及现象如下表:
溶液进行实验,实验操作及现象如下表:| 编号 | 实验操作 | 实验现象 |
| i | 向一支试管中先加入 酸性 酸性 溶液,再加入1滴 溶液,再加入1滴 硫酸和9滴蒸馏水、最后加入 硫酸和9滴蒸馏水、最后加入 草酸溶液 草酸溶液 | 前 内溶液紫色无明显变化,后颜色逐渐变浅, 内溶液紫色无明显变化,后颜色逐渐变浅, 后几乎变为无色 后几乎变为无色 |
| ii | 向另一支试管中先加入 酸性 酸性 溶液,再加入10滴 溶液,再加入10滴 硫酸,最后加入 硫酸,最后加入 草酸溶液 草酸溶液 |  内溶液紫色无明显变化,后颜色迅速变浅,约 内溶液紫色无明显变化,后颜色迅速变浅,约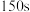 后几乎变为无色 后几乎变为无色 |
②关于实验i中
 后溶液颜色迅速变浅的原因,该小组提出了猜想:该反应中生成的
后溶液颜色迅速变浅的原因,该小组提出了猜想:该反应中生成的 对反应有催化作用。利用提供的试剂设计实验ⅲ,验证猜想。
对反应有催化作用。利用提供的试剂设计实验ⅲ,验证猜想。提供的试剂:
 酸性
酸性 溶液,
溶液, 草酸溶液,
草酸溶液, 硫酸,
硫酸, 溶波,
溶波, 固体,蒸馏水。
固体,蒸馏水。补全实验ⅲ的操作:向试管中先加入
 酸性
酸性 溶液,
溶液, 草酸溶液。
草酸溶液。③基于以上实验与分析,推测实验(III)设计
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐3】氧化还原滴定实验与酸碱中和滴定类似(用已知浓度氧化剂溶液滴定未知浓度还原剂溶液)。
I.现用0.1000mol⋅L﹣1KMnO4酸性溶液滴定未知浓度的无色H2C2O4溶液,已知:2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O。
(1)滴定实验应选用___________ (填“酸”或“碱”)式滴定管盛放高锰酸钾溶液。
(2)如何判断反应到达滴定终点?___________ 。
(3)乙学生按照滴定步骤进行了3次实验,分别记录有关数据如表;
依据表数据计算该H2C2O4溶液的物质的量浓度为___________ mol/L(保留4位有效数字)。
(4)下列操作中可能使测定结果偏低的是 ___________(填字母)。
II.某化学小组为了研究外界条件对化学反应速率的影响,利用上述反应进行了如下实验。
(5)请完成上述实验设计,其中:a=___________ ,b=___________ 。
(6)探究温度对化学反应速率的影响,应选择___________ (填实验编号),实验结论为 ___________ 。
(7)该小组同学根据经验绘制了实验②中n(Mn2+)随时间变化的趋势如图甲所示,但查阅资料发现该实验过程中n(Mn2+)随时间变化的实际趋势如图乙所示。

该小组同学根据图乙所示信息提出了新的假设,并设计以下实验方案继续进行实验。
I.该小组同学提出的假设是 ___________ 。
II.若该小组同学提出的假设成立,应观察到的现象是___________ 。
I.现用0.1000mol⋅L﹣1KMnO4酸性溶液滴定未知浓度的无色H2C2O4溶液,已知:2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O。
(1)滴定实验应选用
(2)如何判断反应到达滴定终点?
(3)乙学生按照滴定步骤进行了3次实验,分别记录有关数据如表;
| 滴定次数 | 待测H2C2O4溶液的体积/mL | 0.1000mol⋅L﹣1KMnO4的体积/mL | ||
| 滴定前刻度 | 滴定后刻度 | 溶液体积/mL | ||
| 第一次 | 25.00 | 0.00 | 26.11 | 26.11 |
| 第二次 | 25.00 | 1.56 | 30.30 | 28.74 |
| 第三次 | 25.00 | 0.22 | 26.31 | 26.09 |
(4)下列操作中可能使测定结果偏低的是 ___________(填字母)。
| A.酸式滴定管未用标准液润洗就直接注入KMnO4标准液 |
| B.滴定前盛放草酸溶液的锥形瓶用蒸馏水洗净后没有干燥 |
| C.酸式滴定管尖嘴部分在滴定前没有气泡,滴定后有气泡 |
| D.读取KMnO4标准液时,开始仰视读数,滴定结束时俯视读数 |
II.某化学小组为了研究外界条件对化学反应速率的影响,利用上述反应进行了如下实验。
| 实验编号 | 实验温度/℃ | 试管中所加试剂及其用量/mL | 溶液褪至无色所需时间/min | |||
| 0.6mol/L H2C2O4溶液 | H2O | 3mol/L H2SO4溶液 | 0.05mol/L KMnO4溶液 | |||
| ① | 25 | 3.0 | a | 2.0 | 3.0 | 1.5 |
| ② | 25 | 2.0 | 3.0 | 2.0 | 3.0 | 2.7 |
| ③ | 50 | 2.0 | b | 2.0 | 3.0 | 1.7 |
(5)请完成上述实验设计,其中:a=
(6)探究温度对化学反应速率的影响,应选择
(7)该小组同学根据经验绘制了实验②中n(Mn2+)随时间变化的趋势如图甲所示,但查阅资料发现该实验过程中n(Mn2+)随时间变化的实际趋势如图乙所示。

该小组同学根据图乙所示信息提出了新的假设,并设计以下实验方案继续进行实验。
| 实验编号 | 实验温度/℃ | 试管中所加试剂及其用量/mL | 再向试管中加入少量固体 | 溶液褪至无色所需时间/min | |||
| 0.6mol/L H2C2O4溶液 | H2O | 3mol/L H2SO4溶液 | 3mol/L H2SO4溶液 | ||||
| ④ | 25 | 2.0 | 3.0 | 2.0 | 3.0 | MnSO4 | d |
II.若该小组同学提出的假设成立,应观察到的现象是
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
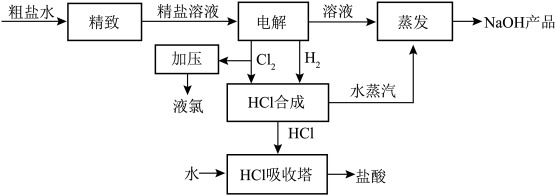
【推荐1】氯碱厂用电解饱和食盐水制取烧碱,同时制盐酸的工艺流程如下:
(1)氯气加压能得到液氯,这利用了氯气______________ 的物理性质。
(2)在HCl合成塔中是_______ 气过量。
(3)按照图示流程,为了制得100吨36.5%的盐酸,理论上需氯化钠_______ 吨。
(4)实验室制备HCl气体的化学方程式:_________ 。
(5)利用HCl合成时放出的热量来产生水蒸气,用于NaOH溶液的蒸发,这样做的优点是_______ 。
(6)氯化氢气体可做美丽的喷泉实验。标准状况下,用容积为V升的圆底烧瓶,采用排空气法收集干燥的氯化氢,所得气体的平均式量是34.625。喷泉实验后,烧瓶中的溶液的体积为____ ,物质的量浓度为___ 。
(7)某化学兴趣小组进行粗盐(含有少量氯化钙和硫酸镁杂质)提纯实验,请结合实验过程回答下列问题。
步骤一:称取10g粗盐,倒入烧杯中后加入30mL水溶解。为加快溶解速率,可采取的方法是______ (任写1种)。步骤二:依次加入稍过量的沉淀剂,充分反应后得到大量沉淀。沉淀剂加入顺序依次为(用化学式表示):__________ 。步骤三:将混合物进行过滤,取滤液进行下一步操作。步骤四:往滤液中加入适量的____ (填试剂名称),调节pH到7(用pH试纸测定),若该试剂不小心加过量,对所得到氯化钠的纯度____ (填“有”或“没有”)影响。步骤五:将滤液倒入______ 中进行加热,等到______ 时,停止加热,利用余热蒸干。步骤六:晶体转入试剂瓶中待用。在步骤三和五中,玻璃棒的作用依次是____ 、____ 。若最终得到的氯化钠固体中还含有微量的NaBr和KCl,更简单的除杂方法是______ 。已知氯元素的近似相对原子质量为35.5,由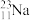 、
、 、
、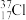 构成的11.7gNaCl中含有
构成的11.7gNaCl中含有
___ 克。
(1)氯气加压能得到液氯,这利用了氯气
(2)在HCl合成塔中是
(3)按照图示流程,为了制得100吨36.5%的盐酸,理论上需氯化钠
(4)实验室制备HCl气体的化学方程式:
(5)利用HCl合成时放出的热量来产生水蒸气,用于NaOH溶液的蒸发,这样做的优点是
(6)氯化氢气体可做美丽的喷泉实验。标准状况下,用容积为V升的圆底烧瓶,采用排空气法收集干燥的氯化氢,所得气体的平均式量是34.625。喷泉实验后,烧瓶中的溶液的体积为
(7)某化学兴趣小组进行粗盐(含有少量氯化钙和硫酸镁杂质)提纯实验,请结合实验过程回答下列问题。
步骤一:称取10g粗盐,倒入烧杯中后加入30mL水溶解。为加快溶解速率,可采取的方法是
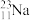 、
、 、
、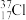 构成的11.7gNaCl中含有
构成的11.7gNaCl中含有
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐2】某兴趣小组根据金属镁与CO2的反应,推测金属钠也能与CO2发生反应,因此他们用下图所示的装置进行“钠与CO2反应”的探究(尾气处理装置略去).又知实验过程中的CO2气体为足量;设能发生的反应都进行完全;一氧化碳气体可用氯化钯(PdCl2)溶液来检验(通过溶液颜色的变化来判断)。

(1)为了使制取气体的装置能“随开随用,随关随停”,则在图中A处应选用的装置是___ (填“I”、“Ⅱ”或“Ⅲ”).若要用干燥、纯净的CO2气体与金属钠反应,则装置B中应盛放的试剂是___ 溶液。
(2)实验开始,检查装置的气密性完好并装入有关药品后,在点燃酒精喷灯前,还必须进行的实验操作是_____ 。
(3)反应完成后,装置D玻璃管中残留的固体物质可能是____ 。(填字母)
 .Na2O2 b.Na2CO3 c.NaHCO3 d.Na2CO3和C
.Na2O2 b.Na2CO3 c.NaHCO3 d.Na2CO3和C
(4)若D玻璃管中残留的固体是纯净物,则钠与CO2反应的化学方程式是_____ 。
(5)请设计合理的实验来检验某固体物质是Na2CO3.答:____ 。

(1)为了使制取气体的装置能“随开随用,随关随停”,则在图中A处应选用的装置是
(2)实验开始,检查装置的气密性完好并装入有关药品后,在点燃酒精喷灯前,还必须进行的实验操作是
(3)反应完成后,装置D玻璃管中残留的固体物质可能是
 .Na2O2 b.Na2CO3 c.NaHCO3 d.Na2CO3和C
.Na2O2 b.Na2CO3 c.NaHCO3 d.Na2CO3和C(4)若D玻璃管中残留的固体是纯净物,则钠与CO2反应的化学方程式是
(5)请设计合理的实验来检验某固体物质是Na2CO3.答:
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐3】某化学兴趣小组的同学利用下图所示实验装置进行实验(图中a、b、c表示止水夹)
(1)甲、乙两仪器的名称是____________ 、_______________ 。
(2)A、C、E相连后的装置可用于制取Cl2,写出A中发生反应的化学方程式_____________ 。
(3)B、D、E装置相连后,在B中盛装浓硝酸和铜片(铜片放在有孔塑料板上)可制得NO2并进行有关实验。
①欲用D装置验证NO2与水的反应,其操作步骤为:先关闭止水夹____________ ,再打开止水夹 ______ ,使烧杯中的水进入试管丁中。
②试管丁中的NO2与水充分反应后,若向试管内缓缓通入一定量的O2,直至试管全部充满水,则所得溶液中溶质的物质的量浓度是____ mol·L−1(保留2位有效数值,气体按标准状况计算)。

(1)甲、乙两仪器的名称是
(2)A、C、E相连后的装置可用于制取Cl2,写出A中发生反应的化学方程式
(3)B、D、E装置相连后,在B中盛装浓硝酸和铜片(铜片放在有孔塑料板上)可制得NO2并进行有关实验。
①欲用D装置验证NO2与水的反应,其操作步骤为:先关闭止水夹
②试管丁中的NO2与水充分反应后,若向试管内缓缓通入一定量的O2,直至试管全部充满水,则所得溶液中溶质的物质的量浓度是
您最近一年使用:0次



