乙醚(CH3CH2OCH2CH3)可作麻醉剂、优质溶剂,还可用于制造无烟火药。
已知:
I.乙醚是无色透明液体,微溶于水,溶于低碳醇、苯、氯仿等,密度比水小,熔点为-116.3℃,沸点为34.6℃,在空气中遇火易燃,甚至会发生爆炸。
Ⅱ.实验室制取乙醚的反应原理如下。
主反应2CH3CH2OH CH3CH2OCH2CH3+H2O
CH3CH2OCH2CH3+H2O
副反应CH3CH2OH CH2=CH2↑+H2O
CH2=CH2↑+H2O
请回答下列问题:
【乙醚制备】实验室用如图所示装置(部分装置略)制取乙醚。
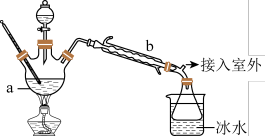
(1)仪器b应更换为下列仪器中的______ 更为恰当(填字母符号)。
(2)实验操作的正确顺序为:安装实验仪器→_______(填序号,下同)→_____→______→______→______→______→取出乙醚立即密闭保存______ 。
①加入药品
②检查装置气密性
③熄灭酒精灯
④通冷却水并加热烧瓶
⑤拆除装置
⑥控制滴加乙醇速率与馏出液速率相等
有同学认为,要确保实验安全,还需要在a中添加______ 。
(3)制备反应的温度应控制在140℃左右,其原因是______ 。实验中若滴入乙醇过快,乙醚的产率会降低,其原因可能是______ 。
【乙醚提纯】利用以下操作可对得到的粗乙醚进行提纯。

(4)操作①、②的名称分别是______ ,______ 。操作②中无水氯化镁的作用是______ 。进行该操作时,必须用水浴加热代替酒精灯加热,其目的是______ 。
已知:
I.乙醚是无色透明液体,微溶于水,溶于低碳醇、苯、氯仿等,密度比水小,熔点为-116.3℃,沸点为34.6℃,在空气中遇火易燃,甚至会发生爆炸。
Ⅱ.实验室制取乙醚的反应原理如下。
主反应2CH3CH2OH
 CH3CH2OCH2CH3+H2O
CH3CH2OCH2CH3+H2O副反应CH3CH2OH
 CH2=CH2↑+H2O
CH2=CH2↑+H2O请回答下列问题:
【乙醚制备】实验室用如图所示装置(部分装置略)制取乙醚。

(1)仪器b应更换为下列仪器中的
A. | B. | C. | D. |
①加入药品
②检查装置气密性
③熄灭酒精灯
④通冷却水并加热烧瓶
⑤拆除装置
⑥控制滴加乙醇速率与馏出液速率相等
有同学认为,要确保实验安全,还需要在a中添加
(3)制备反应的温度应控制在140℃左右,其原因是
【乙醚提纯】利用以下操作可对得到的粗乙醚进行提纯。

(4)操作①、②的名称分别是
更新时间:2023-06-02 15:33:37
|
相似题推荐
解答题-实验探究题
|
适中
(0.65)
名校
【推荐1】下面为甲、乙、丙三位同学均采取乙醇、乙酸与浓硫酸混合共热的方法制取乙酸乙酯的实验过程。
Ⅰ.装置设计:甲、乙、丙三位同学分别设计了下列三套实验装置:
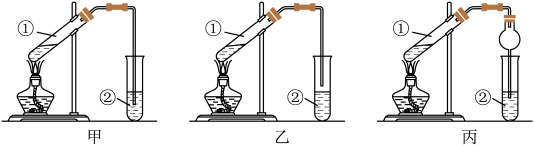
(1)请从甲、乙两位同学设计的装置中选择一种作为实验室制取乙酸乙酯的装置,不应选择的装置是___ (填“甲”或“乙”)。丙同学装置中的球形干燥管,除起冷凝作用外,另一重要作用是___ 。
Ⅱ.实验步骤:
a.按选择的装置组装仪器,在试管中先加入amLCH3CH2OH(密度为ρg/cm-3)和过量的冰醋酸(CH3COOH),并边振荡边缓缓加入2mL浓H2SO4;
b.将试管固定在铁架台上;
c.在试管②中加入适量的饱和Na2CO3溶液;
d.用酒精灯对试管①加热;
e.当观察到试管②中有明显现象时认为反应基本完成。
回答下列问题:
(2)按步骤a装好实验装置,加入药品前还应___ 。
(3)写出制取乙酸乙酯的化学反应方程式____ 。
(4)下列玻璃仪器中可用于分离试管②中的乙酸乙酯是____ (填标号)。
A.分液漏斗 B.漏斗 C.玻璃棒
Ⅲ.如图装置可用于提纯乙酸乙酯,填写下列空白。

(5)B仪器的名称是___ ,B仪器内的水流方向是___ (选答“上进下出”或“下进上出”)。
Ⅰ.装置设计:甲、乙、丙三位同学分别设计了下列三套实验装置:

(1)请从甲、乙两位同学设计的装置中选择一种作为实验室制取乙酸乙酯的装置,不应选择的装置是
Ⅱ.实验步骤:
a.按选择的装置组装仪器,在试管中先加入amLCH3CH2OH(密度为ρg/cm-3)和过量的冰醋酸(CH3COOH),并边振荡边缓缓加入2mL浓H2SO4;
b.将试管固定在铁架台上;
c.在试管②中加入适量的饱和Na2CO3溶液;
d.用酒精灯对试管①加热;
e.当观察到试管②中有明显现象时认为反应基本完成。
回答下列问题:
(2)按步骤a装好实验装置,加入药品前还应
(3)写出制取乙酸乙酯的化学反应方程式
(4)下列玻璃仪器中可用于分离试管②中的乙酸乙酯是
A.分液漏斗 B.漏斗 C.玻璃棒
Ⅲ.如图装置可用于提纯乙酸乙酯,填写下列空白。

(5)B仪器的名称是
您最近一年使用:0次
【推荐2】焦亚硫酸钠(Na2S2O5)是常用的食品抗氧化剂之一。某研究小组采用下图装置制取Na2S2O5。
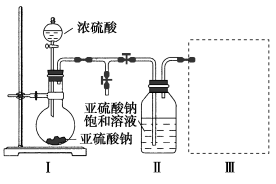
已知:①装置Ⅱ中有Na2S2O5晶体析出,发生的化学反应为:Na2SO3 +SO2=Na2S2O5。
②Na2S2O5的化学性质与Na2SO3相似。
(1)上图中盛放浓硫酸的仪器的名称为_______ 。
(2)装置Ⅰ中反应的化学方程式为_______ 。
(3)要从装置Ⅱ中获得已析出的晶体,可采取的分离方法是_______ 。
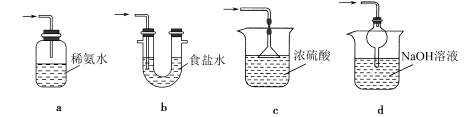
(4)装置Ⅲ用于处理尾气,最合适的装置为_______ (填字母序号)。
(5)检验 Na2S2O5晶体在空气已被氧化的实验方案是_______ 。

已知:①装置Ⅱ中有Na2S2O5晶体析出,发生的化学反应为:Na2SO3 +SO2=Na2S2O5。
②Na2S2O5的化学性质与Na2SO3相似。
(1)上图中盛放浓硫酸的仪器的名称为
(2)装置Ⅰ中反应的化学方程式为
(3)要从装置Ⅱ中获得已析出的晶体,可采取的分离方法是
(4)装置Ⅲ用于处理尾气,最合适的装置为

(5)检验 Na2S2O5晶体在空气已被氧化的实验方案是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐3】二氧化氯是一种黄绿色具有刺激性气味的气体,常用于自来水消毒和果蔬保鲜等方面。氯酸钠还原法是目前使用较为广泛的 制备方法,其中是用
制备方法,其中是用 与
与 在催化剂、
在催化剂、 时,发生反应得到
时,发生反应得到 ,下图装置(夹持装置略)对其制备、吸收、释放进行了研究。
,下图装置(夹持装置略)对其制备、吸收、释放进行了研究。
已知:
① 的浓度较大时易分解,实验室用稳定剂吸收
的浓度较大时易分解,实验室用稳定剂吸收 ,生成
,生成 ,使用时加酸只释放出
,使用时加酸只释放出 一种气体
一种气体
② 与KI反应的离子方程式为:
与KI反应的离子方程式为: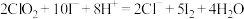 。
。
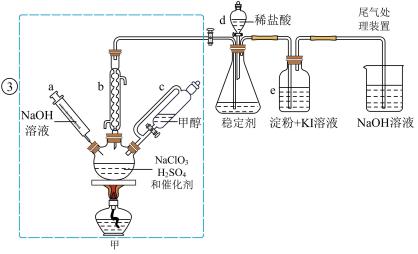
(1)仪器b在装置中的作用是______________ ;比较仪器c和d,实验中c的优点是_____________ 。
(2)制备装置甲中需改进的一项措施是________________ 。
(3)反应中甲醇被氧化为甲酸,写出制备 的化学方程式:
的化学方程式:________________ ;该制备法可选用不同的还原性物质作为还原剂,例如草酸,相比甲醇法,草酸法的优点是________________ 。
(4)下列有关说法正确的是__________ 。
A.仪器a中NaOH溶液主要用于停止反应,并吸收多余的
B.装置e主要用于检验是否有 生成
生成
C.在 释放实验中,发生的离子反应方程式是:
释放实验中,发生的离子反应方程式是: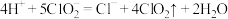
D. 和
和 都为强氧化剂,在相同条件下,等物质的量时
都为强氧化剂,在相同条件下,等物质的量时 的氧化能力是
的氧化能力是 的2.5倍
的2.5倍
(5)自来水厂用碘量法检测水中 的浓度,其实验操作如下:取100.0mL的水样,加入足量的碘化钾,再用氢氧化钠溶液调至中性,并加入淀粉溶液。再用
的浓度,其实验操作如下:取100.0mL的水样,加入足量的碘化钾,再用氢氧化钠溶液调至中性,并加入淀粉溶液。再用 标准溶液滴定碘单质
标准溶液滴定碘单质 ,达到滴定终点时用去15.00mL
,达到滴定终点时用去15.00mL 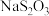 标准溶液,测得该水样中
标准溶液,测得该水样中 的含量为
的含量为__________  。
。
 制备方法,其中是用
制备方法,其中是用 与
与 在催化剂、
在催化剂、 时,发生反应得到
时,发生反应得到 ,下图装置(夹持装置略)对其制备、吸收、释放进行了研究。
,下图装置(夹持装置略)对其制备、吸收、释放进行了研究。已知:
①
 的浓度较大时易分解,实验室用稳定剂吸收
的浓度较大时易分解,实验室用稳定剂吸收 ,生成
,生成 ,使用时加酸只释放出
,使用时加酸只释放出 一种气体
一种气体②
 与KI反应的离子方程式为:
与KI反应的离子方程式为: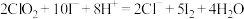 。
。| 物质 |  |  |  |
| 沸点 | 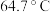 | 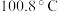 | 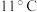 |

(1)仪器b在装置中的作用是
(2)制备装置甲中需改进的一项措施是
(3)反应中甲醇被氧化为甲酸,写出制备
 的化学方程式:
的化学方程式:(4)下列有关说法正确的是
A.仪器a中NaOH溶液主要用于停止反应,并吸收多余的

B.装置e主要用于检验是否有
 生成
生成C.在
 释放实验中,发生的离子反应方程式是:
释放实验中,发生的离子反应方程式是: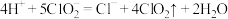
D.
 和
和 都为强氧化剂,在相同条件下,等物质的量时
都为强氧化剂,在相同条件下,等物质的量时 的氧化能力是
的氧化能力是 的2.5倍
的2.5倍(5)自来水厂用碘量法检测水中
 的浓度,其实验操作如下:取100.0mL的水样,加入足量的碘化钾,再用氢氧化钠溶液调至中性,并加入淀粉溶液。再用
的浓度,其实验操作如下:取100.0mL的水样,加入足量的碘化钾,再用氢氧化钠溶液调至中性,并加入淀粉溶液。再用 标准溶液滴定碘单质
标准溶液滴定碘单质 ,达到滴定终点时用去15.00mL
,达到滴定终点时用去15.00mL 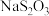 标准溶液,测得该水样中
标准溶液,测得该水样中 的含量为
的含量为 。
。
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐1】海洋植物如海带、海藻中含有丰富的碘元素,碘元素以碘离子的形式存在。实验室从海藻中提取碘的流程如下:
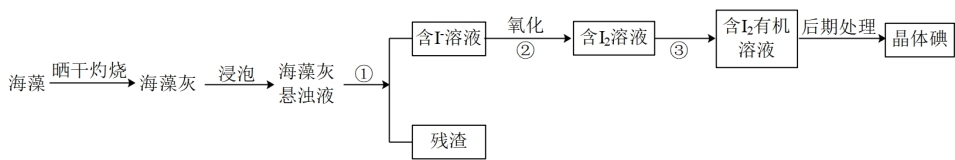
(1)写出提取碘的过程中有关实验操作的名称:①______ ;③________ 。
(2)提取碘的过程中可供选择的有机溶剂是( )
A.汽油、酒精 B.四氯化碳、汽油 C.醋酸、酒精
(3)为完成以上①、③两步操作,实验室里有烧杯、玻璃棒、铁架台、烧瓶、导管、酒精灯,尚缺少的玻璃仪器是____________________________________ 。
(4)从含碘的有机溶剂中提取碘和回收有机溶剂,还需要经过蒸馏。指出下图所示的实验装置中的错误之处:①______ ,②________ ,③________ ,④________ 。

(5)为便于控制蒸馏时的温度,操作时使用水浴加热,最后晶体碘在________ 里聚集。

(1)写出提取碘的过程中有关实验操作的名称:①
(2)提取碘的过程中可供选择的有机溶剂是
A.汽油、酒精 B.四氯化碳、汽油 C.醋酸、酒精
(3)为完成以上①、③两步操作,实验室里有烧杯、玻璃棒、铁架台、烧瓶、导管、酒精灯,尚缺少的玻璃仪器是
(4)从含碘的有机溶剂中提取碘和回收有机溶剂,还需要经过蒸馏。指出下图所示的实验装置中的错误之处:①

(5)为便于控制蒸馏时的温度,操作时使用水浴加热,最后晶体碘在
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐2】实验室用下列仪器组装一套蒸馏石油的装置,并进行蒸馏得到汽油和煤油。

(1)写出下列仪器的名称:①_______ ;②_______ ;③_______ 。
(2)将以上仪器按从左到右顺序,用字母 a、b、c…进行连接: e 接______;______接______; ______接______接______。_______
(3)仪器的 A 口是_______ ,B 口是_______ 。
(4)蒸馏时,温度计水银球应在_______ (位置)。
(5)在②中注入原油后,加几片碎瓷片的目的是_______ 。

(1)写出下列仪器的名称:①
(2)将以上仪器按从左到右顺序,用字母 a、b、c…进行连接: e 接______;______接______; ______接______接______。
(3)仪器的 A 口是
(4)蒸馏时,温度计水银球应在
(5)在②中注入原油后,加几片碎瓷片的目的是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐3】如图是中学化学中常用于混合物的分离和提纯的装置,请根据装置回答问题。

(1)从氯化钾溶液中得到氯化钾固体,选择装置______ (填代表装置图的字母,下同);除去自来水中的Cl-等杂质,选择装置________ 。
(2)从溴水中分离出Br2,选择装置_______ ,该分离方法的名称为________ 。
(3)装置A中①的名称是______ ,进水的方向是从______ (填上”或“下)口进水,装置B在操作时为使液体顺利滴下,除打开下端活塞外,还应进行的具体操作是______________ 。
(4)为了除去KCl中的Ca2+、Mg2+、 及泥沙, 得到挖净的KCl,可将混合物溶于水。然后在下到操作中选取必要的步骤和正确的操作顺序进行提纯。正确的步骤及顺序是
及泥沙, 得到挖净的KCl,可将混合物溶于水。然后在下到操作中选取必要的步骤和正确的操作顺序进行提纯。正确的步骤及顺序是_______ 。
①过滤 ②加过量NaOH溶液 ③加适量盐酸 ④加过量 Na2CO3溶液 ⑤加过量BaCl2溶液 ⑥加过量KOH溶液 ⑦加过量 K2CO3溶液
A.②⑤④①③ B.⑥⑤⑦①③ C.④①②⑤③ D.④②⑤①③

(1)从氯化钾溶液中得到氯化钾固体,选择装置
(2)从溴水中分离出Br2,选择装置
(3)装置A中①的名称是
(4)为了除去KCl中的Ca2+、Mg2+、
 及泥沙, 得到挖净的KCl,可将混合物溶于水。然后在下到操作中选取必要的步骤和正确的操作顺序进行提纯。正确的步骤及顺序是
及泥沙, 得到挖净的KCl,可将混合物溶于水。然后在下到操作中选取必要的步骤和正确的操作顺序进行提纯。正确的步骤及顺序是①过滤 ②加过量NaOH溶液 ③加适量盐酸 ④加过量 Na2CO3溶液 ⑤加过量BaCl2溶液 ⑥加过量KOH溶液 ⑦加过量 K2CO3溶液
A.②⑤④①③ B.⑥⑤⑦①③ C.④①②⑤③ D.④②⑤①③
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐1】二氧化氯( )是一种高效消毒灭菌剂,可有效灭活病毒,但其稳定性较差,故常采用
)是一种高效消毒灭菌剂,可有效灭活病毒,但其稳定性较差,故常采用 和
和 混合溶液将其吸收转化为
混合溶液将其吸收转化为 保存。现利用如图装置及试剂制备
保存。现利用如图装置及试剂制备 。
。

已知:① 的熔点为-59℃,沸点为11℃;稳定性较差,易分解,体积分数大于10%时可能爆炸;
的熔点为-59℃,沸点为11℃;稳定性较差,易分解,体积分数大于10%时可能爆炸; 极易溶于水,且在碱性环境中发生反应
极易溶于水,且在碱性环境中发生反应
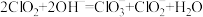 。
。
②高于60℃时 分解成
分解成 和
和 。
。
回答下列问题:
(1) 为
为 的发生装置,生成(
的发生装置,生成( 的离子方程式为
的离子方程式为____________________ 。
(2) 中发生反应的离子方程式为
中发生反应的离子方程式为______________________
(3)实验过程中通入 的目的是
的目的是______ ;实验室可用饱和 溶液、
溶液、 溶液加热制取
溶液加热制取 ,化学方程式为
,化学方程式为________________________ 。
(4)装置 中
中 不能过量的原因是
不能过量的原因是___________________________ 。
(5) 饱和溶液在温度低于38℃时析出的晶体是
饱和溶液在温度低于38℃时析出的晶体是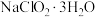 ,高于38℃时析出晶体是
,高于38℃时析出晶体是 。从
。从 溶液中获得
溶液中获得 固体的操作:
固体的操作:______________________ (须使用的试剂:无水乙醇)。
 )是一种高效消毒灭菌剂,可有效灭活病毒,但其稳定性较差,故常采用
)是一种高效消毒灭菌剂,可有效灭活病毒,但其稳定性较差,故常采用 和
和 混合溶液将其吸收转化为
混合溶液将其吸收转化为 保存。现利用如图装置及试剂制备
保存。现利用如图装置及试剂制备 。
。
已知:①
 的熔点为-59℃,沸点为11℃;稳定性较差,易分解,体积分数大于10%时可能爆炸;
的熔点为-59℃,沸点为11℃;稳定性较差,易分解,体积分数大于10%时可能爆炸; 极易溶于水,且在碱性环境中发生反应
极易溶于水,且在碱性环境中发生反应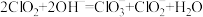 。
。②高于60℃时
 分解成
分解成 和
和 。
。回答下列问题:
(1)
 为
为 的发生装置,生成(
的发生装置,生成( 的离子方程式为
的离子方程式为(2)
 中发生反应的离子方程式为
中发生反应的离子方程式为(3)实验过程中通入
 的目的是
的目的是 溶液、
溶液、 溶液加热制取
溶液加热制取 ,化学方程式为
,化学方程式为(4)装置
 中
中 不能过量的原因是
不能过量的原因是(5)
 饱和溶液在温度低于38℃时析出的晶体是
饱和溶液在温度低于38℃时析出的晶体是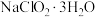 ,高于38℃时析出晶体是
,高于38℃时析出晶体是 。从
。从 溶液中获得
溶液中获得 固体的操作:
固体的操作:
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐2】从固体废料“赤泥”(含 、
、 、
、 、
、 等)中回收的
等)中回收的 可用作半导体镀层的蒸镀材料。回收过程可表示为
可用作半导体镀层的蒸镀材料。回收过程可表示为

资料:①“熔炼”过程中,单质硅和大部分单质铁转化为熔融物分离出来: 和
和 不易被C还原,且
不易被C还原,且 难溶于盐酸;草酸可与多种金属离子形成可溶性配合物。
难溶于盐酸;草酸可与多种金属离子形成可溶性配合物。
②常温下, 、
、 、
、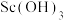 的
的 分别为
分别为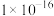 、
、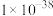 、
、 。
。
(1)“酸浸”时,滤渣的主要成分除了C之外,还有_______ (填化学式)。
(2)“氧化”时,反应的离子方程式为_______ 。
(3)常温下“调pH”时,溶液中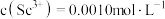 ,为了除去杂质离子,应控制的pH范围是
,为了除去杂质离子,应控制的pH范围是_______ 。
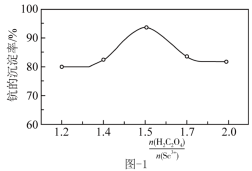
(4)“沉钪”时,发生反应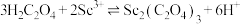 。反应过程中,测得钪的沉淀率随反应物起始物质的量比
。反应过程中,测得钪的沉淀率随反应物起始物质的量比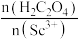 的变化如图-1所示。当
的变化如图-1所示。当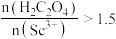 时,钪的沉淀率开始下降的原因是
时,钪的沉淀率开始下降的原因是_______ 。
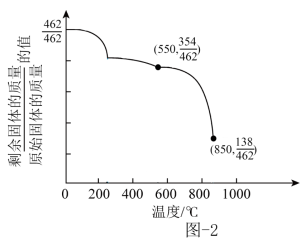
(5)草酸钪晶体[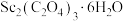 ]在加热后,固体质量随温度变化曲线如图-2所示。在550~850℃范围内,反应的化学方程式为
]在加热后,固体质量随温度变化曲线如图-2所示。在550~850℃范围内,反应的化学方程式为_______ 。
 、
、 、
、 、
、 等)中回收的
等)中回收的 可用作半导体镀层的蒸镀材料。回收过程可表示为
可用作半导体镀层的蒸镀材料。回收过程可表示为
资料:①“熔炼”过程中,单质硅和大部分单质铁转化为熔融物分离出来:
 和
和 不易被C还原,且
不易被C还原,且 难溶于盐酸;草酸可与多种金属离子形成可溶性配合物。
难溶于盐酸;草酸可与多种金属离子形成可溶性配合物。②常温下,
 、
、 、
、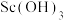 的
的 分别为
分别为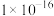 、
、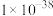 、
、 。
。(1)“酸浸”时,滤渣的主要成分除了C之外,还有
(2)“氧化”时,反应的离子方程式为
(3)常温下“调pH”时,溶液中
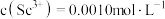 ,为了除去杂质离子,应控制的pH范围是
,为了除去杂质离子,应控制的pH范围是(4)“沉钪”时,发生反应
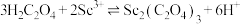 。反应过程中,测得钪的沉淀率随反应物起始物质的量比
。反应过程中,测得钪的沉淀率随反应物起始物质的量比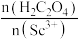 的变化如图-1所示。当
的变化如图-1所示。当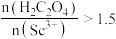 时,钪的沉淀率开始下降的原因是
时,钪的沉淀率开始下降的原因是
(5)草酸钪晶体[
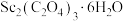 ]在加热后,固体质量随温度变化曲线如图-2所示。在550~850℃范围内,反应的化学方程式为
]在加热后,固体质量随温度变化曲线如图-2所示。在550~850℃范围内,反应的化学方程式为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐3】一氧化二氯( )是高效安全的杀菌消毒剂,某兴趣小组用下图所示装置制备并收集
)是高效安全的杀菌消毒剂,某兴趣小组用下图所示装置制备并收集 ,反应的原理如下:
,反应的原理如下: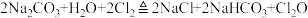 。
。
已知: 的部分性质如表所示
的部分性质如表所示
(1)装置A中仪器a的名称为______________ ,装置A中发生反应的化学方程式为______________ 。
(2)装置B中盛装的试剂的名称为______________ 。
(3)装置E采用冰水混合物冷却的目的是______________ 。
(4)装置F中无水 的作用是
的作用是______________ 。
(5)与传统消毒剂 比较,
比较, 消毒效率是
消毒效率是 的
的______________ 倍(产物视为 ,消毒效率以单位质量得到的电子数表示,结果精确到0.01)。
,消毒效率以单位质量得到的电子数表示,结果精确到0.01)。
(6)某温度下,将氯气通入G装置中,反应得到 ,
, 和
和 的混合溶液,经测定
的混合溶液,经测定 与
与 的物质的量之比为4∶1,写出该反应总的离子方程式:
的物质的量之比为4∶1,写出该反应总的离子方程式:_______________ 。
 )是高效安全的杀菌消毒剂,某兴趣小组用下图所示装置制备并收集
)是高效安全的杀菌消毒剂,某兴趣小组用下图所示装置制备并收集 ,反应的原理如下:
,反应的原理如下: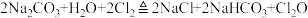 。
。已知:
 的部分性质如表所示
的部分性质如表所示| 物理性质 | 化学性质 |
常温下, 是棕黄色、有刺激性气味的气体;熔点:-120.6℃;沸点2.0℃ 是棕黄色、有刺激性气味的气体;熔点:-120.6℃;沸点2.0℃ |  易溶于水,同时与水反应生成 易溶于水,同时与水反应生成 |
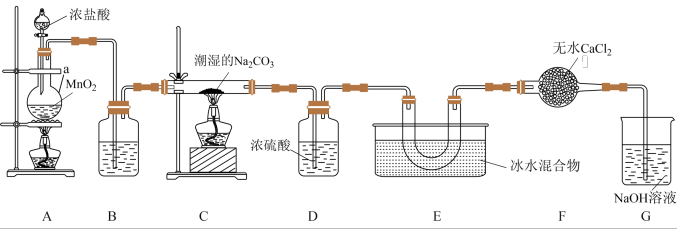
(1)装置A中仪器a的名称为
(2)装置B中盛装的试剂的名称为
(3)装置E采用冰水混合物冷却的目的是
(4)装置F中无水
 的作用是
的作用是(5)与传统消毒剂
 比较,
比较, 消毒效率是
消毒效率是 的
的 ,消毒效率以单位质量得到的电子数表示,结果精确到0.01)。
,消毒效率以单位质量得到的电子数表示,结果精确到0.01)。(6)某温度下,将氯气通入G装置中,反应得到
 ,
, 和
和 的混合溶液,经测定
的混合溶液,经测定 与
与 的物质的量之比为4∶1,写出该反应总的离子方程式:
的物质的量之比为4∶1,写出该反应总的离子方程式:
您最近一年使用:0次



