25 ℃时,0.10 mol·L-1HA溶液中有1%的HA电离,则HA的电离平衡常数Ka为___________ 。
23-24高二上·全国·课时练习 查看更多[1]
更新时间:2023-08-15 09:25:05
|
【知识点】 弱电解质的电离平衡常数
相似题推荐
填空题
|
适中
(0.65)
【推荐1】化学工业为疫情防控提供了强有力的物质支撑。氯的许多化合物既是重要化工原料,又是高效、广谱的灭菌消毒剂。回答下列问题:
(1)氯气是制备系列含氯化合物的主要原料,可采用如图(a)所示的装置来制取。装置中的离子膜只允许___________ 离子通过,氯气的逸出口是___________ (填标号)。

(2)次氯酸为一元弱酸,具有漂白和杀菌作用,其电离平衡体系中各成分的组成分数δ[δ(X)=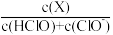 ,X为HClO或ClO−]与pH的关系如图(b)所示。HClO的电离常数Ka值为
,X为HClO或ClO−]与pH的关系如图(b)所示。HClO的电离常数Ka值为___________ 。
(3)Cl2O为淡棕黄色气体,是次氯酸的酸酐,可由新制的HgO和Cl2反应来制备,该反应为歧化反应(氧化剂和还原剂为同一种物质的反应)。上述制备Cl2O的化学方程式为___________ 。
(4)ClO2常温下为黄色气体,易溶于水,其水溶液是一种广谱杀菌剂。一种有效成分为NaClO2、NaHSO4、NaHCO3的“二氧化氯泡腾片”,能快速溶于水,溢出大量气泡,得到ClO2溶液。上述过程中,生成ClO2的反应属于歧化反应,每生成1molClO2消耗NaClO2的量为___________ mol;产生“气泡”的化学方程式为___________ 。
(1)氯气是制备系列含氯化合物的主要原料,可采用如图(a)所示的装置来制取。装置中的离子膜只允许

(2)次氯酸为一元弱酸,具有漂白和杀菌作用,其电离平衡体系中各成分的组成分数δ[δ(X)=
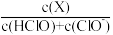 ,X为HClO或ClO−]与pH的关系如图(b)所示。HClO的电离常数Ka值为
,X为HClO或ClO−]与pH的关系如图(b)所示。HClO的电离常数Ka值为(3)Cl2O为淡棕黄色气体,是次氯酸的酸酐,可由新制的HgO和Cl2反应来制备,该反应为歧化反应(氧化剂和还原剂为同一种物质的反应)。上述制备Cl2O的化学方程式为
(4)ClO2常温下为黄色气体,易溶于水,其水溶液是一种广谱杀菌剂。一种有效成分为NaClO2、NaHSO4、NaHCO3的“二氧化氯泡腾片”,能快速溶于水,溢出大量气泡,得到ClO2溶液。上述过程中,生成ClO2的反应属于歧化反应,每生成1molClO2消耗NaClO2的量为
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】完成下列问题。
(1)已知常温下,在NaHSO3溶液中c(H2SO3)<c( ),且H2SO3的电离平衡常数为K1=1.5×10-2,K2=1.1×10-7;氨水的电离平衡常数为K=1.8×10-5.则等物质的量浓度的下列五种溶液:①NH3·H2O②(NH4)2SO3③KHSO3④K2SO3⑤H2SO3,其中水的电离程度由大到小排列顺序为
),且H2SO3的电离平衡常数为K1=1.5×10-2,K2=1.1×10-7;氨水的电离平衡常数为K=1.8×10-5.则等物质的量浓度的下列五种溶液:①NH3·H2O②(NH4)2SO3③KHSO3④K2SO3⑤H2SO3,其中水的电离程度由大到小排列顺序为_______ (填序号)。
(2)已知H2CO3的电离常数K1=4.3×10-7,K2=5.6×10-11。下列微粒可以大量共存的是_______ (填字母)。
a. 、
、 b.
b. 、
、 c.
c. 、
、 d.H2SO3、
d.H2SO3、
(3)CuSO4·5H2O的含量(含杂质Fe3+)通常利用“间接碘量法”测定。已知Cu2+与F-不反应,而Fe3+与F-反应生成FeF ,氧化性I2>FeF
,氧化性I2>FeF ;I2+2Na2S2O3=2NaI+Na2S4O6。步骤如下:
;I2+2Na2S2O3=2NaI+Na2S4O6。步骤如下:
①称取1.250g产品配成100mL溶液。
②取其中25.00mL溶液,加入足量的NaF溶液后,滴加KI溶液至不再产生沉淀。
③用0.1000mol·L-1Na2S2O3标准溶液滴定,平行滴定3次。
步骤②中,若不加足量的NaF溶液,最终的测量值将_______ (填“偏大”“偏小”或“无影响”)。滴加KI溶液,有白色碘化物沉淀生成,反应的离子方程式为_______ ;若Na2S2O3标准溶液的平均用量为10.00mL,则胆矾产品纯度为_______ %。
(1)已知常温下,在NaHSO3溶液中c(H2SO3)<c(
 ),且H2SO3的电离平衡常数为K1=1.5×10-2,K2=1.1×10-7;氨水的电离平衡常数为K=1.8×10-5.则等物质的量浓度的下列五种溶液:①NH3·H2O②(NH4)2SO3③KHSO3④K2SO3⑤H2SO3,其中水的电离程度由大到小排列顺序为
),且H2SO3的电离平衡常数为K1=1.5×10-2,K2=1.1×10-7;氨水的电离平衡常数为K=1.8×10-5.则等物质的量浓度的下列五种溶液:①NH3·H2O②(NH4)2SO3③KHSO3④K2SO3⑤H2SO3,其中水的电离程度由大到小排列顺序为(2)已知H2CO3的电离常数K1=4.3×10-7,K2=5.6×10-11。下列微粒可以大量共存的是
a.
 、
、 b.
b. 、
、 c.
c. 、
、 d.H2SO3、
d.H2SO3、
(3)CuSO4·5H2O的含量(含杂质Fe3+)通常利用“间接碘量法”测定。已知Cu2+与F-不反应,而Fe3+与F-反应生成FeF
 ,氧化性I2>FeF
,氧化性I2>FeF ;I2+2Na2S2O3=2NaI+Na2S4O6。步骤如下:
;I2+2Na2S2O3=2NaI+Na2S4O6。步骤如下:①称取1.250g产品配成100mL溶液。
②取其中25.00mL溶液,加入足量的NaF溶液后,滴加KI溶液至不再产生沉淀。
③用0.1000mol·L-1Na2S2O3标准溶液滴定,平行滴定3次。
步骤②中,若不加足量的NaF溶液,最终的测量值将
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐3】在常温25℃下,回答下列问题:
(1) 的水解常数
的水解常数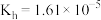 。含等物质的量浓度的
。含等物质的量浓度的 与
与 的混合溶液显
的混合溶液显___________ (填“酸”“碱”或“中”)性,该溶液中各离子浓度由大到小的顺序为___________ 。
(2) 可用氨水吸收生成
可用氨水吸收生成 ,将
,将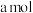
 溶于水,溶液显酸性,原因是
溶于水,溶液显酸性,原因是___________ (用离子方程式表示)。向该溶液滴加b L氨水后溶液呈中性,则滴加氨水的过程中水的电离平衡将___________ (填“正向”“不”或“逆向”)移动,所滴加氨水的浓度为___________  (
( 的电离平衡常数取
的电离平衡常数取 )。
)。
(3)向氨水中加入 稀硫酸至溶液正好呈中性,则
稀硫酸至溶液正好呈中性,则
___________ (填“>”“<”或“=”)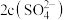 ,此时混合溶液中
,此时混合溶液中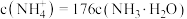 ,则
,则 的电离常数
的电离常数 为
为___________ 。
(1)
 的水解常数
的水解常数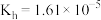 。含等物质的量浓度的
。含等物质的量浓度的 与
与 的混合溶液显
的混合溶液显(2)
 可用氨水吸收生成
可用氨水吸收生成 ,将
,将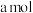
 溶于水,溶液显酸性,原因是
溶于水,溶液显酸性,原因是 (
( 的电离平衡常数取
的电离平衡常数取 )。
)。(3)向氨水中加入
 稀硫酸至溶液正好呈中性,则
稀硫酸至溶液正好呈中性,则
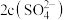 ,此时混合溶液中
,此时混合溶液中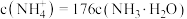 ,则
,则 的电离常数
的电离常数 为
为
您最近一年使用:0次



