完成下列问题。
(1)甲、乙两瓶氨水的浓度分别为1 mol·L-1和0.1 mol·L-1,则甲、乙两瓶氨水中c平(OH-)之比___________ (填“大于”“等于”或“小于”)10,请说明理由:____________________ 。
(2)常温下,将pH=10的NH3·H2O溶液稀释至原体积的10倍。
①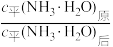
___________ 10(填“>”“<”或“=”,下同)。
②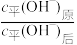
__________ 10。
③pH值范围是___________ 。
(1)甲、乙两瓶氨水的浓度分别为1 mol·L-1和0.1 mol·L-1,则甲、乙两瓶氨水中c平(OH-)之比
(2)常温下,将pH=10的NH3·H2O溶液稀释至原体积的10倍。
①
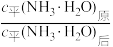
②
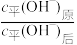
③pH值范围是
更新时间:2023-08-27 08:20:03
|
【知识点】 一元强酸与一元弱酸的比较解读
相似题推荐
填空题
|
适中
(0.65)
【推荐1】在等体积的pH值相等盐酸与醋酸溶液中,各加水稀释100倍,结果盐酸与醋酸的pH值_________ (填“相等”或“不等”)
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐2】食醋是日常饮食中的一种重要的调味剂,其主要成分是乙酸(CH3COOH)。
(1)用0.1mol·L-1 NaOH溶液分别滴定20.00mL浓度均为0.1mol·L-1的盐酸和醋酸溶液,得到溶液pH随加入NaOH溶液体积而变化的两条滴定曲线。
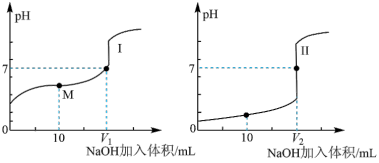
①滴定醋酸的曲线是___________ (填“I”或“Ⅱ”)。
②滴定开始前,三种溶液中由水电离出的c(H+)最大的是___________ 。
③V1和V2的关系:V1___________ V2(“>”、“=”或“<”)。
④M点对应的溶液中各离子 的物质的量浓度由大到小的顺序是___________ 。
(2)国家标准规定酿造食醋中醋酸含量标准为3.5~5.0g/100mL。将食用白醋稀释至原浓度的十分之一 得待测白醋溶液。用0.10mol·L-1标准NaOH溶液滴定某品牌白醋样品的数据如下。
①用酚酞做指示剂,滴定终点的现象是___________ 。
②按表中数据处理,转换为原市售白醋中醋酸的含量为___________ g/100mL(保留两位有效数字),可知该白醋符合国家标准。
③若测定结果偏高,其原因可能是___________ (填字母序号)。
A.滴定过程中振摇时锥形瓶中有液滴溅出
B.碱式滴定管未用标准NaOH溶液润洗就直接注入标准NaOH溶液
C.碱式滴定管的尖嘴在滴定前有气泡,滴定后气泡消失
(1)用0.1mol·L-1 NaOH溶液分别滴定20.00mL浓度均为0.1mol·L-1的盐酸和醋酸溶液,得到溶液pH随加入NaOH溶液体积而变化的两条滴定曲线。

①滴定醋酸的曲线是
②滴定开始前,三种溶液中由水电离出的c(H+)最大的是
③V1和V2的关系:V1
④M点对应的溶液中各
(2)国家标准规定酿造食醋中醋酸含量标准为3.5~5.0g/100mL。将食用白醋稀释至原浓度的
| 滴定次数 | 1 | 2 | 3 |
| V(样品)/mL | 20.00 | 20.00 | 20.00 |
| V消耗(NaOH)/mL | 15.00 | 15.04 | 14.96 |
②按表中数据处理,转换为原市售白醋中醋酸的含量为
③若测定结果偏高,其原因可能是
A.滴定过程中振摇时锥形瓶中有液滴溅出
B.碱式滴定管未用标准NaOH溶液润洗就直接注入标准NaOH溶液
C.碱式滴定管的尖嘴在滴定前有气泡,滴定后气泡消失
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐3】已知水在25℃和95℃时的电离平衡曲线如图所示:
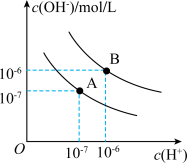
(1)25℃时水的电离平衡曲线应为“A”还是“B”_______ ?并说明理由___________ 。
(2)95℃时,将 的NaOH溶液与
的NaOH溶液与 的
的 溶液混合,若所得混合溶液的
溶液混合,若所得混合溶液的 ,则NaOH溶液与
,则NaOH溶液与 溶液的体积比
溶液的体积比___________ 。
(3)95℃时,某溶液由水电离出 的浓度为
的浓度为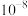 ,则该溶液的
,则该溶液的
___________ 。
(4)在一定温度下,有以下三种酸:a.醋酸b.硫酸c.盐酸。当三种酸的pH相同、体积相同时,分别加入足量的锌,产生 的体积(相同状况)由大到小的顺序为
的体积(相同状况)由大到小的顺序为___________ 。
(5)明矾是常用的一种净水剂,用离子方程式和相应的文字叙述解释其净水的原理:___________ 。
(6)铵盐是重要的化肥, 溶液中离子浓度大小顺序是
溶液中离子浓度大小顺序是___________ 。

(1)25℃时水的电离平衡曲线应为“A”还是“B”
(2)95℃时,将
 的NaOH溶液与
的NaOH溶液与 的
的 溶液混合,若所得混合溶液的
溶液混合,若所得混合溶液的 ,则NaOH溶液与
,则NaOH溶液与 溶液的体积比
溶液的体积比(3)95℃时,某溶液由水电离出
 的浓度为
的浓度为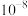 ,则该溶液的
,则该溶液的
(4)在一定温度下,有以下三种酸:a.醋酸b.硫酸c.盐酸。当三种酸的pH相同、体积相同时,分别加入足量的锌,产生
 的体积(相同状况)由大到小的顺序为
的体积(相同状况)由大到小的顺序为(5)明矾是常用的一种净水剂,用离子方程式和相应的文字叙述解释其净水的原理:
(6)铵盐是重要的化肥,
 溶液中离子浓度大小顺序是
溶液中离子浓度大小顺序是
您最近一年使用:0次



