食醋是日常饮食中的一种重要的调味剂,其主要成分是乙酸(CH3COOH)。
(1)用0.1mol·L-1 NaOH溶液分别滴定20.00mL浓度均为0.1mol·L-1的盐酸和醋酸溶液,得到溶液pH随加入NaOH溶液体积而变化的两条滴定曲线。
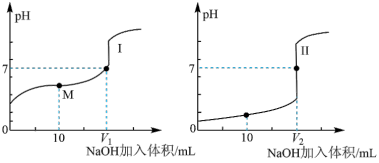
①滴定醋酸的曲线是___________ (填“I”或“Ⅱ”)。
②滴定开始前,三种溶液中由水电离出的c(H+)最大的是___________ 。
③V1和V2的关系:V1___________ V2(“>”、“=”或“<”)。
④M点对应的溶液中各离子 的物质的量浓度由大到小的顺序是___________ 。
(2)国家标准规定酿造食醋中醋酸含量标准为3.5~5.0g/100mL。将食用白醋稀释至原浓度的十分之一 得待测白醋溶液。用0.10mol·L-1标准NaOH溶液滴定某品牌白醋样品的数据如下。
①用酚酞做指示剂,滴定终点的现象是___________ 。
②按表中数据处理,转换为原市售白醋中醋酸的含量为___________ g/100mL(保留两位有效数字),可知该白醋符合国家标准。
③若测定结果偏高,其原因可能是___________ (填字母序号)。
A.滴定过程中振摇时锥形瓶中有液滴溅出
B.碱式滴定管未用标准NaOH溶液润洗就直接注入标准NaOH溶液
C.碱式滴定管的尖嘴在滴定前有气泡,滴定后气泡消失
(1)用0.1mol·L-1 NaOH溶液分别滴定20.00mL浓度均为0.1mol·L-1的盐酸和醋酸溶液,得到溶液pH随加入NaOH溶液体积而变化的两条滴定曲线。

①滴定醋酸的曲线是
②滴定开始前,三种溶液中由水电离出的c(H+)最大的是
③V1和V2的关系:V1
④M点对应的溶液中各
(2)国家标准规定酿造食醋中醋酸含量标准为3.5~5.0g/100mL。将食用白醋稀释至原浓度的
| 滴定次数 | 1 | 2 | 3 |
| V(样品)/mL | 20.00 | 20.00 | 20.00 |
| V消耗(NaOH)/mL | 15.00 | 15.04 | 14.96 |
②按表中数据处理,转换为原市售白醋中醋酸的含量为
③若测定结果偏高,其原因可能是
A.滴定过程中振摇时锥形瓶中有液滴溅出
B.碱式滴定管未用标准NaOH溶液润洗就直接注入标准NaOH溶液
C.碱式滴定管的尖嘴在滴定前有气泡,滴定后气泡消失
更新时间:2024-01-25 09:57:47
|
相似题推荐
填空题
|
适中
(0.65)
【推荐1】亚硝酰氯(NOCl)的沸点为-5.5℃,易水解生成两种酸,常用于有机合成。学习小组在实验室中对NO与 制备NOCl的反应进行了探究。回答下列问题:
制备NOCl的反应进行了探究。回答下列问题:
(1)出于安全和环保考虑,制备反应的实验操作需在______ (条件)下进行。
(2)NO与 反应,装置如图所示(已知
反应,装置如图所示(已知 溶液可以吸收NO)。
溶液可以吸收NO)。
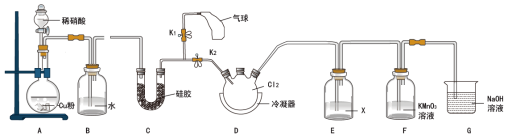
①关闭 ,打开
,打开 和分液漏斗活塞,至气球膨胀,目的为
和分液漏斗活塞,至气球膨胀,目的为______ ;连接B的目的为______ 。
②关闭 ,打开
,打开 ,向D中通入气体,至黄绿色完全消失。D中反应的化学方程式为
,向D中通入气体,至黄绿色完全消失。D中反应的化学方程式为______ 。
(3)装置E中的试剂X为______ ,作用为______ 。
(4)测定NOCl的纯度。
已知:实验前,D中 的体积为
的体积为 (已换算为标准状况)。取实验后D中所得溶液,加入适当过量NaI溶液,酸化后充分反应(杂质不参加反应,还原产物为NO);以淀粉为指示剂,用
(已换算为标准状况)。取实验后D中所得溶液,加入适当过量NaI溶液,酸化后充分反应(杂质不参加反应,还原产物为NO);以淀粉为指示剂,用 标准液滴定,达到滴定终点时消耗标准液体积为
标准液滴定,达到滴定终点时消耗标准液体积为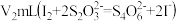 。
。
①NaI发生反应的离子方程式为______ 。
②本实验中NOCl的产率为______ 。
 制备NOCl的反应进行了探究。回答下列问题:
制备NOCl的反应进行了探究。回答下列问题:(1)出于安全和环保考虑,制备反应的实验操作需在
(2)NO与
 反应,装置如图所示(已知
反应,装置如图所示(已知 溶液可以吸收NO)。
溶液可以吸收NO)。
①关闭
 ,打开
,打开 和分液漏斗活塞,至气球膨胀,目的为
和分液漏斗活塞,至气球膨胀,目的为②关闭
 ,打开
,打开 ,向D中通入气体,至黄绿色完全消失。D中反应的化学方程式为
,向D中通入气体,至黄绿色完全消失。D中反应的化学方程式为(3)装置E中的试剂X为
(4)测定NOCl的纯度。
已知:实验前,D中
 的体积为
的体积为 (已换算为标准状况)。取实验后D中所得溶液,加入适当过量NaI溶液,酸化后充分反应(杂质不参加反应,还原产物为NO);以淀粉为指示剂,用
(已换算为标准状况)。取实验后D中所得溶液,加入适当过量NaI溶液,酸化后充分反应(杂质不参加反应,还原产物为NO);以淀粉为指示剂,用 标准液滴定,达到滴定终点时消耗标准液体积为
标准液滴定,达到滴定终点时消耗标准液体积为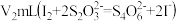 。
。①NaI发生反应的离子方程式为
②本实验中NOCl的产率为
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】以黄铁矿(主要成分为FeS2)为原料生产硫酸,应资源化综合利用产出的炉渣(主要含Fe2O3)和尾气,减轻对环境的污染。
(1)煅烧黄铁矿的化学方程式为___________ 。
(2)将尾气净化所得SO2,边搅拌边通入NaOH溶液中制备NaHSO3溶液。溶液中H2SO3、HSO 、SO
、SO 随pH的分布如图所示,要得到较为纯净的 NaHSO3溶液,应采取的实验操作为
随pH的分布如图所示,要得到较为纯净的 NaHSO3溶液,应采取的实验操作为___________ 。
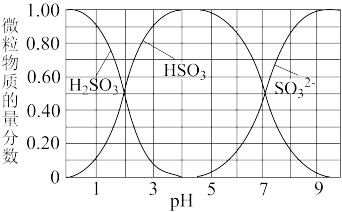
(3)焦亚硫酸钠(Na2S2O5)与强酸反应放出SO2,加热NaHSO3溶液可制备焦亚硫酸钠,所得产品中可能含有Na2SO4.检验产品中是否含有SO 的操作为
的操作为___________ 。
(4)炉渣中的Fe2O3可制备还原铁粉。还原铁粉纯度可通过下列方法测定:称取0.280 0 g 样品,溶于过量稀硫酸,平行三次用标准K2Cr2O7溶液滴定所得溶液中的Fe2+,平均 消耗0.030 00 mol·L-1的K2Cr2O7溶液25.10 mL (测定过程中杂质不参与反应)。
① 写出滴定反应的离子方程式___________ 。
② 计算还原铁粉的纯度(写出计算过程)______ 。
(1)煅烧黄铁矿的化学方程式为
(2)将尾气净化所得SO2,边搅拌边通入NaOH溶液中制备NaHSO3溶液。溶液中H2SO3、HSO
 、SO
、SO 随pH的分布如图所示,要得到较为纯净的 NaHSO3溶液,应采取的实验操作为
随pH的分布如图所示,要得到较为纯净的 NaHSO3溶液,应采取的实验操作为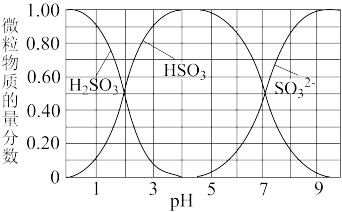
(3)焦亚硫酸钠(Na2S2O5)与强酸反应放出SO2,加热NaHSO3溶液可制备焦亚硫酸钠,所得产品中可能含有Na2SO4.检验产品中是否含有SO
 的操作为
的操作为(4)炉渣中的Fe2O3可制备还原铁粉。还原铁粉纯度可通过下列方法测定:称取0.280 0 g 样品,溶于过量稀硫酸,平行三次用标准K2Cr2O7溶液滴定所得溶液中的Fe2+,平均 消耗0.030 00 mol·L-1的K2Cr2O7溶液25.10 mL (测定过程中杂质不参与反应)。
① 写出滴定反应的离子方程式
② 计算还原铁粉的纯度(写出计算过程)
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐3】水溶液中的离子反应与平衡在生产和生活中有广泛的用途。回答下列问题:
(1)碳酸( )、次氯酸(HClO)的电离平衡常数如表:
)、次氯酸(HClO)的电离平衡常数如表:
将少量 气体通入NaClO溶液中,反应的离子方程式为
气体通入NaClO溶液中,反应的离子方程式为_______ 。
(2)某同学在两个相同的特制容器中分别加入20 mL 0.4 mol·L⁻¹ 溶液和40 mL 0.2 mol·L⁻¹
溶液和40 mL 0.2 mol·L⁻¹ 溶液,再分别用0.4 mol·L⁻¹的盐酸滴定,利用pH计和压强传感器检测,得到如图变化曲线。
溶液,再分别用0.4 mol·L⁻¹的盐酸滴定,利用pH计和压强传感器检测,得到如图变化曲线。
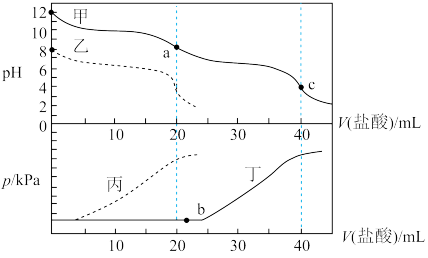
下列说法正确的是_______(填字母)。
(3)在25℃下,将a mol·L⁻¹的氨水与0.01 mol·L⁻¹的盐酸等体积混合,反应平衡时溶液中 ,则溶液显
,则溶液显_______ (填“酸”“碱”或“中”)性;用含a的代数式表示 的电离常数
的电离常数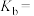
_______ 。
(4)在一定温度下,用NaOH溶液将 转化为
转化为 溶液,实验测得
溶液,实验测得 溶液中
溶液中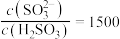 ,则该溶液的pH为
,则该溶液的pH为_______ (已知:该温度下 的
的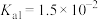 ,
, )。
)。
(1)碳酸(
 )、次氯酸(HClO)的电离平衡常数如表:
)、次氯酸(HClO)的电离平衡常数如表:| 弱酸 |  | HClO |
| 电离平衡常数(25℃) | 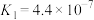  | 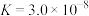 |
将少量
 气体通入NaClO溶液中,反应的离子方程式为
气体通入NaClO溶液中,反应的离子方程式为(2)某同学在两个相同的特制容器中分别加入20 mL 0.4 mol·L⁻¹
 溶液和40 mL 0.2 mol·L⁻¹
溶液和40 mL 0.2 mol·L⁻¹ 溶液,再分别用0.4 mol·L⁻¹的盐酸滴定,利用pH计和压强传感器检测,得到如图变化曲线。
溶液,再分别用0.4 mol·L⁻¹的盐酸滴定,利用pH计和压强传感器检测,得到如图变化曲线。
下列说法正确的是_______(填字母)。
A. 溶液和 溶液和 溶液中微粒种类相同 溶液中微粒种类相同 |
B.图中曲线甲和丁表示向 溶液中滴加盐酸 溶液中滴加盐酸 |
C.在b点发生反应的离子方程式为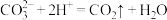 |
| D.滴定分析时,a点可用酚酞、c点可用甲基橙作指示剂指示滴定终点 |
 ,则溶液显
,则溶液显 的电离常数
的电离常数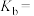
(4)在一定温度下,用NaOH溶液将
 转化为
转化为 溶液,实验测得
溶液,实验测得 溶液中
溶液中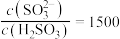 ,则该溶液的pH为
,则该溶液的pH为 的
的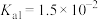 ,
, )。
)。
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐1】室温下向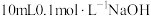 溶液中逐滴加入
溶液中逐滴加入 的一元酸
的一元酸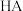 溶液,溶液
溶液,溶液 的变化曲线如图所示。
的变化曲线如图所示。
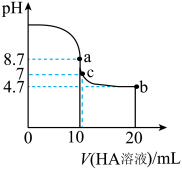
(1) 点(横坐标为10)所示溶液中,溶质是
点(横坐标为10)所示溶液中,溶质是________ ,溶液中各离子浓度从大到小的顺序为________ ,其中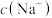
________ (填“>”“<”或“=”)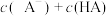 。
。
(2) 点所示溶液中,
点所示溶液中,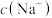
________ (填“>”“<”或“=”) 。
。
(3) 点所示溶液中,
点所示溶液中,
________ (填“>”“<”或“=”) 。
。
(4) 、
、 、
、 点所示溶液中,水的电离程度最大的是
点所示溶液中,水的电离程度最大的是________ 。
(5)以下滴定操作会导致 (
(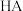 溶液)偏大的是________。
溶液)偏大的是________。
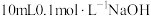 溶液中逐滴加入
溶液中逐滴加入 的一元酸
的一元酸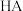 溶液,溶液
溶液,溶液 的变化曲线如图所示。
的变化曲线如图所示。
(1)
 点(横坐标为10)所示溶液中,溶质是
点(横坐标为10)所示溶液中,溶质是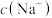
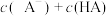 。
。(2)
 点所示溶液中,
点所示溶液中,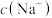
 。
。(3)
 点所示溶液中,
点所示溶液中,
 。
。(4)
 、
、 、
、 点所示溶液中,水的电离程度最大的是
点所示溶液中,水的电离程度最大的是(5)以下滴定操作会导致
 (
(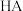 溶液)偏大的是________。
溶液)偏大的是________。| A.滴定管滴定前有气泡,滴定后气泡消失 |
| B.锥形瓶洗涤后没有干燥 |
| C.滴定时锥形瓶中有液体溅出 |
| D.滴定开始前读数时平视,滴定终点读数时俯视 |
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】某学生欲用已知物质的量浓度的盐酸来测定未知物质的量浓度的NaOH溶液时,选择酚酞作指示剂。请填写下列空白:
(1)终点的判断:溶液由_______ 。
(2)下列操作中可能使所测NaOH溶液的浓度数值偏低的是( )
A.酸式滴定管未用标准盐酸润洗就直接注入标准盐酸
B.滴定前盛放NaOH溶液的锥形瓶用蒸馏水洗净后没有干燥
C.酸式滴定管在滴定前有气泡,滴定后气泡消失
D.读取盐酸体积时,开始仰视读数,滴定结束时俯视读数
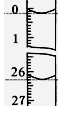
(3)若滴定开始和结束时,酸式滴定管中的液面如图所示,则所用盐酸溶液的体积为_______ mL。
(4)某学生根据3次实验分别记录有关数据如表:
②依据上表数据列式计算该NaOH溶液的物质的量浓度_______ (计算结果取4位有效数)。
(1)终点的判断:溶液由
(2)下列操作中可能使所测NaOH溶液的浓度数值偏低的是
A.酸式滴定管未用标准盐酸润洗就直接注入标准盐酸
B.滴定前盛放NaOH溶液的锥形瓶用蒸馏水洗净后没有干燥
C.酸式滴定管在滴定前有气泡,滴定后气泡消失
D.读取盐酸体积时,开始仰视读数,滴定结束时俯视读数
(3)若滴定开始和结束时,酸式滴定管中的液面如图所示,则所用盐酸溶液的体积为

(4)某学生根据3次实验分别记录有关数据如表:
| 滴定 次数 | 待测NaOH溶液的体积/mL | 0.1000 mol/L盐酸的体积/mL | ||
| 滴定前刻度 | 滴定后刻度 | 平均耗用盐酸 体积/mL | ||
| 第一次 | 25.00 | 0.00 | 26.15 | ①V= |
| 第二次 | 25.00 | 0.56 | 30.30 | |
| 第三次 | 25.00 | 0.20 | 26.45 | |
②依据上表数据列式计算该NaOH溶液的物质的量浓度
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐3】25℃时,部分物质的电离平衡常数如表所示:
请回答下列问题:
(1)HCOOH、H2CO3、HCN的酸性由强到弱的顺序为___________ 。
(2)向Na2CO3溶液中加入足量HCN,反应的离子方程式为___________ 。
(3)写出HCOONa溶液中的电荷守恒式___________ 。
(4)为了测定一元酸HCOOH溶液的浓度,现取25.00mLHCOOH溶液,用1.00mol/L的NaOH标准溶液滴定:
①用NaOH固体配置100mL,1.00mol/L的NaOH溶液,需要用到的仪器除托盘天平,药匙,烧杯,玻璃棒,胶头滴管,还必须要___________ 。
②实验过程中,将25.00mLHCOOH放入锥形瓶,滴入酚酞2-3滴;NaOH溶液应装___________ 入(填“酸式滴定管”或“碱式滴定管”);滴定过程中,眼睛应注视___________ 。
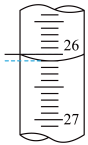
③连续滴定3次,若其中一次滴定结束时,滴定管中的液面如图所示,则终点读数为___________ mL。
④某学生根据3次实验分别记录有关数据如下表:
依据上表数据计算该HCOOH溶液的物质的量浓度为___________ mol/L(计算结果保留到小数点后两位)。
⑤下列操作中可能使所测HCOOH溶液的浓度数值偏低的是___________ (填字母)。
A.滴定前,用待测液润洗锥形瓶
B.一滴标准溶液附在锥形瓶壁上未洗下
C.选用甲基橙作指示剂
D.配置NaOH溶液时,称量NaOH固体速度过慢
E.读取NaOH溶液体积时,开始仰视读数,滴定结束时俯视读数
| 化学式 | HCOOH | H2CO3 | HCN |
| 电离平衡常数 | 1.5×10-4 | Ka1=4.2×10-7 Ka2=4.9×10-11 | 3.0×10-8 |
(1)HCOOH、H2CO3、HCN的酸性由强到弱的顺序为
(2)向Na2CO3溶液中加入足量HCN,反应的离子方程式为
(3)写出HCOONa溶液中的电荷守恒式
(4)为了测定一元酸HCOOH溶液的浓度,现取25.00mLHCOOH溶液,用1.00mol/L的NaOH标准溶液滴定:
①用NaOH固体配置100mL,1.00mol/L的NaOH溶液,需要用到的仪器除托盘天平,药匙,烧杯,玻璃棒,胶头滴管,还必须要
②实验过程中,将25.00mLHCOOH放入锥形瓶,滴入酚酞2-3滴;NaOH溶液应装
③连续滴定3次,若其中一次滴定结束时,滴定管中的液面如图所示,则终点读数为

④某学生根据3次实验分别记录有关数据如下表:
| 实验序号 | 待测HCOOH溶液体积/mL | 1.00mol/LNaOH的体积/mL | ||
| 滴定前刻度 | 滴定后刻度 | 溶液的体积 | ||
| 1 | 25.00 | 0.00 | 12.49 | V1 |
| 2 | 25.00 | 0.56 | 14.56 | V2 |
| 3 | 25.00 | 0.22 | 12.73 | V3 |
⑤下列操作中可能使所测HCOOH溶液的浓度数值偏低的是
A.滴定前,用待测液润洗锥形瓶
B.一滴标准溶液附在锥形瓶壁上未洗下
C.选用甲基橙作指示剂
D.配置NaOH溶液时,称量NaOH固体速度过慢
E.读取NaOH溶液体积时,开始仰视读数,滴定结束时俯视读数
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐1】按要求填空
(1)某温度时,水的离子积为 ,则
,则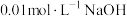 溶液的
溶液的
___________ 。
(2)25℃时, 的醋酸和
的醋酸和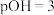 的氢氧化钠两溶液等体积混合后,混合液呈
的氢氧化钠两溶液等体积混合后,混合液呈___________ 性。
(3)同体积、 相同的三种酸a.盐酸b.醋酸c.硫酸,消耗Zn的质量由大到小为
相同的三种酸a.盐酸b.醋酸c.硫酸,消耗Zn的质量由大到小为___________ 。(用字母表示)
(4)常温下时, 的
的 溶液与
溶液与 的
的 溶液按照体积比为3:2混合(忽略体积变化),则反应后溶液的
溶液按照体积比为3:2混合(忽略体积变化),则反应后溶液的 为
为___________ 。( )
)
(5)25℃时,将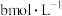 的氨水与
的氨水与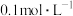 的盐酸等体积混合溶液显中性,用含b的代数式表示
的盐酸等体积混合溶液显中性,用含b的代数式表示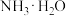 的电离常数
的电离常数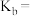
___________ 。
(1)某温度时,水的离子积为
 ,则
,则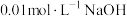 溶液的
溶液的
(2)25℃时,
 的醋酸和
的醋酸和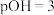 的氢氧化钠两溶液等体积混合后,混合液呈
的氢氧化钠两溶液等体积混合后,混合液呈(3)同体积、
 相同的三种酸a.盐酸b.醋酸c.硫酸,消耗Zn的质量由大到小为
相同的三种酸a.盐酸b.醋酸c.硫酸,消耗Zn的质量由大到小为(4)常温下时,
 的
的 溶液与
溶液与 的
的 溶液按照体积比为3:2混合(忽略体积变化),则反应后溶液的
溶液按照体积比为3:2混合(忽略体积变化),则反应后溶液的 为
为 )
)(5)25℃时,将
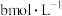 的氨水与
的氨水与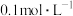 的盐酸等体积混合溶液显中性,用含b的代数式表示
的盐酸等体积混合溶液显中性,用含b的代数式表示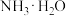 的电离常数
的电离常数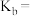
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】请根据所给物质填空:①石墨;②稀硫酸;③ ;④氨水;⑤
;④氨水;⑤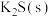 ;⑥
;⑥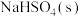 ;⑦
;⑦ ;⑧液态
;⑧液态 ;⑨
;⑨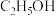 (填序号,下同)
(填序号,下同)
(1)属于强电解质的是___________ ;属于非电解质的是___________ ;能导电的是___________ 。
(2)写出⑤⑥在相应条件下的方程式:
⑤在水溶液中水解的方程式___________ ;
⑥在熔融状态下的电离方程式___________ 。
(3)常温下,当②⑦⑧三种酸溶液的物质的量浓度相同时, 由大到小的顺序是
由大到小的顺序是___________ ;若②⑦⑧三种酸溶液的 相等,则中和等体积等物质的量浓度的氢氧化钠溶液,所需酸溶液的体积由大到小的顺序是
相等,则中和等体积等物质的量浓度的氢氧化钠溶液,所需酸溶液的体积由大到小的顺序是___________ 。
 ;④氨水;⑤
;④氨水;⑤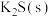 ;⑥
;⑥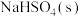 ;⑦
;⑦ ;⑧液态
;⑧液态 ;⑨
;⑨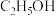 (填序号,下同)
(填序号,下同)(1)属于强电解质的是
(2)写出⑤⑥在相应条件下的方程式:
⑤在水溶液中水解的方程式
⑥在熔融状态下的电离方程式
(3)常温下,当②⑦⑧三种酸溶液的物质的量浓度相同时,
 由大到小的顺序是
由大到小的顺序是 相等,则中和等体积等物质的量浓度的氢氧化钠溶液,所需酸溶液的体积由大到小的顺序是
相等,则中和等体积等物质的量浓度的氢氧化钠溶液,所需酸溶液的体积由大到小的顺序是
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐3】回答下列问题
学科中的平衡理论主要包括:化学平衡、电离平衡、水解平衡和溶解平衡四种,且均符合勒夏特列原理 请回答下列问题:
请回答下列问题:
(1)常温下,某纯碱溶液中滴入酚酞,溶液呈红色,则该溶液呈______ 性,原因是________________ ; 用离子方程式表示
用离子方程式表示
(2)在常温下将pH=2的盐酸10mL加水稀释到1L,则稀释后的溶液的pH值等于______________ ;
(3)已知在H2S溶液中存在下列平衡: H2S H++HS-
H++HS-
向H2S溶液中加入NaOH固体时, 不考虑温度变化
不考虑温度变化 电离平衡向
电离平衡向______ 移动, 填“左”或“右”),c(H+)
填“左”或“右”),c(H+)______ 。(填“增大”、“减小”或“不变”
向H2S溶液中加入NaHS固体时,电离平衡向______ 移动, 填“左”或“右”)c(S2—)
填“左”或“右”)c(S2—)______ 。(填“增大”、“减小”或“不变”)

(4)常温下,取pH=2的盐酸和醋酸溶液各100mL,向其中分别加入适量的Zn粒,反应过程中两溶液的pH变化如图所示。则图中表示醋酸溶液中pH变化曲线的是______  填“A”或“B”
填“A”或“B” ;设盐酸中加入的Zn质量为m1,醋酸溶液中加入的Zn质量为m2,则m1
;设盐酸中加入的Zn质量为m1,醋酸溶液中加入的Zn质量为m2,则m1______ m2。 (选填“ ”、“
”、“ ”、“
”、“ ”
”
学科中的平衡理论主要包括:化学平衡、电离平衡、水解平衡和溶解平衡四种,且均符合勒夏特列原理
 请回答下列问题:
请回答下列问题: (1)常温下,某纯碱溶液中滴入酚酞,溶液呈红色,则该溶液呈
 用离子方程式表示
用离子方程式表示
(2)在常温下将pH=2的盐酸10mL加水稀释到1L,则稀释后的溶液的pH值等于
(3)已知在H2S溶液中存在下列平衡: H2S
 H++HS-
H++HS-向H2S溶液中加入NaOH固体时,
 不考虑温度变化
不考虑温度变化 电离平衡向
电离平衡向 填“左”或“右”),c(H+)
填“左”或“右”),c(H+)
向H2S溶液中加入NaHS固体时,电离平衡向
 填“左”或“右”)c(S2—)
填“左”或“右”)c(S2—)
(4)常温下,取pH=2的盐酸和醋酸溶液各100mL,向其中分别加入适量的Zn粒,反应过程中两溶液的pH变化如图所示。则图中表示醋酸溶液中pH变化曲线的是
 填“A”或“B”
填“A”或“B” ;设盐酸中加入的Zn质量为m1,醋酸溶液中加入的Zn质量为m2,则m1
;设盐酸中加入的Zn质量为m1,醋酸溶液中加入的Zn质量为m2,则m1 ”、“
”、“ ”、“
”、“ ”
”
您最近一年使用:0次



