Ⅰ.请对下列化学反应按吸热或放热的标准分类:
①过氧化钠与水反应 ②碳酸氢钠受热分解 ③食物腐烂 ④酒精燃烧 ⑤光合作用将 转化为
转化为 ⑥生石灰与水作用制熟石灰 ⑦电解水生成
⑥生石灰与水作用制熟石灰 ⑦电解水生成 和
和 ⑧铝片遇浓硫酸钝化
⑧铝片遇浓硫酸钝化
(1)属于放热反应的有:___________ (填序号,下同)。
(2)属于吸热反应的有:___________ 。
Ⅱ.磷元素有多种性质不同的单质,红磷(结构复杂用“P”表示)和白磷( )是磷的两种同素异形体,充分燃烧之后的产物都是五氧化二磷。在常温常压条件,62g白磷完全转化为红磷,大约放出22kJ的热量,根据以上事实回答下列问题:
)是磷的两种同素异形体,充分燃烧之后的产物都是五氧化二磷。在常温常压条件,62g白磷完全转化为红磷,大约放出22kJ的热量,根据以上事实回答下列问题:
(3)62g白磷与62g红磷两者中能量较高的是___________ (填“红磷”或“白磷”,下同),二者更稳定的是___________ 。
(4)一般情况下,石墨比金刚石更稳定,由此推测将石墨转化为金刚石属于___________ (填“放热”或“吸热”)反应。
Ⅲ.已知化学反应 的能量变化如图所示。
的能量变化如图所示。
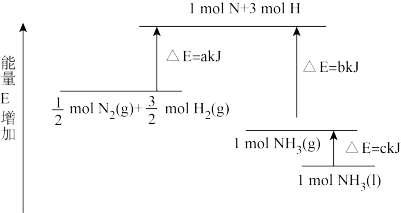
(5)上述反应每生成2
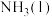 ,理论上需要
,理论上需要___________ (填“吸收”或“放出”)的能量为___________  (用含a、b、c的字母表示,下同);断开
(用含a、b、c的字母表示,下同);断开 中的1mol
中的1mol 键需要吸收
键需要吸收___________  能量。
能量。
①过氧化钠与水反应 ②碳酸氢钠受热分解 ③食物腐烂 ④酒精燃烧 ⑤光合作用将
 转化为
转化为 ⑥生石灰与水作用制熟石灰 ⑦电解水生成
⑥生石灰与水作用制熟石灰 ⑦电解水生成 和
和 ⑧铝片遇浓硫酸钝化
⑧铝片遇浓硫酸钝化(1)属于放热反应的有:
(2)属于吸热反应的有:
Ⅱ.磷元素有多种性质不同的单质,红磷(结构复杂用“P”表示)和白磷(
 )是磷的两种同素异形体,充分燃烧之后的产物都是五氧化二磷。在常温常压条件,62g白磷完全转化为红磷,大约放出22kJ的热量,根据以上事实回答下列问题:
)是磷的两种同素异形体,充分燃烧之后的产物都是五氧化二磷。在常温常压条件,62g白磷完全转化为红磷,大约放出22kJ的热量,根据以上事实回答下列问题:(3)62g白磷与62g红磷两者中能量较高的是
(4)一般情况下,石墨比金刚石更稳定,由此推测将石墨转化为金刚石属于
Ⅲ.已知化学反应
 的能量变化如图所示。
的能量变化如图所示。
(5)上述反应每生成2

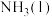 ,理论上需要
,理论上需要 (用含a、b、c的字母表示,下同);断开
(用含a、b、c的字母表示,下同);断开 中的1mol
中的1mol 键需要吸收
键需要吸收 能量。
能量。
更新时间:2023-08-20 21:48:33
|
相似题推荐
解答题-实验探究题
|
适中
(0.65)
名校
【推荐1】Ⅰ.肼(N2H4)是一种良好的火箭推进剂,其与适当的氧化剂(如过氧化氢、氧气等)配合,可组成比冲最高的可贮存液体推进剂。
(1)液态肼N2H4(l)和液态过氧化氢H2O2(l)混合反应时,即产生大量氮气和水蒸气,并放出大量热。若每消耗16g液态肼,放出321kJ的热量,则该反应的热化学方程式为___________ 。
(2)已知反应N2(g)+3H2(g) 2NH3(g),有关物质的化学键键能(拆开1mol化学键所需要的能量)如下:则该反应N2(g)+3H2(g)
2NH3(g),有关物质的化学键键能(拆开1mol化学键所需要的能量)如下:则该反应N2(g)+3H2(g) 2NH3(g) ΔH=
2NH3(g) ΔH=___________ kJ·mol-1。
(3)已知:N2H4(g)+O2(g) = N2(g)+2H2O(g) ΔH=-544kJ·mol-1,若H2O(l)=H2O(g)ΔH=+44kJ·mol-1,则N2H4(g)的燃烧热为___________ 。
Ⅱ.实验室用50 mL 0.50 mol·L-1盐酸、50 mL 0.55 mol·L-1 NaOH溶液和如图所示装置进行中和反应反应热的测定实验,得到如表所示数据:
(4)实验时使用的仪器a的名称___________ 。

(5)稍过量的NaOH溶液原因是___________ 。
(6)根据表中所测数据进行计算,则该实验测得的中和热ΔH=___________ kJ·mol-1[假设盐酸和NaOH溶液的密度按1 g·cm-3计算,反应后混合溶液的比热容(c)按4.18 J·g-1·℃-1计算]。
(7)上述实验测得中和热的数值小于57.3kJ·mol-1,产生偏差的原因可能是___________(填字母)。
(1)液态肼N2H4(l)和液态过氧化氢H2O2(l)混合反应时,即产生大量氮气和水蒸气,并放出大量热。若每消耗16g液态肼,放出321kJ的热量,则该反应的热化学方程式为
(2)已知反应N2(g)+3H2(g)
 2NH3(g),有关物质的化学键键能(拆开1mol化学键所需要的能量)如下:则该反应N2(g)+3H2(g)
2NH3(g),有关物质的化学键键能(拆开1mol化学键所需要的能量)如下:则该反应N2(g)+3H2(g) 2NH3(g) ΔH=
2NH3(g) ΔH=| 共价键 | N≡N | H—H | N—H |
| 键能(kJ/mol) | 946 | 436 | 391 |
(3)已知:N2H4(g)+O2(g) = N2(g)+2H2O(g) ΔH=-544kJ·mol-1,若H2O(l)=H2O(g)ΔH=+44kJ·mol-1,则N2H4(g)的燃烧热为
Ⅱ.实验室用50 mL 0.50 mol·L-1盐酸、50 mL 0.55 mol·L-1 NaOH溶液和如图所示装置进行中和反应反应热的测定实验,得到如表所示数据:
| 实验序号 | 起始温度t1/℃ | 终止温度t2/℃ | |
| 盐酸 | 氢氧化钠溶液 | 混合溶液 | |
| 1 | 20.1 | 20.1 | 23.2 |
| 2 | 20.3 | 20.5 | 23.4 |
| 3 | 20.3 | 20.5 | 23.3 |
(4)实验时使用的仪器a的名称

(5)稍过量的NaOH溶液原因是
(6)根据表中所测数据进行计算,则该实验测得的中和热ΔH=
(7)上述实验测得中和热的数值小于57.3kJ·mol-1,产生偏差的原因可能是___________(填字母)。
| A.量取盐酸溶液时仰视读数 |
| B.一次性把NaOH溶液倒入盛有盐酸的小烧杯中 |
| C.用温度计测量盐酸起始温度后直接测量NaOH溶液的温度 |
| D.用铜丝代替玻璃搅拌器搅拌 |
您最近一年使用:0次
【推荐2】不同价态含硫化合物的转化在工业上有重要的应用。回答下列问题:
I.利用NO2将SO2转化为SO3的反应过程如下:
i.SO2(g)+NO2(g)=SO3(g)+NO(g) ΔH=QkJ·mol-1
ii.2NO(g)+O2(g)=2NO2(g) ΔH=-114.1kJ·mol-1
反应2SO2(g)+O2(g)=2SO3(g) ΔH=-197.7kJ·mol-1。则Q=_______ ;NO2的作用是_______ 。
II.某化学小组对反应2SO2(g)+O2(g)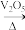 2SO3(g)进行研究。
2SO3(g)进行研究。
(1)相同条件下,在某恒容密闭容器中充入2molSO2和1molO2,发生上述反应。下列情况能说明反应达到化学平衡状态的是_______ (填标号)。
A.2υ(SO2)=υ(O2)
B.容器内气体的压强保持不变
C.SO2与O2的浓度比保持不变
D.混合气体的平均相对分子质量保持不变
(2)在一个容积为2L的恒温恒容密闭容器中,以不同投料方式研究上述反应,得到的数据如下表:
①表中a=_______ ,甲组实验在该条件下的平衡常数K=_______ 。
②在相同条件下,若将甲组实验按2molSO2、1molO2、1molSO3进行投料,则反应开始时v正____ v逆(填“>”“=”或“<”),平衡时SO3的百分含量与原甲组实验相比__________ (填“变大”“变小”或“不变”)。
③为加快乙组实验的反应速率,下列措施可行的是_______ (填标号)。
A.升高温度 B.降低温度 C.充入适量N2 D.移走SO2
若将乙组实验的容器改为绝热容器,则b值_______ (填“变大”“变小”或“不变”)。
I.利用NO2将SO2转化为SO3的反应过程如下:
i.SO2(g)+NO2(g)=SO3(g)+NO(g) ΔH=QkJ·mol-1
ii.2NO(g)+O2(g)=2NO2(g) ΔH=-114.1kJ·mol-1
反应2SO2(g)+O2(g)=2SO3(g) ΔH=-197.7kJ·mol-1。则Q=
II.某化学小组对反应2SO2(g)+O2(g)
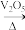 2SO3(g)进行研究。
2SO3(g)进行研究。(1)相同条件下,在某恒容密闭容器中充入2molSO2和1molO2,发生上述反应。下列情况能说明反应达到化学平衡状态的是
A.2υ(SO2)=υ(O2)
B.容器内气体的压强保持不变
C.SO2与O2的浓度比保持不变
D.混合气体的平均相对分子质量保持不变
(2)在一个容积为2L的恒温恒容密闭容器中,以不同投料方式研究上述反应,得到的数据如下表:
| 实验分组 | 甲组 | 乙组 |
| 反应物 | 2molSO2、1molO2 | 2molSO3 |
| 反应热量 | 放热158.16kJ | |
| 反应物的平衡转化率 | a | b |
①表中a=
②在相同条件下,若将甲组实验按2molSO2、1molO2、1molSO3进行投料,则反应开始时v正
③为加快乙组实验的反应速率,下列措施可行的是
A.升高温度 B.降低温度 C.充入适量N2 D.移走SO2
若将乙组实验的容器改为绝热容器,则b值
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐3】二氧化硫的催化氧化是工业上生产硫酸的主要反应,反应如下:
Ⅰ: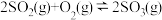
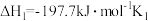 (浓度平衡常数)
(浓度平衡常数)
为研究该反应,某同学设计了以下三种已装固体 催化剂的密闭容器装置
催化剂的密闭容器装置
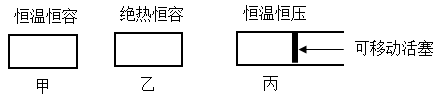
(1)在初始体积与温度相同的条件下,甲、乙、丙中均按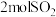 、
、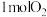 投料,达平衡时,三个容器中
投料,达平衡时,三个容器中 的转化率从大到小的顺序为
的转化率从大到小的顺序为___________ (用“甲、乙、丙”表示)。
(2)在容器丙中,0.1MPa条件下,在不同温度或不同投料方式下研究上述反应得到数据如下表:
①表中:
________ ;
____________ ;大小a_______ d(填“<”,“>”或“=”)
②已知用平衡分压(分压=总压×物质的量分数)代替平衡浓度计算,得到的平衡常数即为压强平衡常数,计算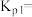
____________ ; 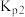
________ 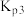 (填“>”、“<”或“=")。
(填“>”、“<”或“=")。
(3)将上述固体催化剂 换成
换成 气体同样可以对该反应起到催化作用,此催化过程如下:
气体同样可以对该反应起到催化作用,此催化过程如下:
Ⅱ: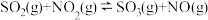

 (浓度平衡常数)
(浓度平衡常数)
Ⅲ: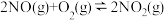

 浓度平衡常数
浓度平衡常数

_________ ;
__________ (用含有 、
、 的表达式表示)。
的表达式表示)。
Ⅰ:
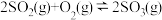
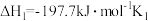 (浓度平衡常数)
(浓度平衡常数)为研究该反应,某同学设计了以下三种已装固体
 催化剂的密闭容器装置
催化剂的密闭容器装置
(1)在初始体积与温度相同的条件下,甲、乙、丙中均按
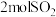 、
、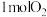 投料,达平衡时,三个容器中
投料,达平衡时,三个容器中 的转化率从大到小的顺序为
的转化率从大到小的顺序为(2)在容器丙中,0.1MPa条件下,在不同温度或不同投料方式下研究上述反应得到数据如下表:
| 实验序号 | A组 | B组 | C组 |
| 反应温度 | 451℃ | 451℃ | 551℃ |
投料方式(按照 、 、 、 、 的顺序) 的顺序) | 2mol、1mol、0mol | 0mol、0mol、2mol | 2mol、1mol、0mol |
| 含硫化合物的转化率 | 60% | b | c |
反应的热量变化( ) ) | 放热a | 吸热e | 放热d |
压强平衡常数( ) ) | 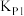 | 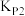 | 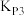 |
①表中:


②已知用平衡分压(分压=总压×物质的量分数)代替平衡浓度计算,得到的平衡常数即为压强平衡常数,计算
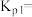
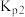
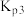 (填“>”、“<”或“=")。
(填“>”、“<”或“=")。(3)将上述固体催化剂
 换成
换成 气体同样可以对该反应起到催化作用,此催化过程如下:
气体同样可以对该反应起到催化作用,此催化过程如下:Ⅱ:
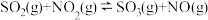

 (浓度平衡常数)
(浓度平衡常数)Ⅲ:
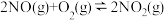

 浓度平衡常数
浓度平衡常数

 、
、 的表达式表示)。
的表达式表示)。
您最近一年使用:0次
【推荐1】碳是形成化合物种类最多的元素,其单质及化合物是人类生产生活所需的主要能源物质。我国将在2030年前实现“碳达峰”、2060年前实现“碳中和”。“碳中和”是指 的排放总量和减少总量相当。
的排放总量和减少总量相当。 的资源化利用能有效减少
的资源化利用能有效减少 排放。
排放。
(1)有机物M、N可以相互转化:


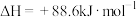 ,M、N相比,较不稳定的是
,M、N相比,较不稳定的是___________ 。
(2)使 和
和 通过灼热的炭层,可生成HCl和
通过灼热的炭层,可生成HCl和 。当消耗1mol
。当消耗1mol 时释放出akJ热量,写出该反应的热化学方程式
时释放出akJ热量,写出该反应的热化学方程式___________ 。
(3)某温度下,向恒容密闭容器中充入 和
和 发生反应:
发生反应: 初始时
初始时 和
和 的分压分别为15kPa、20kPa,一段时间达到平衡后,测得体系压强增加了10kPa,则该反应的平衡常数
的分压分别为15kPa、20kPa,一段时间达到平衡后,测得体系压强增加了10kPa,则该反应的平衡常数
___________  (结果保留两位有效数字,用平衡分压代替平衡浓度计算。分压=总压×物质的量分数)。
(结果保留两位有效数字,用平衡分压代替平衡浓度计算。分压=总压×物质的量分数)。
(4)电解法转化 可实现
可实现 资源化利用。电解
资源化利用。电解 制HCOOH的原理如图。
制HCOOH的原理如图。

①阳极区为该装置的___________ 边(填“左”或“右”),电解一段时间后,溶液中的 向
向___________ 极区移动(填“阳”或“阴”)。
②写出 被还原为
被还原为 的电极反应式:
的电极反应式:___________ 。
 的排放总量和减少总量相当。
的排放总量和减少总量相当。 的资源化利用能有效减少
的资源化利用能有效减少 排放。
排放。(1)有机物M、N可以相互转化:



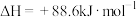 ,M、N相比,较不稳定的是
,M、N相比,较不稳定的是(2)使
 和
和 通过灼热的炭层,可生成HCl和
通过灼热的炭层,可生成HCl和 。当消耗1mol
。当消耗1mol 时释放出akJ热量,写出该反应的热化学方程式
时释放出akJ热量,写出该反应的热化学方程式(3)某温度下,向恒容密闭容器中充入
 和
和 发生反应:
发生反应: 初始时
初始时 和
和 的分压分别为15kPa、20kPa,一段时间达到平衡后,测得体系压强增加了10kPa,则该反应的平衡常数
的分压分别为15kPa、20kPa,一段时间达到平衡后,测得体系压强增加了10kPa,则该反应的平衡常数
 (结果保留两位有效数字,用平衡分压代替平衡浓度计算。分压=总压×物质的量分数)。
(结果保留两位有效数字,用平衡分压代替平衡浓度计算。分压=总压×物质的量分数)。(4)电解法转化
 可实现
可实现 资源化利用。电解
资源化利用。电解 制HCOOH的原理如图。
制HCOOH的原理如图。
①阳极区为该装置的
 向
向②写出
 被还原为
被还原为 的电极反应式:
的电极反应式:
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐2】如图是某同学设计的放热反应的观察装置。其实验操作步骤如下:

①按图所示将实验装置连接好;
②在 U 形管内加入少量红墨水(或品红溶液),打开T形管活塞,使U形管内两边的液面处于同一水平面,再关闭T形管活塞;
③在盛有1.0 g氧化钙的小试管里滴入2 mL左右的蒸馏水,观察现象。 试回答:
(1)实验前必须进行的一步实验操作是__________ ;
(2)实验中观察到的现象是___________ ;
(3)则1mol Ca(OH)2 能量_______ 1mol CaO与1molH2O的总能量;(填“大于”,“等于”或“小于”) ;
(4)若该实验中 CaO 换成 NaOH,实验还能否观察到相同现象?_______ (填“能” 或“否”)。

①按图所示将实验装置连接好;
②在 U 形管内加入少量红墨水(或品红溶液),打开T形管活塞,使U形管内两边的液面处于同一水平面,再关闭T形管活塞;
③在盛有1.0 g氧化钙的小试管里滴入2 mL左右的蒸馏水,观察现象。 试回答:
(1)实验前必须进行的一步实验操作是
(2)实验中观察到的现象是
(3)则1mol Ca(OH)2 能量
(4)若该实验中 CaO 换成 NaOH,实验还能否观察到相同现象?
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐3】为了探究化学能与热能的转化,某实验小组设计了如下三套实验装置:

(1)上述3个装置中,不能证明“铜与浓硝酸反应是吸热反应还是放热反应”的是___________ 。
(2)某同学选用装置Ⅰ进行实验(实验前U形管里液面左右相平),在甲试管里加入适量氢氧化钡溶液与稀硫酸,U形管中可观察到的现象是___________ ,说明该反应属于___________ (填“吸热”或“放热”)反应。
(3)为探究固体M溶于水的热效应,选择装置Ⅱ进行实验(反应在甲中进行)。
①若M为钠,则实验过程中烧杯中可观察到的现象是___________ ;
②若观察到烧杯里产生气泡,则说明M溶于水___________ (填“一定是放热反应”、“一定是吸热反应”或“可能是放热反应”),理由是___________ 。
(4)至少有两种实验方法能证明超氧化钾与水的反应(4KO2 + 2H2O= 4KOH + 3O2↑)是放热反应。
方法①:选择上述装置___________ (填“Ⅰ”、“Ⅱ”或“Ⅲ”)进行实验。
方法②:取适量超氧化钾粉末用脱脂棉包裹并放在石棉网上,向脱脂棉上滴加几滴蒸馏水,片刻后,若观察到___________ ,则说明该反应是放热反应。

(1)上述3个装置中,不能证明“铜与浓硝酸反应是吸热反应还是放热反应”的是
(2)某同学选用装置Ⅰ进行实验(实验前U形管里液面左右相平),在甲试管里加入适量氢氧化钡溶液与稀硫酸,U形管中可观察到的现象是
(3)为探究固体M溶于水的热效应,选择装置Ⅱ进行实验(反应在甲中进行)。
①若M为钠,则实验过程中烧杯中可观察到的现象是
②若观察到烧杯里产生气泡,则说明M溶于水
(4)至少有两种实验方法能证明超氧化钾与水的反应(4KO2 + 2H2O= 4KOH + 3O2↑)是放热反应。
方法①:选择上述装置
方法②:取适量超氧化钾粉末用脱脂棉包裹并放在石棉网上,向脱脂棉上滴加几滴蒸馏水,片刻后,若观察到
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐1】Ⅰ、大气中的二氧化碳主要来自煤、石油及其他含碳化合物的燃烧。已知 时,
时, 下,相关物质燃烧的热化学方程式知下:
下,相关物质燃烧的热化学方程式知下:
①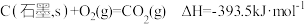 ;
;
②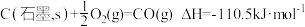 。
。
(1)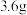 石墨在
石墨在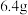 氧气中燃烧至反应物均耗尽:
氧气中燃烧至反应物均耗尽:
①燃烧后的产物为___________ (填化学式),转移的电子总物质的量为___________  。
。
②燃烧后放出的总热量为___________  。
。
③将所得气体通入 溶液中充分反应(不考虑气体的逸出),所得的盐为
溶液中充分反应(不考虑气体的逸出),所得的盐为___________ (填化学式),判断的依据是___________ 。
④若测得③中反应放出的总热敏为 ,已知该条件下,将
,已知该条件下,将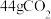 ,通入
,通入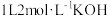 溶液中充分反应放出
溶液中充分反应放出 的热量。则
的热量。则 与
与 溶液反应生成
溶液反应生成 的热化学方程式为
的热化学方程式为___________ (用含m、n的式子表示)。
(2)已知: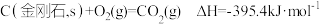 ,下列说法正确的是
,下列说法正确的是___________ (填标号)。
A.金刚石比石显稳定
B.每放出 的热量,需消耗氧气的体积为
的热量,需消耗氧气的体积为
C.等物质的量的金刚石和石墨,完全燃烧后,石墨放出的热量更少
Ⅱ、
(3)在一定温度, 下,分别在
下,分别在 密闭容器中充入
密闭容器中充入 和
和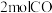 ,发生反应:
,发生反应: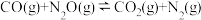 ,达平衡时,测得无毒气体的体积分数
,达平衡时,测得无毒气体的体积分数 ,该条件下平衡常数
,该条件下平衡常数
___________ ( 为以分压表示的平衡常数,分压-总压×物质的量分数)。
为以分压表示的平衡常数,分压-总压×物质的量分数)。
 时,
时, 下,相关物质燃烧的热化学方程式知下:
下,相关物质燃烧的热化学方程式知下:①
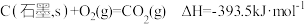 ;
;②
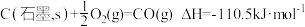 。
。(1)
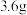 石墨在
石墨在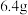 氧气中燃烧至反应物均耗尽:
氧气中燃烧至反应物均耗尽:①燃烧后的产物为
 。
。②燃烧后放出的总热量为
 。
。③将所得气体通入
 溶液中充分反应(不考虑气体的逸出),所得的盐为
溶液中充分反应(不考虑气体的逸出),所得的盐为④若测得③中反应放出的总热敏为
 ,已知该条件下,将
,已知该条件下,将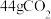 ,通入
,通入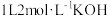 溶液中充分反应放出
溶液中充分反应放出 的热量。则
的热量。则 与
与 溶液反应生成
溶液反应生成 的热化学方程式为
的热化学方程式为(2)已知:
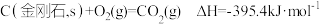 ,下列说法正确的是
,下列说法正确的是A.金刚石比石显稳定
B.每放出
 的热量,需消耗氧气的体积为
的热量,需消耗氧气的体积为
C.等物质的量的金刚石和石墨,完全燃烧后,石墨放出的热量更少
Ⅱ、
(3)在一定温度,
 下,分别在
下,分别在 密闭容器中充入
密闭容器中充入 和
和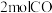 ,发生反应:
,发生反应: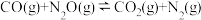 ,达平衡时,测得无毒气体的体积分数
,达平衡时,测得无毒气体的体积分数 ,该条件下平衡常数
,该条件下平衡常数
 为以分压表示的平衡常数,分压-总压×物质的量分数)。
为以分压表示的平衡常数,分压-总压×物质的量分数)。
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐2】化学反应中均伴随着能量的变化,回答下列问题:
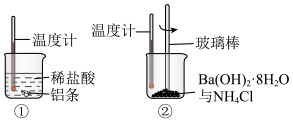
(1)某同学进行如下实验,图①和②中温度计示数降低的是_______ ;
(2)有机物M可转化成N,转化过程如下,则M、N相比,较稳定的是_______ ;
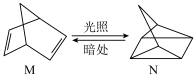
(3)已知 在一定条件下可发生如图的一系列反应,下列说法正确的是_______;
在一定条件下可发生如图的一系列反应,下列说法正确的是_______;
(4)金属Ni可活化 放出
放出 ,其反应历程如图所示:
,其反应历程如图所示:
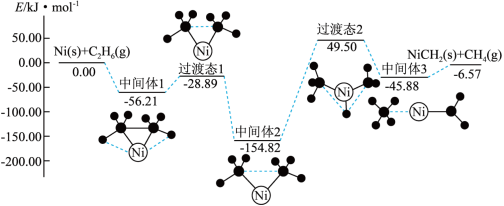
下列关于活化历程的说法正确的是_______。
(5) 与
与 经催化重整,制得合成气:
经催化重整,制得合成气: 已知上述反应中相关的化学键键能数据如下,则该反应的
已知上述反应中相关的化学键键能数据如下,则该反应的
_______ kJ/mol。
(6)在25℃、101kPa下,1g乙烷气体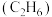 燃烧生成
燃烧生成 和液态水时放热QkJ,则表示乙烷燃烧热的热化学方程式为
和液态水时放热QkJ,则表示乙烷燃烧热的热化学方程式为_______ 。
(7)中和热的测定实验中,取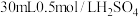 溶液与50mL0.5mol/LNaOH溶液进行中和反应,三次实验温度平均升高4℃,已知溶液的比热容近似为
溶液与50mL0.5mol/LNaOH溶液进行中和反应,三次实验温度平均升高4℃,已知溶液的比热容近似为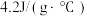 ,溶液的密度均近似为
,溶液的密度均近似为 。通过计算可得稀硫酸和稀NaOH溶液的中和热
。通过计算可得稀硫酸和稀NaOH溶液的中和热
_______ kJ/mol。
(1)某同学进行如下实验,图①和②中温度计示数降低的是

(2)有机物M可转化成N,转化过程如下,则M、N相比,较稳定的是

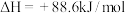
(3)已知
 在一定条件下可发生如图的一系列反应,下列说法正确的是_______;
在一定条件下可发生如图的一系列反应,下列说法正确的是_______;
A. | B.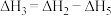 |
C. | D. |
(4)金属Ni可活化
 放出
放出 ,其反应历程如图所示:
,其反应历程如图所示:
下列关于活化历程的说法正确的是_______。
| A.中间体1→中间体2的过程是放热过程 |
| B.加入催化剂可降低该反应的反应热,加快反应速率 |
C.1molNi和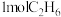 的总能量小于 的总能量小于 和 和 的总能量 的总能量 |
| D.中间体2→中间体3的过程是决速步骤 |
(5)
 与
与 经催化重整,制得合成气:
经催化重整,制得合成气: 已知上述反应中相关的化学键键能数据如下,则该反应的
已知上述反应中相关的化学键键能数据如下,则该反应的
| 化学键 |  |  |  | 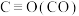 |
| 键能/(kJ/mol) | 413 | 745 | 436 | 1075 |
(6)在25℃、101kPa下,1g乙烷气体
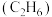 燃烧生成
燃烧生成 和液态水时放热QkJ,则表示乙烷燃烧热的热化学方程式为
和液态水时放热QkJ,则表示乙烷燃烧热的热化学方程式为(7)中和热的测定实验中,取
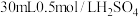 溶液与50mL0.5mol/LNaOH溶液进行中和反应,三次实验温度平均升高4℃,已知溶液的比热容近似为
溶液与50mL0.5mol/LNaOH溶液进行中和反应,三次实验温度平均升高4℃,已知溶液的比热容近似为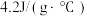 ,溶液的密度均近似为
,溶液的密度均近似为 。通过计算可得稀硫酸和稀NaOH溶液的中和热
。通过计算可得稀硫酸和稀NaOH溶液的中和热
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐3】回答或解释下列问题:
(1)已知: ,则稳定性:白磷
,则稳定性:白磷_______ 红磷(填“大于”或“小于”)。
(2)在常温常压下,1 g氢气在足量氯气中完全燃烧生成氯化氢气体,放出91.5 的热量。写出相应的热化学方程式为
的热量。写出相应的热化学方程式为_______ ;
(3)将浓氨水滴入到固体氢氧化钠中,可以快速制备氨气,用平衡移动原理解释原因:_______ ;
(4)常温下,用0.1 mol/LNaOH溶液分别滴定20.00 mL0.1 mol/LHCl溶液和20.00 mL 0.1 mol/L CH3COOH溶液,得到2条滴定曲线如图所示:

①由A、C点判断,滴定HCl溶液的曲线是_______ (填“图1”或“图2”)。
②E为滴定终点,则a=_______ mL。
③D点对应离子浓度由大到小的顺序为_______ 。
(5)肼(N2H4)是一种应用广泛的化工原料,可作为火箭发动机的燃料。已知断裂1 mol化学键所需的能量:N≡N为942 kJ、N-N为154 kJ,另外1 mol O2(g)变成2 mol O(g)需吸收500 kJ能量,则断裂1 mol N-N键所需的能量是_______ 。

(1)已知:
 ,则稳定性:白磷
,则稳定性:白磷(2)在常温常压下,1 g氢气在足量氯气中完全燃烧生成氯化氢气体,放出91.5
 的热量。写出相应的热化学方程式为
的热量。写出相应的热化学方程式为(3)将浓氨水滴入到固体氢氧化钠中,可以快速制备氨气,用平衡移动原理解释原因:
(4)常温下,用0.1 mol/LNaOH溶液分别滴定20.00 mL0.1 mol/LHCl溶液和20.00 mL 0.1 mol/L CH3COOH溶液,得到2条滴定曲线如图所示:

①由A、C点判断,滴定HCl溶液的曲线是
②E为滴定终点,则a=
③D点对应离子浓度由大到小的顺序为
(5)肼(N2H4)是一种应用广泛的化工原料,可作为火箭发动机的燃料。已知断裂1 mol化学键所需的能量:N≡N为942 kJ、N-N为154 kJ,另外1 mol O2(g)变成2 mol O(g)需吸收500 kJ能量,则断裂1 mol N-N键所需的能量是

您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐1】Ⅰ.浓硫酸具有:①难挥发性(高沸点);②酸性;③强氧化性;④吸水性;⑤脱水性。下列各项分别表现浓硫酸的什么性质,请将序号填于空白处:
(1)蔗糖中倒入浓硫酸,蔗糖变黑,体积膨胀,且有刺激性气味的气体产生,该实验现象表明浓硫酸具有___________ 。
(2)浓硫酸使蓝色的胆矾晶体变为白色,表现的性质是___________ 。
(3)浓硫酸与FeO反应,表现的性质是___________ 。
(4)浓硫酸与食盐共热制HCl气体,表现的性质为___________ 。
Ⅱ.为了探究化学能与热能的转化,某实验小组设计了如下三套实验装置:

①上述装置中,不能用来证明“锌和稀硫酸反应是吸热反应还是放热反应”的是___________ (填序号)。
②某同学选用装置Ⅰ进行实验(实验前U形管里液面左右相平),在甲试管里加入适量氢氧化钡晶体与氯化铵固体搅拌反应,U形管中可观察到的现象是___________ 。
③除了图示某些装置,还有其它方法能证明超氧化钾粉末与水的反应(4KO2+2H2O=4KOH+3O2↑)是放热反应还是吸热反应:取适量超氧化钾粉末用脱脂棉包裹并放在石棉网上,向脱脂棉上滴加几滴蒸馏水,片刻后,若观察到棉花燃烧,则说明该反应是___________ 反应(填“放热”或“吸热”)。
(1)蔗糖中倒入浓硫酸,蔗糖变黑,体积膨胀,且有刺激性气味的气体产生,该实验现象表明浓硫酸具有
(2)浓硫酸使蓝色的胆矾晶体变为白色,表现的性质是
(3)浓硫酸与FeO反应,表现的性质是
(4)浓硫酸与食盐共热制HCl气体,表现的性质为
Ⅱ.为了探究化学能与热能的转化,某实验小组设计了如下三套实验装置:

①上述装置中,不能用来证明“锌和稀硫酸反应是吸热反应还是放热反应”的是
②某同学选用装置Ⅰ进行实验(实验前U形管里液面左右相平),在甲试管里加入适量氢氧化钡晶体与氯化铵固体搅拌反应,U形管中可观察到的现象是
③除了图示某些装置,还有其它方法能证明超氧化钾粉末与水的反应(4KO2+2H2O=4KOH+3O2↑)是放热反应还是吸热反应:取适量超氧化钾粉末用脱脂棉包裹并放在石棉网上,向脱脂棉上滴加几滴蒸馏水,片刻后,若观察到棉花燃烧,则说明该反应是
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐2】反应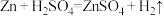 的能量变化趋势如图(I)所示。将纯锌片和纯铜片按下图(II)方式插入100
的能量变化趋势如图(I)所示。将纯锌片和纯铜片按下图(II)方式插入100 相同浓度的稀硫酸中一段时间。回答下列问题:
相同浓度的稀硫酸中一段时间。回答下列问题:
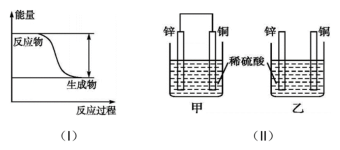
(1)该反应为_______ (填“吸热”或“放热”)反应。
(2)若要使该反应的反应速率增大,下列措施可行的是_______(填字母)。
(3)下列说法中正确的是_______(填序号)。
(4)在相同时间内,两烧杯中产生气泡的速率:甲_______ 乙(填“>”“<”或“=”)。
(5)当甲中产生1.12L(标准状况)气体时,理论上通过导线的电子数目为_______ 。
(6)甲装置构成的原电池中,铜为电池的_______ (填“正”或“负”)极。铜电极上发生的电极反应为_______ 。
(7)当乙中产生1.12L(标准状况)气体时,将锌、铜片取出,再将烧杯中的溶液稀释至1L,测得溶液中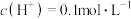 。试确定原稀硫酸中
。试确定原稀硫酸中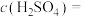
_______ 。
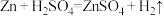 的能量变化趋势如图(I)所示。将纯锌片和纯铜片按下图(II)方式插入100
的能量变化趋势如图(I)所示。将纯锌片和纯铜片按下图(II)方式插入100 相同浓度的稀硫酸中一段时间。回答下列问题:
相同浓度的稀硫酸中一段时间。回答下列问题:
(1)该反应为
(2)若要使该反应的反应速率增大,下列措施可行的是_______(填字母)。
| A.改铁片为铁粉 | B.改稀硫酸为98%的浓硫酸 |
| C.适当升高温度 | D.减小压强 |
| A.甲、乙均为化学能转变为电能的装置 | B.甲装置溶液中 离子向锌极移动 离子向锌极移动 |
| C.甲中铜片质量减小、乙中锌片质量减小 | D.两烧杯中 的浓度均减小 的浓度均减小 |
(5)当甲中产生1.12L(标准状况)气体时,理论上通过导线的电子数目为
(6)甲装置构成的原电池中,铜为电池的
(7)当乙中产生1.12L(标准状况)气体时,将锌、铜片取出,再将烧杯中的溶液稀释至1L,测得溶液中
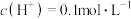 。试确定原稀硫酸中
。试确定原稀硫酸中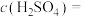
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐3】完成下列问题
(1)甲醛是一种重要的化工产品,可利用甲醇催化脱氢制备。甲醛与气态甲醇转化的能量关系如图所示。
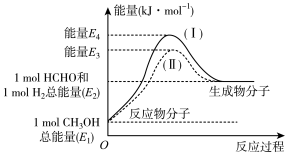
①甲醇催化脱氢转化为甲醛的反应是___________  填“吸热”或“放热”
填“吸热”或“放热” 反应。
反应。
②过程Ⅰ与过程Ⅱ的反应热是否相同?___________ ,原因是___________ 。
(2)在 、101kPa下,1g甲醇(CH3OH)燃烧生成CO2和液态水时放热22.68kJ。则表示甲醇(液体)燃烧热的热化学方程式为:
、101kPa下,1g甲醇(CH3OH)燃烧生成CO2和液态水时放热22.68kJ。则表示甲醇(液体)燃烧热的热化学方程式为:___________ 。
(3)CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H1;CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H2,△H1___________ △H2(填“>”、“<”或“=”)
(4)白磷与氧可发生如下反应:P4(s)+5O2(g)=P4O10(s)。已知断裂下列化学键需要吸收的能量分别为
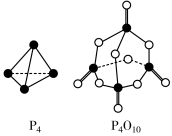
根据图示的分子结构和有关数据估算该反应的△H=___________ ;
(5)某温度时,在容积为2L的密闭容器中,A、B、C三种气态物质的物质的量随时间变化的曲线如图。分析图中数据,回答下列问题:
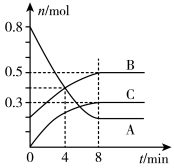
①该反应的化学方程式为___________ 。
②反应开始至4 min时,物质A的平均反应速率为___________ 。
③4 min时,正反应速率___________ (填“>”“<”或“=”,下同)逆反应速率,8 min时,正反应速率___________ 逆反应速率。
(1)甲醛是一种重要的化工产品,可利用甲醇催化脱氢制备。甲醛与气态甲醇转化的能量关系如图所示。

①甲醇催化脱氢转化为甲醛的反应是
 填“吸热”或“放热”
填“吸热”或“放热” 反应。
反应。②过程Ⅰ与过程Ⅱ的反应热是否相同?
(2)在
 、101kPa下,1g甲醇(CH3OH)燃烧生成CO2和液态水时放热22.68kJ。则表示甲醇(液体)燃烧热的热化学方程式为:
、101kPa下,1g甲醇(CH3OH)燃烧生成CO2和液态水时放热22.68kJ。则表示甲醇(液体)燃烧热的热化学方程式为:(3)CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H1;CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H2,△H1
(4)白磷与氧可发生如下反应:P4(s)+5O2(g)=P4O10(s)。已知断裂下列化学键需要吸收的能量分别为
| 化学键 | P-P | P-O | P=O | O-O | O=O |
| 键能(kJ/mol) | a | b | c | d | e |

根据图示的分子结构和有关数据估算该反应的△H=
(5)某温度时,在容积为2L的密闭容器中,A、B、C三种气态物质的物质的量随时间变化的曲线如图。分析图中数据,回答下列问题:

①该反应的化学方程式为
②反应开始至4 min时,物质A的平均反应速率为
③4 min时,正反应速率
您最近一年使用:0次



