I.某同学设计如下实验方案,以分离KCl和BaCl2两种固体混合物,试回答下列问题:
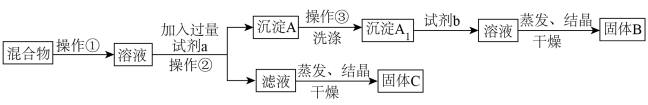
供选试剂:Na2SO4溶液、K2SO4溶液、K2CO3溶液、盐酸。
(1)操作②的名称是___________ 。
(2)试剂a是___________ ,固体B是___________ (填化学式)。
(3)生成沉淀A的化学反应方程式为___________ 。
(4)该方案能否达到实验目的___________ 。(填“能”或“否”),若否,该如何改进(若能,此问不用回答)___________ 。
Ⅱ.
(5)实验室可以用高锰酸钾和浓盐酸反应制取氯气,反应的化学方程式: 。若用6.32gKMnO4与过量的浓盐酸充分反应,理论上可得到氯气的体积(标准状况)为
。若用6.32gKMnO4与过量的浓盐酸充分反应,理论上可得到氯气的体积(标准状况)为___________ (写出计算过程)
(6)ClO2常用于饮用水消毒,我国规定饮用水中残留的ClO2含量在0.1~0.8mg·L-1。测定水样中ClO2含量的实验如下:
准确量取50.00mL水样,加入足量的KI晶体与水样中的ClO2充分反应,生成的I2与5.00mL1.00×10-4mol·L-1Na2S2O3溶液恰好完全反应。
此过程发生反应:
根据上述数据计算并判断该水样中ClO2的含量是否符合国家规定___________ 。(填是或否)(写出计算过程)

供选试剂:Na2SO4溶液、K2SO4溶液、K2CO3溶液、盐酸。
(1)操作②的名称是
(2)试剂a是
(3)生成沉淀A的化学反应方程式为
(4)该方案能否达到实验目的
Ⅱ.
(5)实验室可以用高锰酸钾和浓盐酸反应制取氯气,反应的化学方程式:
 。若用6.32gKMnO4与过量的浓盐酸充分反应,理论上可得到氯气的体积(标准状况)为
。若用6.32gKMnO4与过量的浓盐酸充分反应,理论上可得到氯气的体积(标准状况)为(6)ClO2常用于饮用水消毒,我国规定饮用水中残留的ClO2含量在0.1~0.8mg·L-1。测定水样中ClO2含量的实验如下:
准确量取50.00mL水样,加入足量的KI晶体与水样中的ClO2充分反应,生成的I2与5.00mL1.00×10-4mol·L-1Na2S2O3溶液恰好完全反应。
此过程发生反应:

根据上述数据计算并判断该水样中ClO2的含量是否符合国家规定
更新时间:2023-12-02 20:24:49
|
相似题推荐
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐1】高铁酸钾(K2FeO4)易溶于水,受热分解生成氧气。高铁酸钾的工业制法有多种,其中一种制法的主要步骤如图1所示(方框内为主产物)。
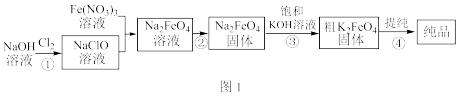
回答下列问题:
(1)NaClO溶液与Fe(NO3)3溶液反应的离子方程式是______ 。
(2)已知K2FeO4在水溶液中易水解:4 + 10H2O=4Fe(OH)3(胶体)+8OH- +3O2↑。在“提纯”K2FeO4时采用重结晶、洗涤、
+ 10H2O=4Fe(OH)3(胶体)+8OH- +3O2↑。在“提纯”K2FeO4时采用重结晶、洗涤、____ (填“高温”或“低温”)烘干的方法,则洗涤剂最好选用___ (填“酸性”“碱性”或“中性”)溶液和______ (填“水”或“有机溶剂”)。
(3)反应的温度、原料的浓度和配比对高铁酸钾的产率都有影响。
图2为不同的反应温度下,Fe(NO3)3质量浓度对K2FeO4生成率的影响;
图3为一定温度下,最佳Fe(NO3)3质量浓度时,NaClO的质量浓度对K2FeO4生成率的影响。

工业生产中最佳反应温度为____ °C,此时Fe(NO3)3与NaClO两种溶液的最佳质量浓度之比___ 。
(4)用高铁酸钾处理污水,能去污、杀菌、消毒,且高铁酸钾自身被还原生成的Fe3+水解生成Fe(OH)3胶体。现有两种分别含有葡萄糖、甲苯的人工污水,每升分别加入30 mgK2FeO4,相同温度下最终去除效果如表。
已知化学需氧量(COD)是在一定条件下,以氧化1升水样中还原性物质所消耗的氧化剂的量为指标,折算成每升水样全部被氧化后,需要的氧的毫克数,以mg·L-1表示。该指标也作为污水中有机物相对含量的综合指标之一。含甲苯的1 L污水,当甲苯去除率为73.24%时,理论上需高铁酸钾_____ mg。[已知M(K2FeO4)=198 g/ mol]。理论上需要的m(K2FeO4)大于实际用量,说明K2FeO4去除有机污水的原理除了氧化作用外,另一个原因可能是_______ 。
(5)工业上通过电解浓NaOH溶液制备K2FeO4,其工作原理如图4所示,阳极的电极反应式为_________ ,其中可循环使用的物质是_________________ 。
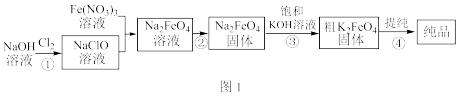
回答下列问题:
(1)NaClO溶液与Fe(NO3)3溶液反应的离子方程式是
(2)已知K2FeO4在水溶液中易水解:4
 + 10H2O=4Fe(OH)3(胶体)+8OH- +3O2↑。在“提纯”K2FeO4时采用重结晶、洗涤、
+ 10H2O=4Fe(OH)3(胶体)+8OH- +3O2↑。在“提纯”K2FeO4时采用重结晶、洗涤、(3)反应的温度、原料的浓度和配比对高铁酸钾的产率都有影响。
图2为不同的反应温度下,Fe(NO3)3质量浓度对K2FeO4生成率的影响;
图3为一定温度下,最佳Fe(NO3)3质量浓度时,NaClO的质量浓度对K2FeO4生成率的影响。

工业生产中最佳反应温度为
(4)用高铁酸钾处理污水,能去污、杀菌、消毒,且高铁酸钾自身被还原生成的Fe3+水解生成Fe(OH)3胶体。现有两种分别含有葡萄糖、甲苯的人工污水,每升分别加入30 mgK2FeO4,相同温度下最终去除效果如表。
项目 | 葡萄糖溶液 | 甲苯溶液 |
起始COD/(mg·L-1) | 1 124 | 1 966 |
处理后COD/( mg·L-1) | 983 | 526 |
去除率/% | 11.54 | 73. 24 |
已知化学需氧量(COD)是在一定条件下,以氧化1升水样中还原性物质所消耗的氧化剂的量为指标,折算成每升水样全部被氧化后,需要的氧的毫克数,以mg·L-1表示。该指标也作为污水中有机物相对含量的综合指标之一。含甲苯的1 L污水,当甲苯去除率为73.24%时,理论上需高铁酸钾
(5)工业上通过电解浓NaOH溶液制备K2FeO4,其工作原理如图4所示,阳极的电极反应式为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐2】现有m g含有 杂质的
杂质的 样品,某同学在实验室用如图装置(部分夹持仪器已省略)测定其杂质含量:
样品,某同学在实验室用如图装置(部分夹持仪器已省略)测定其杂质含量:

已知:碱石灰主要含有氧化钙和氢氧化钠
回答下列问题:
(1)将仪器连接好后,首先要进行的实验操作是___________ 。
(2)装置B中饱和碳酸氢钠的作用是除去 中HCl气体,该过程涉及的离子反应方程式
中HCl气体,该过程涉及的离子反应方程式___________ 。
(3)装置C中 和
和 反应的化学方程式:
反应的化学方程式:___________ 。
(4)若无装置D,测得样品中 的质量分数
的质量分数___________ (填“偏高”“偏低”或“无影响”)。
(5)m g样品充分反应后,待冷却后读出装置F中水的体积,将其折算成产生气体的质量为n g,则样品中 的质量分数为
的质量分数为___________ (用含m、n的代数式表示,列出计算式即可)。
 杂质的
杂质的 样品,某同学在实验室用如图装置(部分夹持仪器已省略)测定其杂质含量:
样品,某同学在实验室用如图装置(部分夹持仪器已省略)测定其杂质含量:
已知:碱石灰主要含有氧化钙和氢氧化钠
回答下列问题:
(1)将仪器连接好后,首先要进行的实验操作是
(2)装置B中饱和碳酸氢钠的作用是除去
 中HCl气体,该过程涉及的离子反应方程式
中HCl气体,该过程涉及的离子反应方程式(3)装置C中
 和
和 反应的化学方程式:
反应的化学方程式:(4)若无装置D,测得样品中
 的质量分数
的质量分数(5)m g样品充分反应后,待冷却后读出装置F中水的体积,将其折算成产生气体的质量为n g,则样品中
 的质量分数为
的质量分数为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐3】碘化钾常用作钢铁酸洗缓蚀剂或者其他缓蚀剂的增效剂。探究小组同学在实验室中制取 并探究
并探究 与
与 的反应。已知:
的反应。已知: 与
与 溶液反应的产物之一是
溶液反应的产物之一是 。实验室制取
。实验室制取 的步骤如下:
的步骤如下:
Ⅰ.向如图所示装置(夹持装置略去,装置气密性好)的仪器D中加入63.5g研细的单质碘和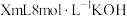 溶液,搅拌;
溶液,搅拌;
Ⅱ.碘完全反应后,打开A装置中的分液漏斗活塞和弹簧夹,向仪器D中缓缓通入足量 ;
;
Ⅲ.反应后,向仪器D中加入适量稀硫酸酸化,水浴加热;
Ⅳ.冷却、过滤得 粗溶液。
粗溶液。

回答下列问题:
(1)仪器a的名称为___________ ,装置B的作用是___________ 。
(2)步骤Ⅰ为保证碘完全反应,D中加入 溶液的体积X至少为
溶液的体积X至少为___________ mL。
(3)向装置D中通入 后发生反应的离子方程式为
后发生反应的离子方程式为___________ 。
(4)步骤Ⅲ中水浴加热的目的是___________ 。
(5)探究 溶液与
溶液与 的反应实验记录如下:
的反应实验记录如下:
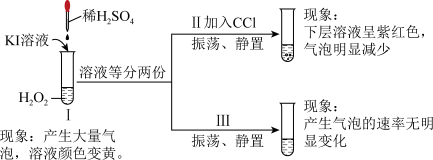
①实验Ⅰ过程中发生的反应有:___________ (用化学方程式表示)。
②比较实验Ⅱ、Ⅲ,实验Ⅱ中气泡明显减少的主要原因是___________ 。
 并探究
并探究 与
与 的反应。已知:
的反应。已知: 与
与 溶液反应的产物之一是
溶液反应的产物之一是 。实验室制取
。实验室制取 的步骤如下:
的步骤如下:Ⅰ.向如图所示装置(夹持装置略去,装置气密性好)的仪器D中加入63.5g研细的单质碘和
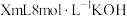 溶液,搅拌;
溶液,搅拌;Ⅱ.碘完全反应后,打开A装置中的分液漏斗活塞和弹簧夹,向仪器D中缓缓通入足量
 ;
;Ⅲ.反应后,向仪器D中加入适量稀硫酸酸化,水浴加热;
Ⅳ.冷却、过滤得
 粗溶液。
粗溶液。
回答下列问题:
(1)仪器a的名称为
(2)步骤Ⅰ为保证碘完全反应,D中加入
 溶液的体积X至少为
溶液的体积X至少为(3)向装置D中通入
 后发生反应的离子方程式为
后发生反应的离子方程式为(4)步骤Ⅲ中水浴加热的目的是
(5)探究
 溶液与
溶液与 的反应实验记录如下:
的反应实验记录如下:
①实验Ⅰ过程中发生的反应有:
②比较实验Ⅱ、Ⅲ,实验Ⅱ中气泡明显减少的主要原因是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐1】某化学实验需要480mL0.10mol/LNa2CO3溶液,某同学选用Na2CO3•10H2O晶体进行配制,简要回答下列问题:
(1)实验时要用到的仪器有:除托盘天平、量筒、烧杯、玻璃棒、胶头滴管外,至少还必须用到的一种玻璃仪器是_____ 。
(2)需用托盘天平称取Na2CO3•10H2O晶体的质量,若在称量样品时,药品放在天平右盘上,砝码放在天平左盘上,天平平衡时实际称量的碳酸钠晶体是________ g(1g以下用游码)。
(3)该实验的正确操作顺序是_____ (填字母代号)。
A.用托盘天平称取Na2CO3•10H2O晶体
B.上下颠倒摇匀
C.用胶头滴管加水至刻度线
D.洗涤所用仪器并将洗涤液转移进容量瓶
E.将所称取的晶体溶于蒸馏水并冷却至室温
F.将溶液转入容量瓶
(4)配制过程中,若遇下列情况,使得所配溶液的浓度偏低的是__________
a.Na2CO3•10H2O晶体不纯,混有NaCl
b.定容时,俯视刻度线
c.容量瓶中洗净后未干燥,残留少量水
d.未冷却至室温就转移定容
e.加蒸馏水时不慎超过了刻度线,立即用胶头滴管将多余的水吸出
f.上下摇匀后,发现液面低于刻度线,再加蒸馏水至刻度线
(5)向200mL所配的0.10mol/LNa2CO3溶液中加入20mL12.25%稀H2SO4(ρ=1.0g/cm3),理论上能收集到标准状况下的气体______ mL。
(1)实验时要用到的仪器有:除托盘天平、量筒、烧杯、玻璃棒、胶头滴管外,至少还必须用到的一种玻璃仪器是
(2)需用托盘天平称取Na2CO3•10H2O晶体的质量,若在称量样品时,药品放在天平右盘上,砝码放在天平左盘上,天平平衡时实际称量的碳酸钠晶体是
(3)该实验的正确操作顺序是
A.用托盘天平称取Na2CO3•10H2O晶体
B.上下颠倒摇匀
C.用胶头滴管加水至刻度线
D.洗涤所用仪器并将洗涤液转移进容量瓶
E.将所称取的晶体溶于蒸馏水并冷却至室温
F.将溶液转入容量瓶
(4)配制过程中,若遇下列情况,使得所配溶液的浓度偏低的是
a.Na2CO3•10H2O晶体不纯,混有NaCl
b.定容时,俯视刻度线
c.容量瓶中洗净后未干燥,残留少量水
d.未冷却至室温就转移定容
e.加蒸馏水时不慎超过了刻度线,立即用胶头滴管将多余的水吸出
f.上下摇匀后,发现液面低于刻度线,再加蒸馏水至刻度线
(5)向200mL所配的0.10mol/LNa2CO3溶液中加入20mL12.25%稀H2SO4(ρ=1.0g/cm3),理论上能收集到标准状况下的气体
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐2】已知某“84”消毒液瓶体部分标签如图所示,该“84”消毒液通常稀释100倍(体积之比)后使用。请回答下列问题:

(1)该“84”消毒液的物质的量浓度约为___________ (结果保留1位小数)mol·L-1。
(2)某同学取100mL该“84”消毒液,稀释后用于消毒,稀释后的溶液中c(Na+)=___________ mol·L-1。
(3)该同学参阅该“84”消毒液的配方,欲用NaClO固体配制480mL含NaClO质量分数为25%的消毒液。下列说法正确的是___________(填字母)。

(4)“84”消毒液与稀硫酸混合使用可增强消毒能力,某消毒小组人员用98%(密度为1.84g·cm-3)的浓硫酸配制2L2.3mol·L-1的稀硫酸用于增强“84”消毒液的消毒能力。
①所配制的稀硫酸中,H+的物质的量浓度为___________ mol·L-1。
②需用浓硫酸的体积为___________ mL。

(1)该“84”消毒液的物质的量浓度约为
(2)某同学取100mL该“84”消毒液,稀释后用于消毒,稀释后的溶液中c(Na+)=
(3)该同学参阅该“84”消毒液的配方,欲用NaClO固体配制480mL含NaClO质量分数为25%的消毒液。下列说法正确的是___________(填字母)。

| A.如图所示的仪器中,有三种是不需要的,还需要一种玻璃仪器 |
| B.把称取的固体放在容量瓶中溶解,冷却至室温后稀释至500mL |
| C.配制过程中,未用蒸馏水洗涤烧杯和玻璃棒会导致结果偏低 |
| D.需要称量NaClO固体的质量为143.0g |
(4)“84”消毒液与稀硫酸混合使用可增强消毒能力,某消毒小组人员用98%(密度为1.84g·cm-3)的浓硫酸配制2L2.3mol·L-1的稀硫酸用于增强“84”消毒液的消毒能力。
①所配制的稀硫酸中,H+的物质的量浓度为
②需用浓硫酸的体积为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐3】“物质的量”搭建起宏观和微观世界的桥梁,以物质的量为中心的计算和应用无处不在。
(1)已知 受热分解产生
受热分解产生 和
和 ,且常温常压下气体摩尔体积为
,且常温常压下气体摩尔体积为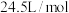 ,则在常温常压下,
,则在常温常压下,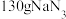 发生分解反应能产生
发生分解反应能产生___________ L的 。
。
(2)在标准状况下,向 氢氧化钠溶液中通入
氢氧化钠溶液中通入 二氧化碳气体充分反应,所得溶液溶质的成分是
二氧化碳气体充分反应,所得溶液溶质的成分是___________ 。
(3)在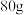 浓度为
浓度为 、密度为
、密度为 的氨水中加入一定量的水稀释成
的氨水中加入一定量的水稀释成 的稀氨水,则加入水的体积___________。
的稀氨水,则加入水的体积___________。
(4)下图是某硫酸试剂瓶标签上的内容:
①某化学兴趣小组进行硫酸性质的实验探究时,需要 的稀硫酸,则配制该稀硫酸需要用量筒量取
的稀硫酸,则配制该稀硫酸需要用量筒量取___________  该浓硫酸。
该浓硫酸。
②在下列配制过程示意图中,有错误的是___________ (填序号)。

③在配制 稀硫酸的过程中,下列情况会引起硫酸的物质的量浓度偏高的是
稀硫酸的过程中,下列情况会引起硫酸的物质的量浓度偏高的是_______ (填序号)。
A.未经冷却趁热将溶液注入容量瓶中进行定容
B.容量瓶洗涤后,未经干燥处理
C.定容时仰视容量瓶刻度线
D.用蒸馏水洗涤量筒中的残留液并转移至容量瓶
(1)已知
 受热分解产生
受热分解产生 和
和 ,且常温常压下气体摩尔体积为
,且常温常压下气体摩尔体积为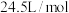 ,则在常温常压下,
,则在常温常压下,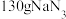 发生分解反应能产生
发生分解反应能产生 。
。(2)在标准状况下,向
 氢氧化钠溶液中通入
氢氧化钠溶液中通入 二氧化碳气体充分反应,所得溶液溶质的成分是
二氧化碳气体充分反应,所得溶液溶质的成分是(3)在
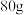 浓度为
浓度为 、密度为
、密度为 的氨水中加入一定量的水稀释成
的氨水中加入一定量的水稀释成 的稀氨水,则加入水的体积___________。
的稀氨水,则加入水的体积___________。A.等于 | B.等于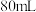 | C.小于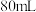 | D.大于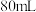 |
(4)下图是某硫酸试剂瓶标签上的内容:
硫酸化学纯 品名:硫酸 化学式:  相对分子质量:98 密度:  质量分数: 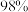 |
 的稀硫酸,则配制该稀硫酸需要用量筒量取
的稀硫酸,则配制该稀硫酸需要用量筒量取 该浓硫酸。
该浓硫酸。②在下列配制过程示意图中,有错误的是

③在配制
 稀硫酸的过程中,下列情况会引起硫酸的物质的量浓度偏高的是
稀硫酸的过程中,下列情况会引起硫酸的物质的量浓度偏高的是A.未经冷却趁热将溶液注入容量瓶中进行定容
B.容量瓶洗涤后,未经干燥处理
C.定容时仰视容量瓶刻度线
D.用蒸馏水洗涤量筒中的残留液并转移至容量瓶
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
【推荐1】化学创造美好生活。磷酸锌是一种绿色环保涂料,实验室用锌灰(含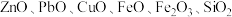 等)为原料制备
等)为原料制备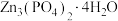 。(难溶于水)的流程如下,回答下列问题:
。(难溶于水)的流程如下,回答下列问题:
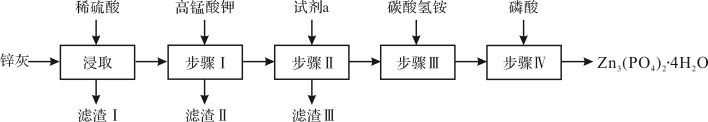
已知:
①本实验条件下高锰酸钾的还原产物为 。
。
② 。
。
(1)滤渣I的主要成分为___________ 。
(2)步骤的主要目的是除去铁元素,需先将溶液的 调至5.0,再滴加
调至5.0,再滴加 溶液,滴加时的离子方程式为
溶液,滴加时的离子方程式为___________ 。
(3)步骤Ⅱ的主要目的是除去铜元素,试剂a为___________ (填化学式)。
(4)步骤Ⅲ在加热条件下生成一种温室气体和沉淀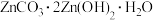 ,其离子方程式为
,其离子方程式为___________ 。
(5)步骤IV反应结束后,得到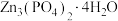 的操作包括
的操作包括___________ 、___________ 和干燥。
(6)锌的某种氧化物的立方晶胞结构如下图所示,晶胞参数为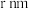 。
。
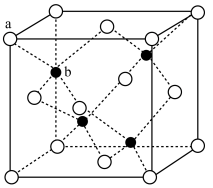 (晶胞中a为氧,b为锌)
(晶胞中a为氧,b为锌)
①写出基态 原子的价层电子排布式
原子的价层电子排布式___________ 。
② 和O之间最短的距离为
和O之间最短的距离为___________  。
。
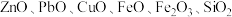 等)为原料制备
等)为原料制备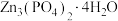 。(难溶于水)的流程如下,回答下列问题:
。(难溶于水)的流程如下,回答下列问题:
已知:
①本实验条件下高锰酸钾的还原产物为
 。
。②
 。
。(1)滤渣I的主要成分为
(2)步骤的主要目的是除去铁元素,需先将溶液的
 调至5.0,再滴加
调至5.0,再滴加 溶液,滴加时的离子方程式为
溶液,滴加时的离子方程式为(3)步骤Ⅱ的主要目的是除去铜元素,试剂a为
(4)步骤Ⅲ在加热条件下生成一种温室气体和沉淀
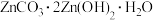 ,其离子方程式为
,其离子方程式为(5)步骤IV反应结束后,得到
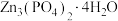 的操作包括
的操作包括(6)锌的某种氧化物的立方晶胞结构如下图所示,晶胞参数为
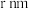 。
。 (晶胞中a为氧,b为锌)
(晶胞中a为氧,b为锌)①写出基态
 原子的价层电子排布式
原子的价层电子排布式②
 和O之间最短的距离为
和O之间最短的距离为 。
。
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐2】1,2-二溴乙烷的制备原理是 ,
, 。某课题小组用下图所示的装置制备1,2-二溴乙烷。
。某课题小组用下图所示的装置制备1,2-二溴乙烷。
(1)装置B的作用是_______ ,装置C的作用是_______ 。
(2)三颈瓶内加入一定量的乙醇-浓硫酸混合液和少量粗砂,加入粗砂的目的是_______ ,仪器F的名称是_______ 。
(3)加热三颈烧瓶前,先将C与D连接处断开,再将三颈烧瓶在石棉网上加热,待温度升到约120℃时,连接C与D,并迅速将A反应温度升温至160~180℃,从F中慢慢滴加乙醇-浓硫酸混合液,保持乙烯气体均匀地通入装有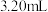 液溴(
液溴( )和3mL水的D中试管,直至反应结束。(Br的相对原子质量为80;1,2-二溴乙烷的相对分子质量为188)
)和3mL水的D中试管,直至反应结束。(Br的相对原子质量为80;1,2-二溴乙烷的相对分子质量为188)
①将C与D连接处断开的原因是_______ 。
②判断反应结束的现象是_______ 。
(4)将粗产品通过以下操作提纯得到1,2-二溴乙烷。
a.水洗涤
b.氢氧化钠溶液洗涤
c.过滤
d.用无水氯化钙干燥
e.蒸馏收集129~133℃馏分,最后得到 产品(1,2-二溴乙烷)
产品(1,2-二溴乙烷)
①粗品提纯的顺序是a→b→a→_______ 。(填序号)
②1,2-二溴乙烷的产率为_______ 。
(5)下列操作中,不会导致产物产率降低的是_______ 。(填正确答案的标号)
a.乙烯通过溴水时速率太快
b.装置C中的NaOH溶液用水代替
c.去掉装置D烧杯中的水
d.实验时没有E装置
e.试管D中不加水
 ,
, 。某课题小组用下图所示的装置制备1,2-二溴乙烷。
。某课题小组用下图所示的装置制备1,2-二溴乙烷。
(1)装置B的作用是
(2)三颈瓶内加入一定量的乙醇-浓硫酸混合液和少量粗砂,加入粗砂的目的是
(3)加热三颈烧瓶前,先将C与D连接处断开,再将三颈烧瓶在石棉网上加热,待温度升到约120℃时,连接C与D,并迅速将A反应温度升温至160~180℃,从F中慢慢滴加乙醇-浓硫酸混合液,保持乙烯气体均匀地通入装有
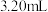 液溴(
液溴( )和3mL水的D中试管,直至反应结束。(Br的相对原子质量为80;1,2-二溴乙烷的相对分子质量为188)
)和3mL水的D中试管,直至反应结束。(Br的相对原子质量为80;1,2-二溴乙烷的相对分子质量为188)①将C与D连接处断开的原因是
②判断反应结束的现象是
(4)将粗产品通过以下操作提纯得到1,2-二溴乙烷。
a.水洗涤
b.氢氧化钠溶液洗涤
c.过滤
d.用无水氯化钙干燥
e.蒸馏收集129~133℃馏分,最后得到
 产品(1,2-二溴乙烷)
产品(1,2-二溴乙烷)①粗品提纯的顺序是a→b→a→
②1,2-二溴乙烷的产率为
(5)下列操作中,不会导致产物产率降低的是
a.乙烯通过溴水时速率太快
b.装置C中的NaOH溶液用水代替
c.去掉装置D烧杯中的水
d.实验时没有E装置
e.试管D中不加水
您最近一年使用:0次
【推荐3】实验室里需要纯净的氯化钠溶液,但现在只有混有硫酸钠、碳酸氢铵的氯化钠固体。某学生设计了如图方案,请回答下列问题。

已知:操作①中发生的化学反应方程式为:NH4HCO3 NH3↑+CO2↑+H2O↑。
NH3↑+CO2↑+H2O↑。
(1)试剂1最好为_______ (填化学式)。
(2)加入试剂2的目的________ ,此时发生反应的离子方程式:________ 。
(3)加入盐酸时,所发生反应的离子方程式:_______ 。
(4)操作④的目的是_______
(5)如何检验产品中的溶质为NaCl_______ 。

已知:操作①中发生的化学反应方程式为:NH4HCO3
 NH3↑+CO2↑+H2O↑。
NH3↑+CO2↑+H2O↑。(1)试剂1最好为
(2)加入试剂2的目的
(3)加入盐酸时,所发生反应的离子方程式:
(4)操作④的目的是
(5)如何检验产品中的溶质为NaCl
您最近一年使用:0次
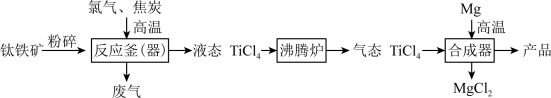
【推荐1】钛和钛合金被认为是21世纪的重要金属材料,广泛用于火箭、飞机制造业等。如图是工业上利用钛铁矿,其主要成分为钛酸亚铁(FeTiO3)制备金属钛的工艺流程。
资料:Ti为固体,化学性质稳定,不溶于稀硫酸、稀盐酸等。
(1)钛酸亚铁(FeTiO3)中钛元素的化合价是___________ 。
(2)钛铁矿在投入反应釜前要先粉碎,其目的是___________ ;反应釜中发生的反应是: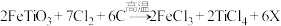 ,X为反应产生的废气,其化学式是
,X为反应产生的废气,其化学式是___________ 。
(3)反应釜中得到TiCl4和FeCl3的混合物在沸腾炉中分离,这是利用了TiCl4与FeCl3的___________ 不同。
(4)写出合成器中反应的化学方程式___________ 。
(5)利用上述方法制取的金属钛中可能会含有少量杂质,该杂质是金属___________ ,由金属钛的性质可知,除去这种杂质可以用___________ (填试剂名称)。
(6)依据“绿色低碳”理念,你认为该流程中存在的不足之处是___________ 。
资料:Ti为固体,化学性质稳定,不溶于稀硫酸、稀盐酸等。

(1)钛酸亚铁(FeTiO3)中钛元素的化合价是
(2)钛铁矿在投入反应釜前要先粉碎,其目的是
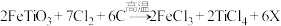 ,X为反应产生的废气,其化学式是
,X为反应产生的废气,其化学式是(3)反应釜中得到TiCl4和FeCl3的混合物在沸腾炉中分离,这是利用了TiCl4与FeCl3的
(4)写出合成器中反应的化学方程式
(5)利用上述方法制取的金属钛中可能会含有少量杂质,该杂质是金属
(6)依据“绿色低碳”理念,你认为该流程中存在的不足之处是
您最近一年使用:0次
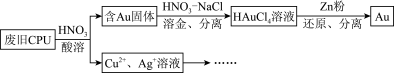
【推荐2】用如图方法回收废旧CPU中的单质Au(金),Ag和Cu。
已知:①浓硝酸不能单独将 溶解。②
溶解。②
(1)酸溶后经___________ 操作,将混合物分离。
(2)浓、稀 均可作酸溶试剂。溶解等量的
均可作酸溶试剂。溶解等量的 消耗
消耗 的物质的量不同,写出消耗
的物质的量不同,写出消耗 物质的量少的反应的化学方程式:
物质的量少的反应的化学方程式:___________ 。
(3)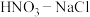 与王水[
与王水[ (浓硝酸):
(浓硝酸): (浓盐酸)
(浓盐酸) 溶金原理相同。关于溶金的下列说法正确的是
溶金原理相同。关于溶金的下列说法正确的是___________ 。
A.用到了 的氧化性
的氧化性
B.王水中浓盐酸的主要作用是增强溶液的酸性
C.用浓盐酸与 也可使
也可使 溶解
溶解
(4)若用 粉将溶液中的
粉将溶液中的 完全还原,则参加反应的
完全还原,则参加反应的 的物质的量是
的物质的量是___________ mol。
(5)用适当浓度的盐酸、 溶液、氨水与铁粉,可按照如图方法从酸溶后的溶液中回收
溶液、氨水与铁粉,可按照如图方法从酸溶后的溶液中回收 和
和 (图中标注的试剂和物质均不同)。
(图中标注的试剂和物质均不同)。
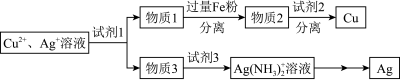
试剂1是___________ ,物质2是___________ 。

已知:①浓硝酸不能单独将
 溶解。②
溶解。②
(1)酸溶后经
(2)浓、稀
 均可作酸溶试剂。溶解等量的
均可作酸溶试剂。溶解等量的 消耗
消耗 的物质的量不同,写出消耗
的物质的量不同,写出消耗 物质的量少的反应的化学方程式:
物质的量少的反应的化学方程式:(3)
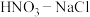 与王水[
与王水[ (浓硝酸):
(浓硝酸): (浓盐酸)
(浓盐酸) 溶金原理相同。关于溶金的下列说法正确的是
溶金原理相同。关于溶金的下列说法正确的是A.用到了
 的氧化性
的氧化性B.王水中浓盐酸的主要作用是增强溶液的酸性
C.用浓盐酸与
 也可使
也可使 溶解
溶解(4)若用
 粉将溶液中的
粉将溶液中的 完全还原,则参加反应的
完全还原,则参加反应的 的物质的量是
的物质的量是(5)用适当浓度的盐酸、
 溶液、氨水与铁粉,可按照如图方法从酸溶后的溶液中回收
溶液、氨水与铁粉,可按照如图方法从酸溶后的溶液中回收 和
和 (图中标注的试剂和物质均不同)。
(图中标注的试剂和物质均不同)。
试剂1是
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐3】锶为第IIA族元素,有“金属味精”之称,锶及其化合物广泛应该用于工业、医药、军事等领域。碳酸锶( )是制备多种锶盐化合物的中间产品。以含锶矿物为原料可以制得高纯碳酸锶。
)是制备多种锶盐化合物的中间产品。以含锶矿物为原料可以制得高纯碳酸锶。
已知:常温下, ,
, ,
, 。
。
(1)一种以菱锶矿(主要含 ,还含有少量
,还含有少量 、
、 、
、 )为原料制备高纯碳酸锶的工艺流程如下:
)为原料制备高纯碳酸锶的工艺流程如下:

已知: 、
、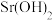 、
、 在水中的溶解度(g)见下表:
在水中的溶解度(g)见下表:
①“浸取”时,四种金属元素均转化为对应的氢氧化物,用热水浸取的目的除加快浸取速率外,还有___________ 。
②“趁热过滤”后,所得“滤渣”的成分为___________ 。
③“碳化”过程中需要控制温度为90℃左右,原因是___________ 。该过程中发生反应的离子方程式为___________ 。
(2)以天青石(主要成分是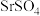 )为原料可以制备得到碳酸锶。该制备过程中涉及的主要反应为
)为原料可以制备得到碳酸锶。该制备过程中涉及的主要反应为 。向
。向 溶液中加入少量天青石粉末,充分浸泡一段时间后测得溶液中
溶液中加入少量天青石粉末,充分浸泡一段时间后测得溶液中 。判断此时是否达到平衡,并说明理由:
。判断此时是否达到平衡,并说明理由:___________ 。
 )是制备多种锶盐化合物的中间产品。以含锶矿物为原料可以制得高纯碳酸锶。
)是制备多种锶盐化合物的中间产品。以含锶矿物为原料可以制得高纯碳酸锶。已知:常温下,
 ,
, ,
, 。
。(1)一种以菱锶矿(主要含
 ,还含有少量
,还含有少量 、
、 、
、 )为原料制备高纯碳酸锶的工艺流程如下:
)为原料制备高纯碳酸锶的工艺流程如下:
已知:
 、
、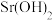 、
、 在水中的溶解度(g)见下表:
在水中的溶解度(g)见下表:| 温度/℃ | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 |
 | 0.176 | 0.165 | 0.153 | 0.141 | 0.116 | 0.106 | 0.094 | 0.035 | 0.019 |
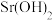 | 0.48 | 0.69 | 1.09 | 1.8 | 3.13 | 4.53 | 7.03 | 13.6 | 24.2 |
 | 2.48 | 3.89 | 5.59 | 8.22 | 20.94 | 35.6 | 101.4 | —— | —— |
②“趁热过滤”后,所得“滤渣”的成分为
③“碳化”过程中需要控制温度为90℃左右,原因是
(2)以天青石(主要成分是
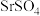 )为原料可以制备得到碳酸锶。该制备过程中涉及的主要反应为
)为原料可以制备得到碳酸锶。该制备过程中涉及的主要反应为 。向
。向 溶液中加入少量天青石粉末,充分浸泡一段时间后测得溶液中
溶液中加入少量天青石粉末,充分浸泡一段时间后测得溶液中 。判断此时是否达到平衡,并说明理由:
。判断此时是否达到平衡,并说明理由:
您最近一年使用:0次



