回答下列问题
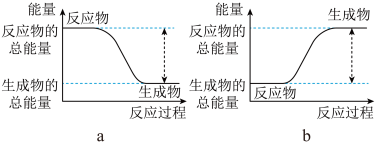
(1)从能量的变化和反应的快慢等角度研究反应: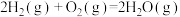 。已知该反应为放热反应,如图能正确表示该反应中能量变化的是
。已知该反应为放热反应,如图能正确表示该反应中能量变化的是______ 。
从断键和成键的角度分析上述反应中能量的变化,化学键的键能如表所示。
反应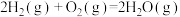 的
的
______ kJ/mol。则该反应生成1 mol  可以放出热量是
可以放出热量是______ kJ。
(2) 溶液常用于腐蚀印刷电路铜板,发生
溶液常用于腐蚀印刷电路铜板,发生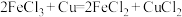 ,若将此反应设计成原电池,则负极所用电极材料为:
,若将此反应设计成原电池,则负极所用电极材料为:______ 。当线路中转移0.2 mol电子时,则被腐蚀铜的质量为:______ g。
(3)铅蓄电池在放电时发生的电池反应式为: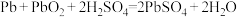 ,负极电极反应式为:
,负极电极反应式为:__________________ 。
(1)从能量的变化和反应的快慢等角度研究反应:
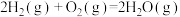 。已知该反应为放热反应,如图能正确表示该反应中能量变化的是
。已知该反应为放热反应,如图能正确表示该反应中能量变化的是
从断键和成键的角度分析上述反应中能量的变化,化学键的键能如表所示。
| 化学键 |  |  |  |
| 键能(kJ/mol) | 436 | 496 | 463 |
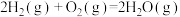 的
的
 可以放出热量是
可以放出热量是(2)
 溶液常用于腐蚀印刷电路铜板,发生
溶液常用于腐蚀印刷电路铜板,发生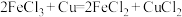 ,若将此反应设计成原电池,则负极所用电极材料为:
,若将此反应设计成原电池,则负极所用电极材料为:(3)铅蓄电池在放电时发生的电池反应式为:
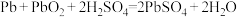 ,负极电极反应式为:
,负极电极反应式为:
更新时间:2023-11-02 10:42:37
|
相似题推荐
【推荐1】某化学兴趣小组进行了实验:向2支试管中分别加入0.5 g Na2CO3固体和0.5 gNaHCO3固体,再分别加入30 mL 0.3 mol·L-1盐酸,充分反应后,用手触摸试管,明显感觉到加Na2CO3固体的试管变热了,加NaHCO3固体的试管变冷了。甲同学由此得出结论:CO (aq) +2H+ (aq)=H2O(1) +CO2(g)△H1<0, HCO
(aq) +2H+ (aq)=H2O(1) +CO2(g)△H1<0, HCO (aq)+H+ (aq)=H2O(1) +CO2(g) △H2>0。回答下列问题:
(aq)+H+ (aq)=H2O(1) +CO2(g) △H2>0。回答下列问题:
(1)乙同学认为该实验不一定能得到甲同学的结论,你支持谁的观点?_____ (填“甲”或“乙”) ,理由是_______ 。
(2)查阅资料:
反应I :CO (aq) +2H+ (aq)=H2O(l) +CO2(g) △H1= -12.14kJ· mol-1;
(aq) +2H+ (aq)=H2O(l) +CO2(g) △H1= -12.14kJ· mol-1;
反应II :HCO (aq) +H+ (aq)=H2O(l) +CO2(g) △H2= +12.64 kJ·mol-1。
(aq) +H+ (aq)=H2O(l) +CO2(g) △H2= +12.64 kJ·mol-1。
向V mLc mol· L-1碳酸钠溶液中,逐滴加入2V mLc mol·L-1稀盐酸。下列图象中,能正确表示该反应过程中的能量变化的是 (填标号)。
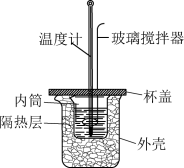
(3)该化学兴趣小组用如图所示装置设计了实验,验证碳酸钠、碳酸氢钠分别与稀盐酸反应的热效应。
表格一:
表格二:
表格三:
实验操作:将试剂1与试剂2混合,测混合后溶液的温度,静置,冷却至定温,再将试剂3与之前的混合溶液混合,再测混合溶液的温度。
①实验中玻璃搅拌器的使用方法是_______________ 。
②表格二对应实验得出的结论是________________ 。
③反应III:Na2CO3(s) +2H+ (aq)=2Na+ (aq) +H2O(1) +CO2(g) △H3;
反应IV:NaHCO3(s)+ H+ (aq)=Na+ (aq) + H2O(l) +CO2(g) △H4。
则△H1______ (填“>”、“< ”或“=”,下同) △H3,△H2______ △H4。
 (aq) +2H+ (aq)=H2O(1) +CO2(g)△H1<0, HCO
(aq) +2H+ (aq)=H2O(1) +CO2(g)△H1<0, HCO (aq)+H+ (aq)=H2O(1) +CO2(g) △H2>0。回答下列问题:
(aq)+H+ (aq)=H2O(1) +CO2(g) △H2>0。回答下列问题:(1)乙同学认为该实验不一定能得到甲同学的结论,你支持谁的观点?
(2)查阅资料:
反应I :CO
 (aq) +2H+ (aq)=H2O(l) +CO2(g) △H1= -12.14kJ· mol-1;
(aq) +2H+ (aq)=H2O(l) +CO2(g) △H1= -12.14kJ· mol-1;反应II :HCO
 (aq) +H+ (aq)=H2O(l) +CO2(g) △H2= +12.64 kJ·mol-1。
(aq) +H+ (aq)=H2O(l) +CO2(g) △H2= +12.64 kJ·mol-1。向V mLc mol· L-1碳酸钠溶液中,逐滴加入2V mLc mol·L-1稀盐酸。下列图象中,能正确表示该反应过程中的能量变化的是 (填标号)。
A.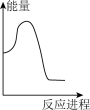 | B.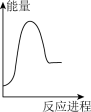 | C.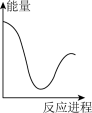 | D.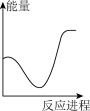 |

表格一:
试剂1 | 试剂2混合前温度/℃ | 混合后温度/℃ |
0.5 g Na2CO3 | 40mL HCl 19.0 | 21.7 |
0.5 g NaHCO3 | 40 mL HCl 19.0 | 18.1 |
表格二:
试剂1 | 试剂2混合 前温度/℃ | 溶解后温 度/℃ | 静置后的 温度/℃ | 试剂3混合 前温度/℃ | 混合后 温度/℃ |
0.5 g Na2CO3 | 10 mL H2O19.0 | 22. 3 | 19.0 | 10mL H2O 19.0 | 19.0 |
0.5 g NaHCO3 | 10 mL H2O19.0 | 17.5 | 19.0 | 10 mL H2O 19.0 | 19.0 |
表格三:
试剂1 | 试剂2混合 前温度/℃ | 溶解后温 度/℃ | 静置后的 温度/℃ | 试剂3混合 前温度/℃ | 混合后 温度/℃ |
0.5 g Na2CO3 | 10 mL H2O19.0 | 22.3 | 19.0 | 10mL HCl 19.0 | 20.5 |
0.5 g NaHCO3 | 10 mL H2O19.0 | 17.5 | 19.0 | 10 mL HCl19.0 | 18.3 |
实验操作:将试剂1与试剂2混合,测混合后溶液的温度,静置,冷却至定温,再将试剂3与之前的混合溶液混合,再测混合溶液的温度。
①实验中玻璃搅拌器的使用方法是
②表格二对应实验得出的结论是
③反应III:Na2CO3(s) +2H+ (aq)=2Na+ (aq) +H2O(1) +CO2(g) △H3;
反应IV:NaHCO3(s)+ H+ (aq)=Na+ (aq) + H2O(l) +CO2(g) △H4。
则△H1
您最近一年使用:0次
解答题-原理综合题
|
较易
(0.85)
解题方法
【推荐2】Ⅰ.CH3OH是一种无色有刺激性气味的液体,在生产生活中有重要用途,同时也是一种重要的化工原料。
(1)已知CH3OH(g)+ O2(g)
O2(g) CO2(g)+2H2(g)的能量变化如图所示,下列说法正确的是
CO2(g)+2H2(g)的能量变化如图所示,下列说法正确的是_____ (填字母)。

a.CH3OH转变成H2的过程是一个吸收能量的过程
b.H2的生成速率与CH3OH的消耗速率之比为1∶2
c.化学变化不仅有新物质生成,同时也一定有能量变化
d.1molH-O键断裂的同时2molC=O键断裂,则反应达最大限度
(2)某温度下,将5molCH3OH和2molO2充入2L的密闭容器中,经过4min反应达到平衡,测得c(O2)=0.2mol•L-1,4min内平均反应速率v(H2)=_____ ,则CH3OH的转化率为______ 。
(3)已知断开1molH-H键吸收的能量为436kJ,形成1molH-N键放出的能量为391kJ,根据化学方程式N2+3H2=2NH3,反应完1molN2放出的能量为92.4kJ,则断开1molN≡N键需吸收的能量是_____ kJ。
Ⅱ.将等物质的量的A和B混合于2L的密闭容器中,发生如下反应:3A(g)+B(g) xC(g)+2D(g),5min后测得c(D)=0.5mol•L-1,c(A)∶c(B)=1∶2,C的反应速率是0.15mol•L-1•min-1。
xC(g)+2D(g),5min后测得c(D)=0.5mol•L-1,c(A)∶c(B)=1∶2,C的反应速率是0.15mol•L-1•min-1。
(4)x=______ 。
(5)A在5min末的浓度是______ 。
(6)此时容器内的压强与开始时之比为______ 。
(1)已知CH3OH(g)+
 O2(g)
O2(g) CO2(g)+2H2(g)的能量变化如图所示,下列说法正确的是
CO2(g)+2H2(g)的能量变化如图所示,下列说法正确的是
a.CH3OH转变成H2的过程是一个吸收能量的过程
b.H2的生成速率与CH3OH的消耗速率之比为1∶2
c.化学变化不仅有新物质生成,同时也一定有能量变化
d.1molH-O键断裂的同时2molC=O键断裂,则反应达最大限度
(2)某温度下,将5molCH3OH和2molO2充入2L的密闭容器中,经过4min反应达到平衡,测得c(O2)=0.2mol•L-1,4min内平均反应速率v(H2)=
(3)已知断开1molH-H键吸收的能量为436kJ,形成1molH-N键放出的能量为391kJ,根据化学方程式N2+3H2=2NH3,反应完1molN2放出的能量为92.4kJ,则断开1molN≡N键需吸收的能量是
Ⅱ.将等物质的量的A和B混合于2L的密闭容器中,发生如下反应:3A(g)+B(g)
 xC(g)+2D(g),5min后测得c(D)=0.5mol•L-1,c(A)∶c(B)=1∶2,C的反应速率是0.15mol•L-1•min-1。
xC(g)+2D(g),5min后测得c(D)=0.5mol•L-1,c(A)∶c(B)=1∶2,C的反应速率是0.15mol•L-1•min-1。(4)x=
(5)A在5min末的浓度是
(6)此时容器内的压强与开始时之比为
您最近一年使用:0次
解答题-原理综合题
|
较易
(0.85)
名校
解题方法
【推荐3】化学反应伴随能量变化,获取反应能量变化有多条途径
(1)下列反应中,属于吸热反应的是___________(填字母)。
(2)获取能量变化的途径
①通过化学键的键能计算。
已知:
计算可得: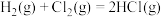

___________ 
②通过盖斯定律可计算。已知在25℃、101kPa时:
Ⅰ.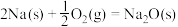
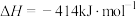
Ⅱ.
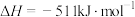
写出 与
与 反应生成
反应生成 的热化学方程式:
的热化学方程式:___________ 。
(3)以 、
、 为原料生产尿素[
为原料生产尿素[ ]的反应历程与能量变化示意图如图。
]的反应历程与能量变化示意图如图。

①第二步反应的
___________ 0(填“>”、“<”或“=”)
②从图像分析决定生产尿素的总反应的反应速率的步骤是第___________ 步反应。
(4)火箭和导弹表面的薄层是耐高温物质,将石墨、铝粉和二氧化钛按一定比例混合在高温下煅烧,所得物质可作耐高温材料,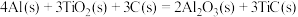
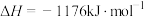 ,则反应过程中,每转移
,则反应过程中,每转移 电子放出的热量为
电子放出的热量为___________ kJ。
(1)下列反应中,属于吸热反应的是___________(填字母)。
A. 与水反应 与水反应 | B.甲烷的燃烧反应 |
C. 与氯化铵反应 与氯化铵反应 | D.锌与盐酸反应 |
①通过化学键的键能计算。
已知:
| 化学键种类 |  |  |  |
键能( ) ) | 436 | 247 | 434 |
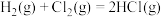


②通过盖斯定律可计算。已知在25℃、101kPa时:
Ⅰ.
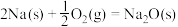
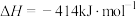
Ⅱ.

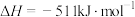
写出
 与
与 反应生成
反应生成 的热化学方程式:
的热化学方程式:(3)以
 、
、 为原料生产尿素[
为原料生产尿素[ ]的反应历程与能量变化示意图如图。
]的反应历程与能量变化示意图如图。
①第二步反应的

②从图像分析决定生产尿素的总反应的反应速率的步骤是第
(4)火箭和导弹表面的薄层是耐高温物质,将石墨、铝粉和二氧化钛按一定比例混合在高温下煅烧,所得物质可作耐高温材料,
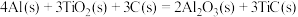
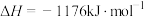 ,则反应过程中,每转移
,则反应过程中,每转移 电子放出的热量为
电子放出的热量为
您最近一年使用:0次
解答题-原理综合题
|
较易
(0.85)
解题方法
【推荐1】合成氨工业对国民经济和社会发展有重要的意义。
(1)合成氨工业中常以天然气与水蒸气为原料制取H2:CH4(g) + H2O(g)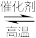 CO(g) + 3H2(g),反应中有关物质的化学键键能数据如下表所示,
CO(g) + 3H2(g),反应中有关物质的化学键键能数据如下表所示,
则CH4(g) + H2O(g) CO(g) + 3H2(g) △H=
CO(g) + 3H2(g) △H=________ kJ·mol−1。
(2)某科技小组在实验室中模拟合成氨反应,在430℃、20KPa时,将一定量的N2、 H2置于2L的恒容密闭容器中发生反应,N2(g) + 3H2(g) 2NH3(g) △H= −92.4kJ·mol−1,反应过程中各组分的物质的量变化如下图所示:
2NH3(g) △H= −92.4kJ·mol−1,反应过程中各组分的物质的量变化如下图所示:
①前10min内的H2的平均反应速率为_______ mol/(L·min)
②反应进行到10min 时,曲线发生变化的原因可能是____
A.加入N2 B.减小容器容积
C.加入催化剂 D.降低温度
③反应进行到25min时,曲线发生变化的原因是__________ ,再次达平衡时,平衡常数______ (填“增大”“减小”或“不变”)。
(3)工业上还利用天然和水蒸气反应的产物合成甲醇:CO(g) + 2H2(g) CH3OH(g) △H<0,在一定条件下CO的平衡转化率与温度、压强的关系如图所示:
CH3OH(g) △H<0,在一定条件下CO的平衡转化率与温度、压强的关系如图所示:

①p1_____ p2 (填“>”、“<“或“=”,下同)
②比较该反应在A、B两点的平衡常数大小:K(A)_______ K(B)。
(1)合成氨工业中常以天然气与水蒸气为原料制取H2:CH4(g) + H2O(g)
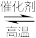 CO(g) + 3H2(g),反应中有关物质的化学键键能数据如下表所示,
CO(g) + 3H2(g),反应中有关物质的化学键键能数据如下表所示,| 化学键 | C−H | H−H |  (CO) (CO) | H−O |
| 键能(kJ·mol−1) | 413 | 436 | 1075 | 465 |
 CO(g) + 3H2(g) △H=
CO(g) + 3H2(g) △H=(2)某科技小组在实验室中模拟合成氨反应,在430℃、20KPa时,将一定量的N2、 H2置于2L的恒容密闭容器中发生反应,N2(g) + 3H2(g)
 2NH3(g) △H= −92.4kJ·mol−1,反应过程中各组分的物质的量变化如下图所示:
2NH3(g) △H= −92.4kJ·mol−1,反应过程中各组分的物质的量变化如下图所示:
①前10min内的H2的平均反应速率为
②反应进行到10min 时,曲线发生变化的原因可能是
A.加入N2 B.减小容器容积
C.加入催化剂 D.降低温度
③反应进行到25min时,曲线发生变化的原因是
(3)工业上还利用天然和水蒸气反应的产物合成甲醇:CO(g) + 2H2(g)
 CH3OH(g) △H<0,在一定条件下CO的平衡转化率与温度、压强的关系如图所示:
CH3OH(g) △H<0,在一定条件下CO的平衡转化率与温度、压强的关系如图所示:
①p1
②比较该反应在A、B两点的平衡常数大小:K(A)
您最近一年使用:0次
解答题-原理综合题
|
较易
(0.85)
解题方法
【推荐2】氨是一种重要的化工原料,合成氨工艺在不断的探索和优化,已知:
(1)工业合成氨的热化学方程式是___________ 。
(2)在合成氨过程中,需要不断分离出氨的原因为___________ 。
a.有利于平衡正向移动 b.防止催化剂中毒 c.改变反应的活化能
德国化学家埃特尔对工业合成氨的机理进行了实证研究获得2007年诺贝尔化学奖。在某一温度时,各步反应能量变化如下图所示(*代表吸附中心):

(3)反应历程中决速步骤反应的化学方程式是___________ 。
(4)合成氨工艺全球年均消耗能源3.5亿吨,占能源供应总量的1%以上;排放 超过4亿吨,占排放总量的约1.6%。请从分子结构角度解释工业合成氨的条件苛刻、耗能巨大的原因
超过4亿吨,占排放总量的约1.6%。请从分子结构角度解释工业合成氨的条件苛刻、耗能巨大的原因___________ 。
(5)针对合成氨工业中高耗能问题,中国科学家研制了一种新型催化剂,将合成氨温度、压强降低到350℃、1MPa,从反应机理角度分析新型催化剂降低能耗的原因是___________ 。
(6)针对合成氨中 大量排放问题,某研究团队提出利用金属锂元素合成氨,流程如下图所示。
大量排放问题,某研究团队提出利用金属锂元素合成氨,流程如下图所示。

①冶炼金属锂的化学方程式是___________ 。
②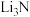 合成氨过程中发生非氧化还原反应,此步反应的化学方程式是
合成氨过程中发生非氧化还原反应,此步反应的化学方程式是___________ 。此方案中可循环利用的物质是___________ 。
| 化学键 | N≡N | H-H | N-H |
键能/ | 946 | 436 | 391 |
(1)工业合成氨的热化学方程式是
(2)在合成氨过程中,需要不断分离出氨的原因为
a.有利于平衡正向移动 b.防止催化剂中毒 c.改变反应的活化能
德国化学家埃特尔对工业合成氨的机理进行了实证研究获得2007年诺贝尔化学奖。在某一温度时,各步反应能量变化如下图所示(*代表吸附中心):

(3)反应历程中决速步骤反应的化学方程式是
(4)合成氨工艺全球年均消耗能源3.5亿吨,占能源供应总量的1%以上;排放
 超过4亿吨,占排放总量的约1.6%。请从分子结构角度解释工业合成氨的条件苛刻、耗能巨大的原因
超过4亿吨,占排放总量的约1.6%。请从分子结构角度解释工业合成氨的条件苛刻、耗能巨大的原因(5)针对合成氨工业中高耗能问题,中国科学家研制了一种新型催化剂,将合成氨温度、压强降低到350℃、1MPa,从反应机理角度分析新型催化剂降低能耗的原因是
(6)针对合成氨中
 大量排放问题,某研究团队提出利用金属锂元素合成氨,流程如下图所示。
大量排放问题,某研究团队提出利用金属锂元素合成氨,流程如下图所示。
①冶炼金属锂的化学方程式是
②
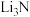 合成氨过程中发生非氧化还原反应,此步反应的化学方程式是
合成氨过程中发生非氧化还原反应,此步反应的化学方程式是
您最近一年使用:0次
解答题-原理综合题
|
较易
(0.85)
解题方法
【推荐3】Ⅰ.今有两个氢气燃烧生成水的热化学方程式:
H2(g)+1/2O2(g)=H2O(g) ΔH=a kJ/mol
2H2(g)+O2(g)=2H2O(l) ΔH=b kJ/mol
请回答下列问题:
(1)反应热的关系:2a__________ (填“>”、“<”或“=”)b。
(2)若已知H2(g)+1/2O2(g)=H2O(g) ΔH=-242 kJ/mol,且氧气中1 mol氧氧键完全断裂时吸收热量496 kJ,水蒸气中1 mol H-O键形成时放出热量463 kJ,则氢气中1 mol H-H键断裂时吸收的热量为_________ 。
Ⅱ.氢氧燃料电池是一种新型的化学电源,其构造如图一所示:a、b两个电极均由多孔碳制成,通入的气体由孔隙中逸出,并在电极表面放电。

(1)a电极反应式是______________ ;
(2)该燃料电池生成了360 kg的水,则电路中通过了______ mol的电子。
(3)用如图二所示电解方法精炼粗铜,电解液a选用CuSO4溶液,则:
①X电极反应式是____________ 。
②Y电极的材料是______________ 。
H2(g)+1/2O2(g)=H2O(g) ΔH=a kJ/mol
2H2(g)+O2(g)=2H2O(l) ΔH=b kJ/mol
请回答下列问题:
(1)反应热的关系:2a
(2)若已知H2(g)+1/2O2(g)=H2O(g) ΔH=-242 kJ/mol,且氧气中1 mol氧氧键完全断裂时吸收热量496 kJ,水蒸气中1 mol H-O键形成时放出热量463 kJ,则氢气中1 mol H-H键断裂时吸收的热量为
Ⅱ.氢氧燃料电池是一种新型的化学电源,其构造如图一所示:a、b两个电极均由多孔碳制成,通入的气体由孔隙中逸出,并在电极表面放电。

(1)a电极反应式是
(2)该燃料电池生成了360 kg的水,则电路中通过了
(3)用如图二所示电解方法精炼粗铜,电解液a选用CuSO4溶液,则:
①X电极反应式是
②Y电极的材料是
您最近一年使用:0次
解答题-实验探究题
|
较易
(0.85)
【推荐1】某小组研究化学反应中的能量变化,进行了如下实验。
(1)实验 I:将Zn片和Cu片分别插入盛有50mL 2 mol/L稀硫酸的烧杯中。
①Zn片与稀硫酸反应的离子方程式为_________ 。
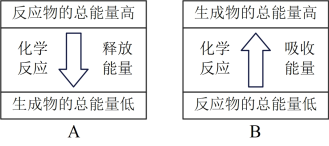
②Zn片与稀硫酸反应的能量变化关系符合如图_________ (填“A”或“B”)。
②结合电子的移动方向,解释Cu片表面产生气泡的原因_________ 。
(3)实验I和Ⅱ产生等量气体时,测得T2>T3。结合能量的转化形式,分析两溶液温度变化幅度不同 的原因 _________ 。
(4)根据实验Ⅱ,判断下列说法不正确 的是_________ 。
①在锌电极上也可观察到气泡产生
②电子可由锌电极经溶液流向铜电极
③溶液中的SO 向铜电极移动
向铜电极移动
(5)将Zn片和Cu片换成Fe片和石墨棒,重复实验Ⅱ,判断电流表指针是否发生偏转。若不偏转,说明理由;若偏转,写出Fe片表面发生的电极反应式。理由或电极反应式是_________ 。
(1)实验 I:将Zn片和Cu片分别插入盛有50mL 2 mol/L稀硫酸的烧杯中。
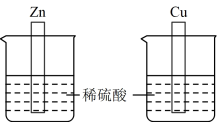
①Zn片与稀硫酸反应的离子方程式为
②Zn片与稀硫酸反应的能量变化关系符合如图

②结合电子的移动方向,解释Cu片表面产生气泡的原因
(3)实验I和Ⅱ产生等量气体时,测得T2>T3。结合能量的转化形式,分析两溶液温度变化幅度
(4)根据实验Ⅱ,判断下列说法
①在锌电极上也可观察到气泡产生
②电子可由锌电极经溶液流向铜电极
③溶液中的SO
 向铜电极移动
向铜电极移动(5)将Zn片和Cu片换成Fe片和石墨棒,重复实验Ⅱ,判断电流表指针是否发生偏转。若不偏转,说明理由;若偏转,写出Fe片表面发生的电极反应式。理由或电极反应式是
您最近一年使用:0次
解答题-原理综合题
|
较易
(0.85)
解题方法
【推荐2】(1)氢气可由天然气和水反应制备,其主要反应为CH4(g)+2H2O(g)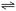 CO2(g)+4H2(g),反应过程中能量变化如图所示:
CO2(g)+4H2(g),反应过程中能量变化如图所示:
(1)若已知某些化学键的键能用字母表示如表:(计算用含a、b、c、d字母表示)。根据该反应制取1molH2要吸收或放出热量为__________
(2)在恒温恒容条件下反应,能说明该反应已达到平衡状态的是______________ 。
a.2v正(CO2)=v逆(H2O)
b.容器内密度不再发生变化
c.平均相对分子质量不再发生变化
d.当4molC-H键断裂时,同时又2molC=O键断裂
(3)某温度时,在一个2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示。根据图中数据,试填写下列空白:
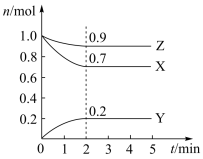
①该反应的化学方程式为__________
②反应开始至2min,气体Y的平均反应速率为__________
(4)利用2H2+O2=2H2O的燃烧反应,可以构成一个以KOH溶液作电解质溶液的燃料电池,该燃料电池的正极反应式为__________ 。
 CO2(g)+4H2(g),反应过程中能量变化如图所示:
CO2(g)+4H2(g),反应过程中能量变化如图所示:
(1)若已知某些化学键的键能用字母表示如表:(计算用含a、b、c、d字母表示)。根据该反应制取1molH2要吸收或放出热量为
| 化学键 | C-H | O-H | C=O | H-H |
| 键能(kJ/mol) | a | b | c | d |
(2)在恒温恒容条件下反应,能说明该反应已达到平衡状态的是
a.2v正(CO2)=v逆(H2O)
b.容器内密度不再发生变化
c.平均相对分子质量不再发生变化
d.当4molC-H键断裂时,同时又2molC=O键断裂
(3)某温度时,在一个2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示。根据图中数据,试填写下列空白:

①该反应的化学方程式为
②反应开始至2min,气体Y的平均反应速率为
(4)利用2H2+O2=2H2O的燃烧反应,可以构成一个以KOH溶液作电解质溶液的燃料电池,该燃料电池的正极反应式为
您最近一年使用:0次
解答题-原理综合题
|
较易
(0.85)
【推荐3】研究化学能与热能、电能的转化具有重要价值。回答下列问题:
(1)下列化学反应过程中的能量变化符合图示的是_______ (填序号)。

①酸碱中和反应 ②碳酸钙分解 ③金属钠与水反应 ④酒精燃烧 ⑤灼热的碳与二氧化碳反应 ⑥ 与
与 反应
反应
(2) 的反应过程如图所示:
的反应过程如图所示:

若1mol (g)和1mol
(g)和1mol  (g)充分反应,则反应物中旧键断裂共吸收
(g)充分反应,则反应物中旧键断裂共吸收_______ kJ能量,生成物中新键形成共放出_______ kJ能量,该反应为_______ (填“吸热”或“放热”)反应。
(3)依据NaOH与HCl的反应原理设计原电池,你认为是否合理?_______ (填“是”或“否”),理由是_______ 。
(4)利用反应 设计一个原电池(正极材料用碳棒),回答下列问题:
设计一个原电池(正极材料用碳棒),回答下列问题:
①电池的负极材料是_______ ,电解质溶液是_______ 。
②正极上出现的现象是_______ 。
③若导线上转移1mol电子,则生成铜的质量为_______ g。
(1)下列化学反应过程中的能量变化符合图示的是

①酸碱中和反应 ②碳酸钙分解 ③金属钠与水反应 ④酒精燃烧 ⑤灼热的碳与二氧化碳反应 ⑥
 与
与 反应
反应(2)
 的反应过程如图所示:
的反应过程如图所示:
若1mol
 (g)和1mol
(g)和1mol  (g)充分反应,则反应物中旧键断裂共吸收
(g)充分反应,则反应物中旧键断裂共吸收(3)依据NaOH与HCl的反应原理设计原电池,你认为是否合理?
(4)利用反应
 设计一个原电池(正极材料用碳棒),回答下列问题:
设计一个原电池(正极材料用碳棒),回答下列问题:①电池的负极材料是
②正极上出现的现象是
③若导线上转移1mol电子,则生成铜的质量为
您最近一年使用:0次
解答题-实验探究题
|
较易
(0.85)
【推荐1】酸性锌锰干电池是一种一次电池,其结构如图所示。该电池在放电过程产生MnOOH和Zn(NH3)2Cl2。回答下列问题:

(1)电池反应的化学方程式为____ 。
(2)如图为电解500mL1mol/LCuSO4溶液的装置,该装置的电源为上述酸性锌锰干电池。当电池负极消耗16.25gZn时,电解后溶液的pH=____ (忽略电解前后溶液体积变化)。将电解后的溶液恢复至原溶液时,应加入的试剂是____ ,其质量为____ 。

(3)用该废电池的锌皮(含少量杂质铁)可制备化工原料ZnSO4•7H2O。其流程如图:

已知部分物质的Ksp如表:
①氧化时的离子方程式____ 。
②试剂X最好选用____ (填化学式),调pH的范围是____ (假定Zn2+浓度为0.1mol/L,离子浓度小于1×10-5mol/L时,即可认为该离子沉淀完全)。
③若上述流程中不加H2O2氧化的后果是____ ,原因是____ 。

(1)电池反应的化学方程式为
(2)如图为电解500mL1mol/LCuSO4溶液的装置,该装置的电源为上述酸性锌锰干电池。当电池负极消耗16.25gZn时,电解后溶液的pH=

(3)用该废电池的锌皮(含少量杂质铁)可制备化工原料ZnSO4•7H2O。其流程如图:

已知部分物质的Ksp如表:
| 化合物 | Zn(OH)2 | Fe(OH)2 | Fe(OH)3 |
| Ksp近似值 | 10-17 | 10-17 | 10-39 |
②试剂X最好选用
③若上述流程中不加H2O2氧化的后果是
您最近一年使用:0次
解答题-原理综合题
|
较易
(0.85)
名校
【推荐2】原电池原理的发现是储能和供能技术的巨大进步,是化学对人类的一项重大贡献。将纯锌片和纯铜片按图方式插入100 mL相同浓度的稀硫酸中一段时间,回答下列问题:

(1)下列说法正确的是____________ 。
A.甲、乙均为化学能转变为电能的装置 B.乙中铜片上没有明显变化
C.甲中铜片质量减少、乙中锌片质量减少 D.甲乙两烧杯中溶液的 pH 均增大
(2)同条件下两烧杯中产生同体积的气体,需要的时间甲________ 乙(填“>”“<”或“=”)。
(3)请写出甲乙图中构成原电池的负极电极反应式:__________________ 。
(4)当甲中溶液质量增重15.75g时,电极上转移电子数目为______________ 。
(5)如图为甲烷氧气燃料电池的构造示意图,电解质溶液的溶质是KOH。写出正极的电极反应方程式为_________ 。


(1)下列说法正确的是
A.甲、乙均为化学能转变为电能的装置 B.乙中铜片上没有明显变化
C.甲中铜片质量减少、乙中锌片质量减少 D.甲乙两烧杯中溶液的 pH 均增大
(2)同条件下两烧杯中产生同体积的气体,需要的时间甲
(3)请写出甲乙图中构成原电池的负极电极反应式:
(4)当甲中溶液质量增重15.75g时,电极上转移电子数目为
(5)如图为甲烷氧气燃料电池的构造示意图,电解质溶液的溶质是KOH。写出正极的电极反应方程式为

您最近一年使用:0次
解答题-原理综合题
|
较易
(0.85)
解题方法
【推荐3】能源是当今社会发展的三大支柱之一.根据题中提供的信息,请回答下列问题:
I.天然气和甲醇都是一种高效、低耗、污染小的清洁能源。在一定条件下,通过太阳光的作用,形成如图所示的物质循环。

(1)写出甲烷完全燃烧的化学方程式________
(2)如图的物质循环中太阳能最终转化为_________ 能。
II.新冠疫情防控期间,测温枪发挥了极大的作用。有一种便携式测温枪,里面使用了锌银纽扣式电池,其电极材料分别为Zn和Ag2O,电解质为KOH溶液。工作时电池总反应为:Zn+ Ag2O+H2O=2Ag+ Zn(OH)2
(3)正极的电极反应式为___________
(4)外电路每通过0.4 mole-,负极质量增重了______ g
I.天然气和甲醇都是一种高效、低耗、污染小的清洁能源。在一定条件下,通过太阳光的作用,形成如图所示的物质循环。

(1)写出甲烷完全燃烧的化学方程式
(2)如图的物质循环中太阳能最终转化为
II.新冠疫情防控期间,测温枪发挥了极大的作用。有一种便携式测温枪,里面使用了锌银纽扣式电池,其电极材料分别为Zn和Ag2O,电解质为KOH溶液。工作时电池总反应为:Zn+ Ag2O+H2O=2Ag+ Zn(OH)2
(3)正极的电极反应式为
(4)外电路每通过0.4 mole-,负极质量增重了
您最近一年使用:0次



