醋酸铟是一种化工产品,以ITO靶材废料(主要由 、
、 组成)为原料制备醋酸铟的流程如下:
组成)为原料制备醋酸铟的流程如下:
(1)已知 和
和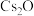 可反应生成偏铟酸铯(CsInO2),也可以与
可反应生成偏铟酸铯(CsInO2),也可以与 反应生成
反应生成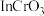 ,据此判断
,据此判断 属于
属于___________ (填“酸性氧化物”“碱性氧化物”或“两性氧化物”)。写出 与
与 反应的离子方程式:
反应的离子方程式:___________ 。
(2)酸浸时,铟的浸出率在不同温度和硫酸浓度下的数值如下表,锡的浸出率小于20%。
由上表信息可得出规律:其他条件不变时,铟的浸出率随温度升高而___________ (填“增大”“减小”或“不变”,下同),温度越高,硫酸浓度对铟的浸出率影响___________ 。
(3)酸溶时无气泡产生,则酸溶时发生反应的化学方程式为___________ 。
(4)现有一份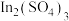 和
和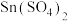 的混合溶液,向其中逐渐加入锌粉,测得析出固体的质量随加入锌粉的物质的量的关系如图所示。图中ab段反应的离子方程式为
的混合溶液,向其中逐渐加入锌粉,测得析出固体的质量随加入锌粉的物质的量的关系如图所示。图中ab段反应的离子方程式为___________ ,该混合溶液中,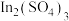 和
和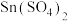 的物质的量浓度之比为
的物质的量浓度之比为___________ 。
 、
、 组成)为原料制备醋酸铟的流程如下:
组成)为原料制备醋酸铟的流程如下: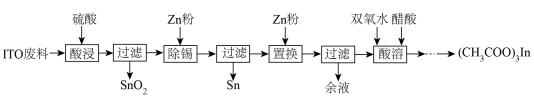
(1)已知
 和
和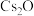 可反应生成偏铟酸铯(CsInO2),也可以与
可反应生成偏铟酸铯(CsInO2),也可以与 反应生成
反应生成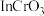 ,据此判断
,据此判断 属于
属于 与
与 反应的离子方程式:
反应的离子方程式:(2)酸浸时,铟的浸出率在不同温度和硫酸浓度下的数值如下表,锡的浸出率小于20%。
| 温度 | 30℃ | 50℃ | 70℃ | 90℃ |
 的 的 溶液 溶液 | 56% | 72% | 83% | 91% |
 的 的 溶液 溶液 | 68% | 81% | 89% | 94% |
(3)酸溶时无气泡产生,则酸溶时发生反应的化学方程式为
(4)现有一份
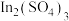 和
和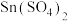 的混合溶液,向其中逐渐加入锌粉,测得析出固体的质量随加入锌粉的物质的量的关系如图所示。图中ab段反应的离子方程式为
的混合溶液,向其中逐渐加入锌粉,测得析出固体的质量随加入锌粉的物质的量的关系如图所示。图中ab段反应的离子方程式为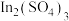 和
和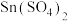 的物质的量浓度之比为
的物质的量浓度之比为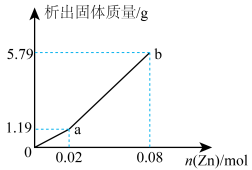
更新时间:2023-11-30 22:22:17
|
相似题推荐
解答题-实验探究题
|
适中
(0.65)
名校
【推荐1】人体血液里Ca2+的浓度一般采用mg•cm-3来表示。抽取一定体积的血样,将其中的Ca2+转化为草酸钙(CaC2O4)沉淀,将此草酸钙沉淀洗涤后溶于强酸(如盐酸)可得草酸(H2C2O4),再用KMnO4溶液滴定即可测定血液样品中Ca2+的浓度。某研究性学习小组设计如图实验步骤测定血液样品中Ca2+的浓度。
步骤1:配制KMnO4标准溶液。如图是配制100mLKMnO4标准溶液的过程。
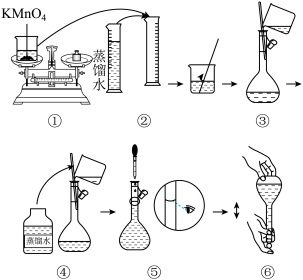
(1)需用的仪器有天平、药匙、烧杯、玻璃棒、量筒、胶头滴管、____ 。请你观察图示判断,其中不正确的操作有____ (填序号)。
(2)如果用图示的操作所配制的溶液进行实验,在其他操作正确的情况下,所配制的溶液浓度将____ (填“偏大”或“偏小”)。
步骤2:测定血液样品中Ca2+的浓度。抽取血样20.00mL,经过上述处理后得到草酸,再用0.020mol•L-1KMnO4溶液滴定,使草酸转化成CO2逸出,这时共消耗12.00mLKMnO4溶液。
(3)已知:CaC2O4+2HCl=CaCl2+H2C2O4
2KMnO4+5H2C2O4+6HCl==2MnCl2+2KCl+10CO2↑+8H2O。
经过计算,血液样品中Ca2+的浓度为多少mg•cm-3(写出计算过程)____ 。
步骤1:配制KMnO4标准溶液。如图是配制100mLKMnO4标准溶液的过程。

(1)需用的仪器有天平、药匙、烧杯、玻璃棒、量筒、胶头滴管、
(2)如果用图示的操作所配制的溶液进行实验,在其他操作正确的情况下,所配制的溶液浓度将
步骤2:测定血液样品中Ca2+的浓度。抽取血样20.00mL,经过上述处理后得到草酸,再用0.020mol•L-1KMnO4溶液滴定,使草酸转化成CO2逸出,这时共消耗12.00mLKMnO4溶液。
(3)已知:CaC2O4+2HCl=CaCl2+H2C2O4
2KMnO4+5H2C2O4+6HCl==2MnCl2+2KCl+10CO2↑+8H2O。
经过计算,血液样品中Ca2+的浓度为多少mg•cm-3(写出计算过程)
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐2】镍行业发展蕴藏着巨大的潜力。某小组用废镍催化剂(成分为Al2O3、Ni、Fe、SiO2、CaO等)制备草酸镍晶体(NiC2O4·2H2O)的部分实验流程如下:
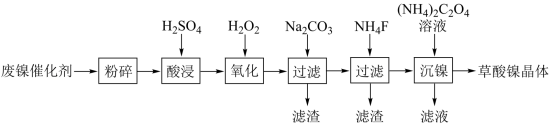
(1)“粉碎”的目的是______________________________________________ .
(2)实验过程中多次进行过滤。过滤操作中,除需用到玻璃棒、烧杯外,还需用到的玻璃仪器有_______ .
(3)保持其他条件相同。在不同温度下对废镍催化剂进行”酸浸”。镍浸出率随时间变化如图。以下四个选项中最适宜的条件是____________ (填字母)。
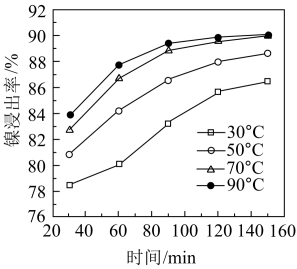
a.30℃、30min b.90℃、150min
c.70℃、120min d.90℃、120min
(4)证明“沉镍”工序中Ni2+已经沉淀完全的实验步骤及现象是______________________________ .
(5)草酸镍晶体(NiC2O4·2H2O)在热空气中干燥;脱水后,再隔绝空气高温煅烧3小时,制得三氧化二镍,同时获得一种混合气体。写出草酸镍(NiC2O4。)高温分解的化学方程式________________ .
(6)工业上还可用电解法制取三氧化二镍。电解过程中产生的CIO-把二价镍氧化为三价镍。
写出C1O-氧化Ni(OH)2生成三氧化二镍的离子方程式__________________________________ .
(7)用1000g废镍催化剂(镍含量为a%),理论上可制备草酸镍晶体的质量为________ g(只列式不计算。已知:NiC2O4·2H2O的相对分子质量为183)。

(1)“粉碎”的目的是
(2)实验过程中多次进行过滤。过滤操作中,除需用到玻璃棒、烧杯外,还需用到的玻璃仪器有
(3)保持其他条件相同。在不同温度下对废镍催化剂进行”酸浸”。镍浸出率随时间变化如图。以下四个选项中最适宜的条件是

a.30℃、30min b.90℃、150min
c.70℃、120min d.90℃、120min
(4)证明“沉镍”工序中Ni2+已经沉淀完全的实验步骤及现象是
(5)草酸镍晶体(NiC2O4·2H2O)在热空气中干燥;脱水后,再隔绝空气高温煅烧3小时,制得三氧化二镍,同时获得一种混合气体。写出草酸镍(NiC2O4。)高温分解的化学方程式
(6)工业上还可用电解法制取三氧化二镍。电解过程中产生的CIO-把二价镍氧化为三价镍。
写出C1O-氧化Ni(OH)2生成三氧化二镍的离子方程式
(7)用1000g废镍催化剂(镍含量为a%),理论上可制备草酸镍晶体的质量为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐3】数形结合思想是化学科的重要思维模式,请结合所学知识和图像作答:
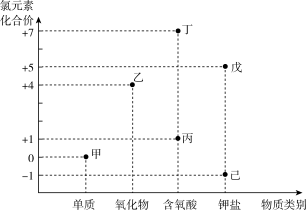
(1)如图为含氯元素物质的“价类二维图”,下列说法正确的是______ 。
(2)某实验小组向100mLFeI2液中通入Cl2,溶液中Fe3+、I2的物质的量随通入的Cl2的物质的量变化如图所示(不考虑与水的反应)。请回答下列问题:
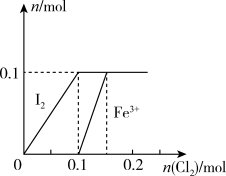
当通入Cl2的物质的量n(Cl2)=0.12mol时,溶液中: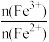 =
=______ ;通入足量氯气反应的化学方程式为______ 。
(3)烟气脱硫一体化技术是大气污染防治研究的热点,ClO2是性能优良的脱硫试剂,在强酸性条件下稳定。
①ClO 也是性能优良的脱硫试剂,ClO2与NaOH溶液反应生成NaClO3和NaClO2,写出该反应的离子方程式:
也是性能优良的脱硫试剂,ClO2与NaOH溶液反应生成NaClO3和NaClO2,写出该反应的离子方程式:______ 。
②某研究小组用ClO2进行脱除SO2实验时,测得SO2的脱除率随溶液pH变化如图。
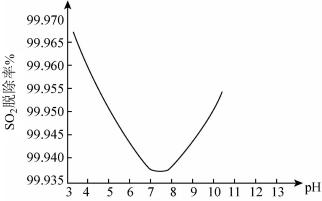
当3<pH<7时,随pH的增大,SO2脱除率逐渐降低,其原因是______ ;在pH约7.8之后,随pH的增大,SO2脱除率又开始升高,其原因是______ 。
(4)某同学参阅了“84消毒液”说明中的配方,欲用NaClO固体配制480mL含NaClO25%,密度为1.19g/cm3的消毒液。下列说法正确的是______ 。
A.容量瓶用蒸馏水洗净后必须烘干才能用于溶液的配制
B.所配得的NaClO消毒液在空气中光照,久置后溶液中NaClO的物质的量浓度减小
C.需要称量的NaClO固体的质量为140g
D.定容时俯视刻度线,会使配制溶液浓度偏高
E.上下颠倒摇匀后发现溶液凹液面低于刻度线,应再加水至刻度线
(1)如图为含氯元素物质的“价类二维图”,下列说法正确的是

| A.乙、丁均属于电解质 |
| B.丙的酸性强于碳酸 |
| C.乙是一种广谱型的消毒剂,可取代甲成为自来水的消毒剂 |
| D.戊→己必须加还原剂才能实现 |

当通入Cl2的物质的量n(Cl2)=0.12mol时,溶液中:
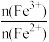 =
=(3)烟气脱硫一体化技术是大气污染防治研究的热点,ClO2是性能优良的脱硫试剂,在强酸性条件下稳定。
①ClO
 也是性能优良的脱硫试剂,ClO2与NaOH溶液反应生成NaClO3和NaClO2,写出该反应的离子方程式:
也是性能优良的脱硫试剂,ClO2与NaOH溶液反应生成NaClO3和NaClO2,写出该反应的离子方程式:②某研究小组用ClO2进行脱除SO2实验时,测得SO2的脱除率随溶液pH变化如图。

当3<pH<7时,随pH的增大,SO2脱除率逐渐降低,其原因是
(4)某同学参阅了“84消毒液”说明中的配方,欲用NaClO固体配制480mL含NaClO25%,密度为1.19g/cm3的消毒液。下列说法正确的是
A.容量瓶用蒸馏水洗净后必须烘干才能用于溶液的配制
B.所配得的NaClO消毒液在空气中光照,久置后溶液中NaClO的物质的量浓度减小
C.需要称量的NaClO固体的质量为140g
D.定容时俯视刻度线,会使配制溶液浓度偏高
E.上下颠倒摇匀后发现溶液凹液面低于刻度线,应再加水至刻度线
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
【推荐1】某无色透明溶液可能含有Na+、Fe3+、Ca2+、SO 、CO
、CO 、Cl-、NO
、Cl-、NO 中几种,现进行如下实验:
中几种,现进行如下实验:
①滴加BaCl2溶液,有白色沉淀产生,将沉淀滤出。
②向上述沉淀中加入足量的稀盐酸,有部分沉淀溶解。
③向滤液加入AgNO3溶液,有白色沉淀生成,该沉淀不溶于稀HNO3。
试判断:
(1)该溶液中肯定没有_______ ,可能有_______ ,肯定有_______ (填离子符号)。
(2)写出步骤②的离子方程式_______ 。
 、CO
、CO 、Cl-、NO
、Cl-、NO 中几种,现进行如下实验:
中几种,现进行如下实验:①滴加BaCl2溶液,有白色沉淀产生,将沉淀滤出。
②向上述沉淀中加入足量的稀盐酸,有部分沉淀溶解。
③向滤液加入AgNO3溶液,有白色沉淀生成,该沉淀不溶于稀HNO3。
试判断:
(1)该溶液中肯定没有
(2)写出步骤②的离子方程式
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐2】无色碘化钾溶液露置在空气中容易变为黄色,某兴趣小组进行如下实验探究。
实验试剂: KI溶液、
KI溶液、
 溶液、蒸馏水、指示剂。
溶液、蒸馏水、指示剂。
实验仪器:试管、试剂瓶、胶头滴管、温度计。
Ⅰ、针对冬夏季节不同,KI溶液变色快慢不同,小组成员进行以下实验。
回答下列问题。
(1)该实验的目的是探究_____ 对反应速率的影响。
(2)该实验除题中所给仪器外,还需要补充的仪器是_____ 。
(3)分析上述实验记录结果,可得出的结论是:温度每升高_____ ℃,反应速率增大为原来的4倍。
Ⅱ、为探究溶液的酸性强弱对KI溶液变色速率的影响,小组成员进行以下实验。
第①步:分别取1mL KI溶液于两支试管中,并分别滴加两滴指示剂;
KI溶液于两支试管中,并分别滴加两滴指示剂;
第②步:向其中一支试管中加入_____,然后向另一支试管中加入1mL蒸馏水和1mL
 溶液,并同时记录KI溶液变色的时间。
溶液,并同时记录KI溶液变色的时间。
实验结论:其它条件相同时,溶液酸性越强,KI溶液变色越快。
回答下列问题。
(4)第①步实验中,滴加的指示剂为_____ (填入具体的试剂)。
(5)将第②步实验内容补充完整:向其中一支试管中加入_____ 。
(6)该实验操作中必须控制不变的是_____ 。
a、温度
b、试剂的用量(体积)
c、试剂添加的顺序
(7)该探究实验中KI溶液变色反应的离子方程式为_____ 。
实验试剂:
 KI溶液、
KI溶液、
 溶液、蒸馏水、指示剂。
溶液、蒸馏水、指示剂。实验仪器:试管、试剂瓶、胶头滴管、温度计。
Ⅰ、针对冬夏季节不同,KI溶液变色快慢不同,小组成员进行以下实验。
| 实验编号 | ① | ② | ③ | ④ | ⑤ |
| 温度/℃ | 30 | 40 | 50 | 60 | 70 |
| 显色时间/s | 160 | 80 | 40 | 20 | 10 |
(1)该实验的目的是探究
(2)该实验除题中所给仪器外,还需要补充的仪器是
(3)分析上述实验记录结果,可得出的结论是:温度每升高
Ⅱ、为探究溶液的酸性强弱对KI溶液变色速率的影响,小组成员进行以下实验。
第①步:分别取1mL
 KI溶液于两支试管中,并分别滴加两滴指示剂;
KI溶液于两支试管中,并分别滴加两滴指示剂;第②步:向其中一支试管中加入_____,然后向另一支试管中加入1mL蒸馏水和1mL

 溶液,并同时记录KI溶液变色的时间。
溶液,并同时记录KI溶液变色的时间。实验结论:其它条件相同时,溶液酸性越强,KI溶液变色越快。
回答下列问题。
(4)第①步实验中,滴加的指示剂为
(5)将第②步实验内容补充完整:向其中一支试管中加入
(6)该实验操作中必须控制不变的是
a、温度
b、试剂的用量(体积)
c、试剂添加的顺序
(7)该探究实验中KI溶液变色反应的离子方程式为
您最近一年使用:0次
【推荐3】氮化镓( )具有优异的光电性能。一种利用炼锌矿渣[含
)具有优异的光电性能。一种利用炼锌矿渣[含 、
、 、
、 、
、 ]制备
]制备 的流程如下:
的流程如下:
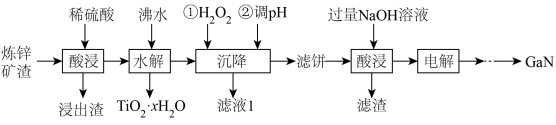
已知:①“酸浸”后的溶液中,含有金属元素的离子有 、
、 、
、 、
、 、
、 ;
;
② 与
与 化学性质相似;
化学性质相似;
③该工艺条件下,相关金属离子开始沉淀和沉淀完全( )的pH范围如下表:
)的pH范围如下表:
(1)为提高酸浸效率,可采取的措施有________ (至少写两条);“沉降”时加 发生的离子方程式为
发生的离子方程式为________ 。
(2)利用表格中的数据计算 的
的
_______ 。
(3)酸浸液中加入沸水可使 发生水解,水解的离子方程式为
发生水解,水解的离子方程式为_________ 。
(4)滤液1中可回收利用的物质是_______ (填化学式,下同);“碱浸”后溶液中所含溶质有 、
、________ 。
(5)“沉降”时,调pH的理论范围为________ ;当 恰好完全沉淀时,溶液中
恰好完全沉淀时,溶液中 的浓度为
的浓度为________  。
。
 )具有优异的光电性能。一种利用炼锌矿渣[含
)具有优异的光电性能。一种利用炼锌矿渣[含 、
、 、
、 、
、 ]制备
]制备 的流程如下:
的流程如下:
已知:①“酸浸”后的溶液中,含有金属元素的离子有
 、
、 、
、 、
、 、
、 ;
;②
 与
与 化学性质相似;
化学性质相似;③该工艺条件下,相关金属离子开始沉淀和沉淀完全(
 )的pH范围如下表:
)的pH范围如下表:| 离子 |  |  |  |  |
| 开始沉淀的pH | 3.0 | 7.6 | 1.7 | 5.5 |
| 沉淀完全的pH | 4.9 | 9.6 | 3.2 | 8.0 |
(1)为提高酸浸效率,可采取的措施有
 发生的离子方程式为
发生的离子方程式为(2)利用表格中的数据计算
 的
的
(3)酸浸液中加入沸水可使
 发生水解,水解的离子方程式为
发生水解,水解的离子方程式为(4)滤液1中可回收利用的物质是
 、
、(5)“沉降”时,调pH的理论范围为
 恰好完全沉淀时,溶液中
恰好完全沉淀时,溶液中 的浓度为
的浓度为 。
。
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
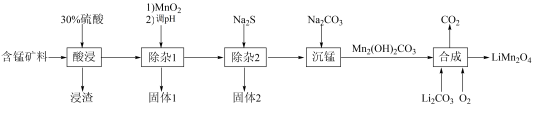
【推荐1】LiMn2O4、LiFePO4是锂离子电池常用的活性材料。某小组以含锰矿料(主要成分是MnCO3,含少量Fe2O3、Fe3O4、FeO、CoO和SiO2)为原料制备LiMn2O4的流程如图所示(部分条件和产物省略)。
已知几种金属氢氧化物沉淀的pH如表所示:
请回答下列问题:
(1)写出一条提高“酸浸”速率的措施:___________ 。
(2)“除杂1”时,加入MnO2的作用是___________ (用离子方程式表示)。
(3)要使“固体1”中除了含有MnO2外,只含另外一种固体,其化学式为___________ ,则“除杂1”过程调节pH范围为 ___________ 。
(4)在高温下“合成”LiMn2O4,反应的化学方程式为___________ 。
(5)已知:常温下,Ksp(CoS)=3.0 × 10−26、Ksp(MnS)=3.0 × 10−14。假设“除杂1”后的溶液中c( )为 0.1mol⋅L−1,为了使残液中 c(Co2 + )≤ 1.0 × 10−5 mol⋅L−1,必须控制 c(S2−) 的范围为
)为 0.1mol⋅L−1,为了使残液中 c(Co2 + )≤ 1.0 × 10−5 mol⋅L−1,必须控制 c(S2−) 的范围为_____ mol⋅L−1。
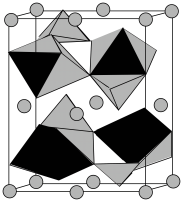
(6)固体1可作为LiFePO4的原料。LiFePO4晶胞结构如图所示,其中O围绕Fe和P分别形成正八面体和正四面体,它们通过共顶点、共棱形成空间链结构。LiFePO4晶胞中P的杂化轨道类型为__________ ,晶胞中含有正八面体的数目为__________ 。

已知几种金属氢氧化物沉淀的pH如表所示:
| 金属氢氧化物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Mn(OH)2 |
| 开始沉淀的pH | 2.7 | 7.5 | 7.6 | 7.8 |
| 完全沉淀的pH | 3.7 | 9.7 | 9.2 | 10.4 |
请回答下列问题:
(1)写出一条提高“酸浸”速率的措施:
(2)“除杂1”时,加入MnO2的作用是
(3)要使“固体1”中除了含有MnO2外,只含另外一种固体,其化学式为
(4)在高温下“合成”LiMn2O4,反应的化学方程式为
(5)已知:常温下,Ksp(CoS)=3.0 × 10−26、Ksp(MnS)=3.0 × 10−14。假设“除杂1”后的溶液中c(
 )为 0.1mol⋅L−1,为了使残液中 c(Co2 + )≤ 1.0 × 10−5 mol⋅L−1,必须控制 c(S2−) 的范围为
)为 0.1mol⋅L−1,为了使残液中 c(Co2 + )≤ 1.0 × 10−5 mol⋅L−1,必须控制 c(S2−) 的范围为(6)固体1可作为LiFePO4的原料。LiFePO4晶胞结构如图所示,其中O围绕Fe和P分别形成正八面体和正四面体,它们通过共顶点、共棱形成空间链结构。LiFePO4晶胞中P的杂化轨道类型为

您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐2】高铁酸钾(K2FeO4)是一种强氧化剂和环境友好型水处理剂,易分解,遇水和酸易变质。学习小组在实验室对高铁酸钾的制备和一些性质进行探究。
回答下列问题:
(1)高铁酸钾的制备。
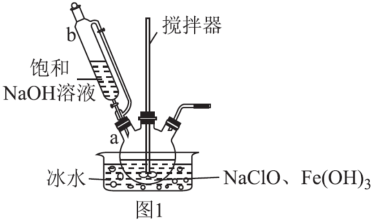
步骤一:制备Na2FeO4,装置如图1所示。将b中饱和NaOH溶液全部逐滴滴入a中,充分反应;
步骤二:由b向a中反应后液体中加入饱和KOH溶液;
步骤三:将a中所得浊液移出,分离提纯。
①仪器b的名称为___ ,其侧管的作用为___ 。
②步骤一中采用冰水浴冷却的目的为___ ;a中制备Na2FeO4反应的离子方程式为___ 。
③步骤二中,能得到K2FeO4悬浊液的原因为___ 。
④K2FeO4悬浊液经过滤、洗涤、提纯,可得产品。其中提纯所用的操作名称为___ 。
(2)K2FeO4遇水转化为Fe(OH)3,则其作水处理剂的优点为___ 。
(3)用图2所示装置检验K2FeO4受热分解的产物。
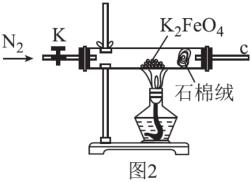
①检验分解的气体产物为O2的操作和现象为___ 。
②设计实验证明完全分解后的固体产物中不含Fe(Ⅱ)___ 。
回答下列问题:
(1)高铁酸钾的制备。
步骤一:制备Na2FeO4,装置如图1所示。将b中饱和NaOH溶液全部逐滴滴入a中,充分反应;

步骤二:由b向a中反应后液体中加入饱和KOH溶液;
步骤三:将a中所得浊液移出,分离提纯。
①仪器b的名称为
②步骤一中采用冰水浴冷却的目的为
③步骤二中,能得到K2FeO4悬浊液的原因为
④K2FeO4悬浊液经过滤、洗涤、提纯,可得产品。其中提纯所用的操作名称为
(2)K2FeO4遇水转化为Fe(OH)3,则其作水处理剂的优点为
(3)用图2所示装置检验K2FeO4受热分解的产物。

①检验分解的气体产物为O2的操作和现象为
②设计实验证明完全分解后的固体产物中不含Fe(Ⅱ)
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
【推荐3】某硫酸厂产生的烧渣(主要含Fe2O3、FeO,还有一定量的SiO2)可用于制备FeCO3,其流程如下:
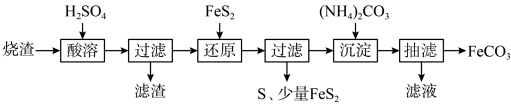
已知:“还原”时,FeS2与H2SO4不反应;Fe3+通过反应Ⅰ、Ⅱ被还原,其中反应Ⅰ为FeS2+14Fe3++8H2O=15Fe2++ 2SO +16H+。
+16H+。
(1)滤渣的成分为_____ ;“还原”后为检验Fe3+是否反应完全,可以用什么试剂_____ 。
(2)“还原”时反应Ⅱ的离子方程式_____ 。
(3)下列操作或描述不正确的是_____ 。
A “沉淀”时,可以先将溶液调节成强碱性,再加入(NH4)2CO3以使沉淀完全
B 抽滤时,应选择比布氏漏斗内径略小又能将全部小孔盖住的滤纸
C 抽滤不宜用于过滤胶状沉淀,因为其易在滤纸上形成一层密实的沉淀,溶液不易透过
D 制得的FeCO3还需洗涤、烘干
(4)如图安装抽滤装置,经过一系列操作完成抽滤。请选择合适的编号,按正确的操作顺序补充 完整:
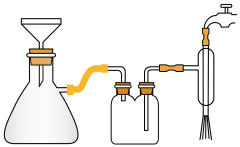
在布氏漏斗中加入滤纸→__ →__ →__ →__ →确认抽干。
①转移固液混合物;②开大水龙头;③关闭水龙头;④微开水龙头;⑤加入少量蒸馏水润湿滤纸。
(5)抽滤后得到的FeCO3需要充分洗涤,如何检验FeCO3已洗涤干净?_____ 。

已知:“还原”时,FeS2与H2SO4不反应;Fe3+通过反应Ⅰ、Ⅱ被还原,其中反应Ⅰ为FeS2+14Fe3++8H2O=15Fe2++ 2SO
 +16H+。
+16H+。(1)滤渣的成分为
(2)“还原”时反应Ⅱ的离子方程式
(3)下列操作或描述不正确的是
A “沉淀”时,可以先将溶液调节成强碱性,再加入(NH4)2CO3以使沉淀完全
B 抽滤时,应选择比布氏漏斗内径略小又能将全部小孔盖住的滤纸
C 抽滤不宜用于过滤胶状沉淀,因为其易在滤纸上形成一层密实的沉淀,溶液不易透过
D 制得的FeCO3还需洗涤、烘干
(4)如图安装抽滤装置,经过一系列操作完成抽滤。请选择合适的编号,按正确的操作顺序补充 完整:

在布氏漏斗中加入滤纸→
①转移固液混合物;②开大水龙头;③关闭水龙头;④微开水龙头;⑤加入少量蒸馏水润湿滤纸。
(5)抽滤后得到的FeCO3需要充分洗涤,如何检验FeCO3已洗涤干净?
您最近一年使用:0次



