高铁酸钾(K2FeO4)是一种强氧化剂和环境友好型水处理剂,易分解,遇水和酸易变质。学习小组在实验室对高铁酸钾的制备和一些性质进行探究。
回答下列问题:
(1)高铁酸钾的制备。
步骤一:制备Na2FeO4,装置如图1所示。将b中饱和NaOH溶液全部逐滴滴入a中,充分反应;
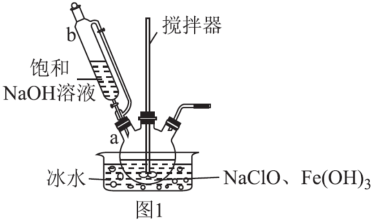
步骤二:由b向a中反应后液体中加入饱和KOH溶液;
步骤三:将a中所得浊液移出,分离提纯。
①仪器b的名称为___ ,其侧管的作用为___ 。
②步骤一中采用冰水浴冷却的目的为___ ;a中制备Na2FeO4反应的离子方程式为___ 。
③步骤二中,能得到K2FeO4悬浊液的原因为___ 。
④K2FeO4悬浊液经过滤、洗涤、提纯,可得产品。其中提纯所用的操作名称为___ 。
(2)K2FeO4遇水转化为Fe(OH)3,则其作水处理剂的优点为___ 。
(3)用图2所示装置检验K2FeO4受热分解的产物。
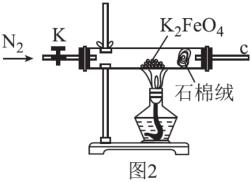
①检验分解的气体产物为O2的操作和现象为___ 。
②设计实验证明完全分解后的固体产物中不含Fe(Ⅱ)___ 。
回答下列问题:
(1)高铁酸钾的制备。
步骤一:制备Na2FeO4,装置如图1所示。将b中饱和NaOH溶液全部逐滴滴入a中,充分反应;

步骤二:由b向a中反应后液体中加入饱和KOH溶液;
步骤三:将a中所得浊液移出,分离提纯。
①仪器b的名称为
②步骤一中采用冰水浴冷却的目的为
③步骤二中,能得到K2FeO4悬浊液的原因为
④K2FeO4悬浊液经过滤、洗涤、提纯,可得产品。其中提纯所用的操作名称为
(2)K2FeO4遇水转化为Fe(OH)3,则其作水处理剂的优点为
(3)用图2所示装置检验K2FeO4受热分解的产物。

①检验分解的气体产物为O2的操作和现象为
②设计实验证明完全分解后的固体产物中不含Fe(Ⅱ)
20-21高三·河南·开学考试 查看更多[4]
河南部分学校2022届新高三8月份摸底联考化学试题安徽省亳州市涡阳县育萃高级中学2021-2022学年高二上学期第一次月考化学试题(已下线)3.1.2 不同价态铁元素之间的转化-2021-2022学年高一化学课后培优练(鲁科版2019必修第一册)山西省太原市第五十六中学2021-2022学年高三上学期第一次月考化学试题
更新时间:2021-08-28 12:17:10
|
相似题推荐
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐1】2023年7月18日,习总书记在全国生态环境保护大会上强调全面推进美丽中国建设加快推进人与自然和谐共生的现代化,务必要持续深入打好污染防治攻坚战。含氮化合物对生态环境和人类健康都有一定的影响,必须采取相应的措施来治理或加以控制。
(1)生物硝化反硝化法可将酸性废水中的氨氮转化为氮气,其原理如图所示。
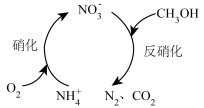
① 的空间构型为
的空间构型为___________ 。
②每处理含1mol 的酸性废水,理论上消耗CH3OH的物质的量为
的酸性废水,理论上消耗CH3OH的物质的量为___________ (保留两位有效数字)。
③上述生物硝化反硝化法的优点是___________ 。
(2)折点加氯法是将次氯酸钠投入废水中,将废水中的氨氮转化为N2的化学脱氮工艺。设定反应温度为25℃,向含 的酸性废水中投加NaClO时,
的酸性废水中投加NaClO时, 浓度、氯胺(NH2Cl)浓度与投入的NaClO溶液体积的关系如图所示。
浓度、氯胺(NH2Cl)浓度与投入的NaClO溶液体积的关系如图所示。
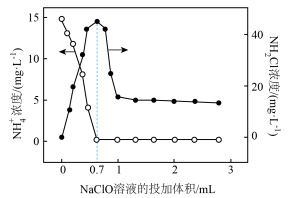
①在酸性废水中,投入的NaClO在0~0.7mL过程中发生的反应为 + ClO- = NH2Cl + H2O。投入量在0.7~1.0mL的过程中反应的离子方程式为
+ ClO- = NH2Cl + H2O。投入量在0.7~1.0mL的过程中反应的离子方程式为___________ 。
②实验证明,弱酸性有助于提高废水中氮的脱除率,其原因是___________ 。
(3)氨是一种无碳富氢的能源载体,体积能量密度高,易液化储存,是理想的储氢介质。近期科学家研究实现了以氨直接作为燃料,在低温碱性膜燃料电池中通过氨氧化反应实现化学能到电能的转化,且终端无碳、无污染气体排放,有助于实现碳达峰和碳中和。该氨碱性膜燃料电池的负极反应式为___________ 。
(4)腌制食品中亚硝酸盐允许残留量(以NaNO2计) 。为测定某咸菜中亚硝酸盐的残留量,取0.3kg咸菜榨汁,经处理得无色溶液,将所得溶液转移至250mL容量瓶并定容。取出25mL溶液置于锥形瓶中,加入盐酸调节pH,再滴加KI至过量,待反应完成后用
。为测定某咸菜中亚硝酸盐的残留量,取0.3kg咸菜榨汁,经处理得无色溶液,将所得溶液转移至250mL容量瓶并定容。取出25mL溶液置于锥形瓶中,加入盐酸调节pH,再滴加KI至过量,待反应完成后用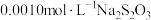 标准液滴定,共消耗体积为12.00mL。则该市售咸菜的亚硝酸盐残留量是否符合安全标准
标准液滴定,共消耗体积为12.00mL。则该市售咸菜的亚硝酸盐残留量是否符合安全标准 ___________ (请用计算结果和简要文字说明。已知: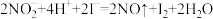 ;
;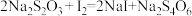 ) 。
) 。
(1)生物硝化反硝化法可将酸性废水中的氨氮转化为氮气,其原理如图所示。

①
 的空间构型为
的空间构型为②每处理含1mol
 的酸性废水,理论上消耗CH3OH的物质的量为
的酸性废水,理论上消耗CH3OH的物质的量为③上述生物硝化反硝化法的优点是
(2)折点加氯法是将次氯酸钠投入废水中,将废水中的氨氮转化为N2的化学脱氮工艺。设定反应温度为25℃,向含
 的酸性废水中投加NaClO时,
的酸性废水中投加NaClO时, 浓度、氯胺(NH2Cl)浓度与投入的NaClO溶液体积的关系如图所示。
浓度、氯胺(NH2Cl)浓度与投入的NaClO溶液体积的关系如图所示。
①在酸性废水中,投入的NaClO在0~0.7mL过程中发生的反应为
 + ClO- = NH2Cl + H2O。投入量在0.7~1.0mL的过程中反应的离子方程式为
+ ClO- = NH2Cl + H2O。投入量在0.7~1.0mL的过程中反应的离子方程式为②实验证明,弱酸性有助于提高废水中氮的脱除率,其原因是
(3)氨是一种无碳富氢的能源载体,体积能量密度高,易液化储存,是理想的储氢介质。近期科学家研究实现了以氨直接作为燃料,在低温碱性膜燃料电池中通过氨氧化反应实现化学能到电能的转化,且终端无碳、无污染气体排放,有助于实现碳达峰和碳中和。该氨碱性膜燃料电池的负极反应式为
(4)腌制食品中亚硝酸盐允许残留量(以NaNO2计)
 。为测定某咸菜中亚硝酸盐的残留量,取0.3kg咸菜榨汁,经处理得无色溶液,将所得溶液转移至250mL容量瓶并定容。取出25mL溶液置于锥形瓶中,加入盐酸调节pH,再滴加KI至过量,待反应完成后用
。为测定某咸菜中亚硝酸盐的残留量,取0.3kg咸菜榨汁,经处理得无色溶液,将所得溶液转移至250mL容量瓶并定容。取出25mL溶液置于锥形瓶中,加入盐酸调节pH,再滴加KI至过量,待反应完成后用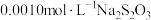 标准液滴定,共消耗体积为12.00mL。则该市售咸菜的亚硝酸盐残留量是否符合安全标准
标准液滴定,共消耗体积为12.00mL。则该市售咸菜的亚硝酸盐残留量是否符合安全标准 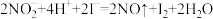 ;
;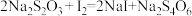 ) 。
) 。
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐2】某小组探究“地康法制氯气”的原理并验证Cl2的性质,设计实验如下(夹持装置略去)请回答下列问题:
I. Cl2的制备。
(1)装置B中发生反应的化学方程式为____________________ 。
(2)装置C的作用除干燥气体外还有_________________ 。
(3)装置 E中盛放CuSO4的仪器名称为_______________ ;反应开始后,硫酸铜变蓝,则装置D中发生反应的化学方程式为_____________________ 。
II. Cl2性质的验证。
该小组用实验I中制得的Cl2和如图所示装置(不能重复使用)依次验证干燥纯净的Cl2无漂白性、湿润的Cl2有漂白性、Cl的非金属性强于S
查阅资料:
①PdCl2溶液捕获CO时,生成金属单质和两种酸性气体化合物;
②少量CO2不干扰实验;
③该实验条件下,C与Cl2不反应。
(4)按气流从左到右的方向,装置连接的合理顺序为E→__→__→__→__→__→__→__→尾气处理____________ (填装置字母,)
(5)试剂X的名称为____________ 。
(6)装置J中发生反应的化学方程式为_________________ 。
(7)设计实验证明经净化后的Cl2中不含HCl:_______________
I. Cl2的制备。
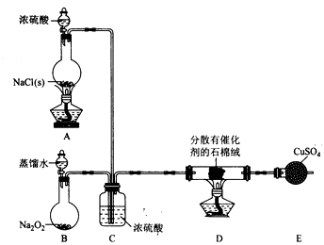
(1)装置B中发生反应的化学方程式为
(2)装置C的作用除干燥气体外还有
(3)装置 E中盛放CuSO4的仪器名称为
II. Cl2性质的验证。
该小组用实验I中制得的Cl2和如图所示装置(不能重复使用)依次验证干燥纯净的Cl2无漂白性、湿润的Cl2有漂白性、Cl的非金属性强于S
查阅资料:
①PdCl2溶液捕获CO时,生成金属单质和两种酸性气体化合物;
②少量CO2不干扰实验;
③该实验条件下,C与Cl2不反应。
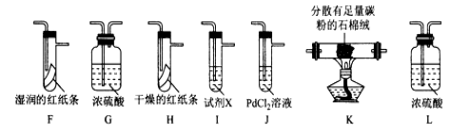
(4)按气流从左到右的方向,装置连接的合理顺序为E→__→__→__→__→__→__→__→尾气处理
(5)试剂X的名称为
(6)装置J中发生反应的化学方程式为
(7)设计实验证明经净化后的Cl2中不含HCl:
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐3】研究氯气及其水溶液的性质具有重要的意义。
(1)学习小组利用下图研究物质的性质,其中气体X的主要成分是氯气,杂质是空气和水蒸气。
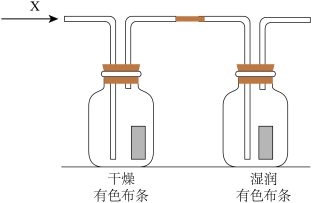
回答下列问题:
①证明氯气不能漂白的证据是__________________________________________ 。
②湿润的有色布条褪色原因是_____________________________ (用必要的文字和化学用语说明)。
③这种实验设计还存在事故隐患,请你设计实验方案消除事故隐患:__________________________ 。
(2)在探究新制饱和氯水成分的实验中,由实验现象得出的结论中正确的是_______ 。
a.氯水的颜色呈浅黄绿色,证明氯气与水没有反应
b.向氯水中滴加硝酸酸化的AgNO3溶液,产生白色沉淀,证明氯水中含有Cl-
c.向氯水中加入NaHCO3粉末,有气泡产生,证明氯水是一种酸
d.氯水中加入氢氧化钠溶液后黄绿色消失,溶液中Cl-和ClO-数目增加
(3)将新制氯水慢慢滴加到含酚酞的NaOH溶液中,滴到最后一滴时红色突然褪去,产生此现象的原因可能有两种(简要文字说明):①___________ ;②____________ 。实验证明:红色褪去的原因是①或者是②___________ 。
(1)学习小组利用下图研究物质的性质,其中气体X的主要成分是氯气,杂质是空气和水蒸气。

回答下列问题:
①证明氯气不能漂白的证据是
②湿润的有色布条褪色原因是
③这种实验设计还存在事故隐患,请你设计实验方案消除事故隐患:
(2)在探究新制饱和氯水成分的实验中,由实验现象得出的结论中正确的是
a.氯水的颜色呈浅黄绿色,证明氯气与水没有反应
b.向氯水中滴加硝酸酸化的AgNO3溶液,产生白色沉淀,证明氯水中含有Cl-
c.向氯水中加入NaHCO3粉末,有气泡产生,证明氯水是一种酸
d.氯水中加入氢氧化钠溶液后黄绿色消失,溶液中Cl-和ClO-数目增加
(3)将新制氯水慢慢滴加到含酚酞的NaOH溶液中,滴到最后一滴时红色突然褪去,产生此现象的原因可能有两种(简要文字说明):①
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
解题方法
【推荐1】A、B、C、D分别是HCl、FeCl3、MgCl2、AlCl3溶液中的一种,某实验小组用另一种溶液X与它们进行了如图所示的实验,试推断A、B、C、D、X分别为:
A:____________ B:____________ C:___________ D:____________ X:______________
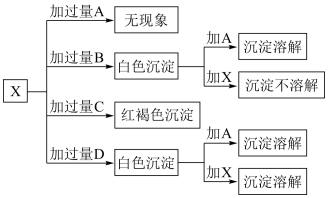
A:

您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
解题方法
【推荐2】甲、乙、丙三种物质之间有如下转化关系:
甲 乙
乙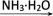 丙
丙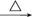 甲
甲
(1)若甲是不溶于水的白色固体物质,既能溶于盐酸又能溶于氢氧化钠溶液,则甲是_____ 。写出“丙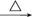 甲”转化的化学方程式:
甲”转化的化学方程式:_______________________________ 。
(2)若乙溶液中加入KSCN溶液,有血红色出现,则甲物质是:___________ 。写出“甲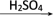 乙”转化的离子方程式:
乙”转化的离子方程式:________________________________ 。
甲
 乙
乙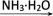 丙
丙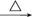 甲
甲(1)若甲是不溶于水的白色固体物质,既能溶于盐酸又能溶于氢氧化钠溶液,则甲是
 甲”转化的化学方程式:
甲”转化的化学方程式:(2)若乙溶液中加入KSCN溶液,有血红色出现,则甲物质是:
 乙”转化的离子方程式:
乙”转化的离子方程式:
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐3】由两种或两种以上金属离子(或铵根离子)和一种酸根离子构成的盐称为复盐。为确定某复盐结晶水合物Q(含有两种金属阳离子)的组成,甲、乙两位同学分别进行了如下实验:
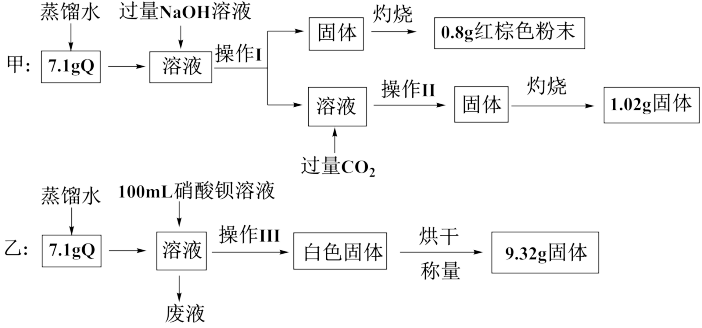
请回答下列问题:
(1)操作Ⅰ、Ⅱ、Ⅲ相同,为__________ 、洗涤,仅由甲的实验能不能确定操作Ⅰ中所得固体的成分?__________ (填“能”或“不能”),说明理由:_________ 。
(2)甲实验中通入过量二氧化碳发生反应生成沉淀的离子方程式为_______ 。
(3)0.8 g红棕色粉末的物质的量为__________ 。
(4)乙实验中,若100 mL硝酸钡溶液恰好完全反应,则硝酸钡溶液的物质的量浓度为__________ 。
(5)Q的化学式为________ 。

请回答下列问题:
(1)操作Ⅰ、Ⅱ、Ⅲ相同,为
(2)甲实验中通入过量二氧化碳发生反应生成沉淀的离子方程式为
(3)0.8 g红棕色粉末的物质的量为
(4)乙实验中,若100 mL硝酸钡溶液恰好完全反应,则硝酸钡溶液的物质的量浓度为
(5)Q的化学式为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
【推荐1】铵明矾是一种广泛应用于医药、食品、污水处理等多个行业的重要化工产品。以高岭土(含SiO2、Al2O3、少量Fe2O3等)为原料制备硫酸铝晶体[Al2(SO4)3·18H2O]和铵明矾[NH4Al(SO4)2·12H2O]的工艺流程如下图所示。
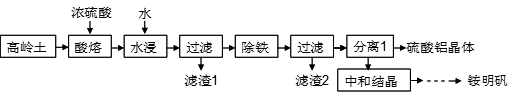
请回答下列问题:
(1)高岭土首先需要灼烧,实验室灼烧高岭土所需的实验仪器有_____ (填字母)。
a.蒸发皿 b.泥三角 c.漏斗 d.酒精灯 e.三脚架 f.坩埚 g.烧杯 h.试管
(2)研究发现,随着酸熔温度升高,氧化铝的溶出率增大,但若酸熔时温度过高(超过240℃),SiO2不仅会消耗硫酸,导致氧化铝溶出率下降,还会同时产生高温的腐蚀性气体,该副反应的化学方程式为_____ 。
(3)要检验除铁后的滤液中是否含有Fe3+,应采取的实验方法为_______ ;滤渣2的主要成分为_______ (填化学式)。
(4)“分离1”操作包含的实验步骤有_______ 、_______ 、_______ 、洗涤、干燥。
(5)中和结晶操作是将过滤出硫酸铝晶体后的滤液,先用硫酸调节酸铝比(溶液中游离硫酸和硫酸铝的物质的量之比),再用氨水中和至一定的pH值即可析出铵明矾晶体,写出该过程中的总反应方程式________ 。
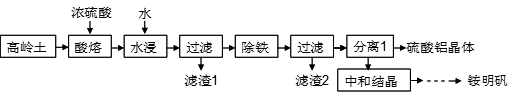
请回答下列问题:
(1)高岭土首先需要灼烧,实验室灼烧高岭土所需的实验仪器有
a.蒸发皿 b.泥三角 c.漏斗 d.酒精灯 e.三脚架 f.坩埚 g.烧杯 h.试管
(2)研究发现,随着酸熔温度升高,氧化铝的溶出率增大,但若酸熔时温度过高(超过240℃),SiO2不仅会消耗硫酸,导致氧化铝溶出率下降,还会同时产生高温的腐蚀性气体,该副反应的化学方程式为
(3)要检验除铁后的滤液中是否含有Fe3+,应采取的实验方法为
(4)“分离1”操作包含的实验步骤有
(5)中和结晶操作是将过滤出硫酸铝晶体后的滤液,先用硫酸调节酸铝比(溶液中游离硫酸和硫酸铝的物质的量之比),再用氨水中和至一定的pH值即可析出铵明矾晶体,写出该过程中的总反应方程式
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
【推荐2】工业上常以黄铜矿(主要成分是CuFeS2)为原料制备铜以及副产物铁红(Fe2O3),两种方法均能实现铜的冶炼,其工艺流程如图:

回答下列问题:
(1)为使“焙烧”反应充分进行,工业上可采取的措施是____ (写一条),写出“焙烧”时反应的化学方程式:___ 。
(2)“灼烧1”工序中起氧化作用的物质是____ 。
(3)FeCl3溶液“浸取”时,铜的浸出率结果如图所示。由图可知,当铜的浸出率为90%时,所采用的实验条件为____ ,写出该工序发生反应的离子方程式:______ 。
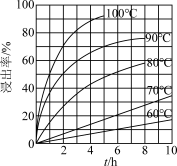
(4)“调节pH”所用试剂X是_____ ,该工序的目的是除去溶液中的Fe3+。当调节溶液的pH=3.5时,Fe3+______ (填“是”或“不是”)沉淀完全[c(Fe3+)≤1×10-5mol•L-1时可认为Fe3+沉淀完全],若滤液中c(Cu2+)=0.2mol•L-1,此时是否有Cu(OH)2析出?_______ (列式计算)。{已知:25℃时,Ksp[Fe(OH)3]=1.0×10-39、Ksp[Cu(OH)2]=2.2×10-20}
(5)方法乙比方法甲更好,其原因是_____ (写一点)。

回答下列问题:
(1)为使“焙烧”反应充分进行,工业上可采取的措施是
(2)“灼烧1”工序中起氧化作用的物质是
(3)FeCl3溶液“浸取”时,铜的浸出率结果如图所示。由图可知,当铜的浸出率为90%时,所采用的实验条件为

(4)“调节pH”所用试剂X是
(5)方法乙比方法甲更好,其原因是
您最近一年使用:0次
【推荐3】钛酸钡被誉为“电子陶瓷工业的支柱”。工业制取方法如图,先获得不溶性草酸氧钛钡晶体[BaTiO(C2O4)2•4H2O],煅烧后可获得钛酸钡粉体。
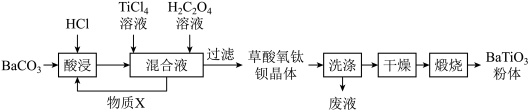
(1)酸浸时发生的反应的离子方程式为___ 。
(2)配制TiCl4溶液时通常将TiCl4固体溶于浓盐酸再加水稀释,其目的是___ 。
(3)加入H2C2O4溶液时,发生反应的化学方程式为___ 。可循环使用的物质X是___ (填化学式),设计实验方案验证草酸氧钛钡晶体是否洗涤干净:___ 。
(4)煅烧草酸氧钛钡晶体得到BaTiO3的同时,生成高温下的气态产物有CO、___ 。
(5)工业上用饱和Na2CO3溶液处理重晶石(主要成分是BaSO4),待达到平衡后,移走上层清液,重复多次操作,将其转化为易溶于酸的BaCO3,再由BaCO3制备其它钡盐。已知常温下:Ksp(BaSO4)=1.0×10-10,Ksp(BaCO3)=2.59×10-9,请问至少需要___ mol•L-1的碳酸钠溶液浸泡才能实现上述转化(忽略CO32-的水解)。

(1)酸浸时发生的反应的离子方程式为
(2)配制TiCl4溶液时通常将TiCl4固体溶于浓盐酸再加水稀释,其目的是
(3)加入H2C2O4溶液时,发生反应的化学方程式为
(4)煅烧草酸氧钛钡晶体得到BaTiO3的同时,生成高温下的气态产物有CO、
(5)工业上用饱和Na2CO3溶液处理重晶石(主要成分是BaSO4),待达到平衡后,移走上层清液,重复多次操作,将其转化为易溶于酸的BaCO3,再由BaCO3制备其它钡盐。已知常温下:Ksp(BaSO4)=1.0×10-10,Ksp(BaCO3)=2.59×10-9,请问至少需要
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐1】焦亚硫酸钠 是常用的抗氧化剂,在空气中、受热时均易分解。
是常用的抗氧化剂,在空气中、受热时均易分解。
(1)化学兴趣小组同学利用如图所示装置(部分夹持装置已略去,实验前已除去装置中的空气)制取 并探究
并探究 的性质。
的性质。

Ⅰ.打开 和
和 ,关闭
,关闭 ,制取
,制取
① 中
中 元素化合价为
元素化合价为 ,其中
,其中 的化合价为
的化合价为___________ ;装置C中干燥管的作用是___________ 。
② 中通入过量
中通入过量 充分反应后,经冷却结晶时发生反应
充分反应后,经冷却结晶时发生反应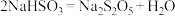 可获得
可获得 晶体。
晶体。 中生成
中生成 的化学方程式为
的化学方程式为___________ 。
③ 中所得
中所得 晶体常用饱和
晶体常用饱和 水溶液洗涤。用饱和
水溶液洗涤。用饱和 水溶液洗涤的目的除洗去产物表面的杂质离子外还有
水溶液洗涤的目的除洗去产物表面的杂质离子外还有___________ 。
II.更换 瓶中的溶液,探究
瓶中的溶液,探究 的性质。
的性质。
④将 中溶液更换为品红的乙醇溶液,无明显现象;而将
中溶液更换为品红的乙醇溶液,无明显现象;而将 通入品红的水溶液中,溶液褪色。由此可推知,使品红水溶液褪色的物质可能是
通入品红的水溶液中,溶液褪色。由此可推知,使品红水溶液褪色的物质可能是___________ 。(写化学式)
(2)葡萄酒中常加入 作抗氧化剂。测定某葡萄酒中
作抗氧化剂。测定某葡萄酒中 残留量的实验步骤如下:取
残留量的实验步骤如下:取 葡萄酒样品,用
葡萄酒样品,用 的
的 标准液滴定至恰好完全反应(以淀粉溶液作指示剂),消耗碘标准液
标准液滴定至恰好完全反应(以淀粉溶液作指示剂),消耗碘标准液 ,已知滴定过程中发生的反应为:
,已知滴定过程中发生的反应为: (未配平)。计算该葡萄酒中
(未配平)。计算该葡萄酒中 的残留量
的残留量___________ (以 为单位,写出计算过程)。
为单位,写出计算过程)。
 是常用的抗氧化剂,在空气中、受热时均易分解。
是常用的抗氧化剂,在空气中、受热时均易分解。(1)化学兴趣小组同学利用如图所示装置(部分夹持装置已略去,实验前已除去装置中的空气)制取
 并探究
并探究 的性质。
的性质。
Ⅰ.打开
 和
和 ,关闭
,关闭 ,制取
,制取
①
 中
中 元素化合价为
元素化合价为 ,其中
,其中 的化合价为
的化合价为②
 中通入过量
中通入过量 充分反应后,经冷却结晶时发生反应
充分反应后,经冷却结晶时发生反应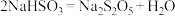 可获得
可获得 晶体。
晶体。 中生成
中生成 的化学方程式为
的化学方程式为③
 中所得
中所得 晶体常用饱和
晶体常用饱和 水溶液洗涤。用饱和
水溶液洗涤。用饱和 水溶液洗涤的目的除洗去产物表面的杂质离子外还有
水溶液洗涤的目的除洗去产物表面的杂质离子外还有II.更换
 瓶中的溶液,探究
瓶中的溶液,探究 的性质。
的性质。④将
 中溶液更换为品红的乙醇溶液,无明显现象;而将
中溶液更换为品红的乙醇溶液,无明显现象;而将 通入品红的水溶液中,溶液褪色。由此可推知,使品红水溶液褪色的物质可能是
通入品红的水溶液中,溶液褪色。由此可推知,使品红水溶液褪色的物质可能是(2)葡萄酒中常加入
 作抗氧化剂。测定某葡萄酒中
作抗氧化剂。测定某葡萄酒中 残留量的实验步骤如下:取
残留量的实验步骤如下:取 葡萄酒样品,用
葡萄酒样品,用 的
的 标准液滴定至恰好完全反应(以淀粉溶液作指示剂),消耗碘标准液
标准液滴定至恰好完全反应(以淀粉溶液作指示剂),消耗碘标准液 ,已知滴定过程中发生的反应为:
,已知滴定过程中发生的反应为: (未配平)。计算该葡萄酒中
(未配平)。计算该葡萄酒中 的残留量
的残留量 为单位,写出计算过程)。
为单位,写出计算过程)。
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐2】一种从钼镍废催化剂(主要含MoS2、NiS、Al2O3、SiO2以及C)中回收镍和钼的工艺流程如下:

回答下列问题:
(1)写出“培烧”时产生的CO2的电子式:_______ 。
(2)“焙烧”时,MoS2首先转化为MoO3,写出该反应的化学方程式:_______ 。
(3)写出滤液中溶质的一种工业用途:_______ ;“净化2”时,发生反应的离子方程式为_______ 。
(4)已知常温下,Ksp(CaMoO4)=1.46×10-8;Ksp(CaCO3)=3.36×10-9,由CaMoO4制备Na2MoO4的方法是_______ 。
(5)已知NiO是不溶于水的碱性氧化物,由浸渣“除铝”所用的试剂是_______ ;“酸溶”得到的溶液制备NiSO4·7H2O的操作方法是_______ 、过滤、洗涤、干燥。
(6)若废催化剂中含160 g MoS2,上,述工艺中获得CaMoO4的质量为190 g,则CaMoO4的产率为_______ 。

回答下列问题:
(1)写出“培烧”时产生的CO2的电子式:
(2)“焙烧”时,MoS2首先转化为MoO3,写出该反应的化学方程式:
(3)写出滤液中溶质的一种工业用途:
(4)已知常温下,Ksp(CaMoO4)=1.46×10-8;Ksp(CaCO3)=3.36×10-9,由CaMoO4制备Na2MoO4的方法是
(5)已知NiO是不溶于水的碱性氧化物,由浸渣“除铝”所用的试剂是
(6)若废催化剂中含160 g MoS2,上,述工艺中获得CaMoO4的质量为190 g,则CaMoO4的产率为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐3】铝是活泼的金属,某学习小组通过实验探究铝及其化合物的性质。
(1)用坩埚钳夹住一片未打磨过的薄铝片在酒精灯上加热,铝片内有熔化的物质被包裹着,但没有熔融下滴.原因是_______ 。
(2)向 溶液中逐滴滴加氨水至氨水过量,实验现象为
溶液中逐滴滴加氨水至氨水过量,实验现象为_______ 。
(3) 既能溶于盐酸又能溶于
既能溶于盐酸又能溶于 溶液,
溶液, 溶于
溶于 溶液的离子方程式为
溶液的离子方程式为_______ 。
(4) 可作污水处理剂或石油工业的催化剂,通过下图所示装置制取少量
可作污水处理剂或石油工业的催化剂,通过下图所示装置制取少量 。
。
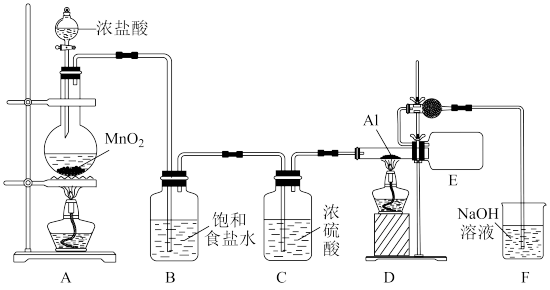
已知:无水氯化铝是白色晶体,易升华,遇水或水蒸气发生剧烈反应,产生 ,同时看到有白雾现象。
,同时看到有白雾现象。
①装置A中反应的化学方程式为_______ 。
②该实验中有两处加热装置,实验时先点燃的是_______ ,(填“A”或“D”)装置的酒精灯。理由是_______ 。
③装置E和装置F之间连接有球形干燥管,作用是_______ 。
④无水 遇水蒸气反应的化学方程式
遇水蒸气反应的化学方程式_______ 。
(1)用坩埚钳夹住一片未打磨过的薄铝片在酒精灯上加热,铝片内有熔化的物质被包裹着,但没有熔融下滴.原因是
(2)向
 溶液中逐滴滴加氨水至氨水过量,实验现象为
溶液中逐滴滴加氨水至氨水过量,实验现象为(3)
 既能溶于盐酸又能溶于
既能溶于盐酸又能溶于 溶液,
溶液, 溶于
溶于 溶液的离子方程式为
溶液的离子方程式为(4)
 可作污水处理剂或石油工业的催化剂,通过下图所示装置制取少量
可作污水处理剂或石油工业的催化剂,通过下图所示装置制取少量 。
。
已知:无水氯化铝是白色晶体,易升华,遇水或水蒸气发生剧烈反应,产生
 ,同时看到有白雾现象。
,同时看到有白雾现象。①装置A中反应的化学方程式为
②该实验中有两处加热装置,实验时先点燃的是
③装置E和装置F之间连接有球形干燥管,作用是
④无水
 遇水蒸气反应的化学方程式
遇水蒸气反应的化学方程式
您最近一年使用:0次



