工业上常以黄铜矿(主要成分是CuFeS2)为原料制备铜以及副产物铁红(Fe2O3),两种方法均能实现铜的冶炼,其工艺流程如图:

回答下列问题:
(1)为使“焙烧”反应充分进行,工业上可采取的措施是____ (写一条),写出“焙烧”时反应的化学方程式:___ 。
(2)“灼烧1”工序中起氧化作用的物质是____ 。
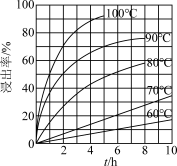
(3)FeCl3溶液“浸取”时,铜的浸出率结果如图所示。由图可知,当铜的浸出率为90%时,所采用的实验条件为____ ,写出该工序发生反应的离子方程式:______ 。
(4)“调节pH”所用试剂X是_____ ,该工序的目的是除去溶液中的Fe3+。当调节溶液的pH=3.5时,Fe3+______ (填“是”或“不是”)沉淀完全[c(Fe3+)≤1×10-5mol•L-1时可认为Fe3+沉淀完全],若滤液中c(Cu2+)=0.2mol•L-1,此时是否有Cu(OH)2析出?_______ (列式计算)。{已知:25℃时,Ksp[Fe(OH)3]=1.0×10-39、Ksp[Cu(OH)2]=2.2×10-20}
(5)方法乙比方法甲更好,其原因是_____ (写一点)。

回答下列问题:
(1)为使“焙烧”反应充分进行,工业上可采取的措施是
(2)“灼烧1”工序中起氧化作用的物质是
(3)FeCl3溶液“浸取”时,铜的浸出率结果如图所示。由图可知,当铜的浸出率为90%时,所采用的实验条件为

(4)“调节pH”所用试剂X是
(5)方法乙比方法甲更好,其原因是
更新时间:2019-09-26 12:30:42
|
相似题推荐
解答题-工业流程题
|
适中
(0.65)
名校
【推荐1】由含碘废水制取碘酸钾的一种工艺如下:
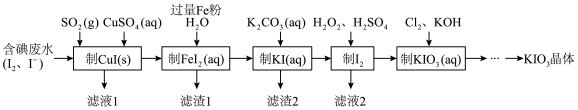
⑴ 写出KIO3在日常生活中的一个重要应用________________________ 。
⑵ 检验“含碘废水”中是否含有单质I2的常用试剂是________ (写试剂名称)。
⑶ 通入SO2的目的是将I2还原为I-,该反应的离子方程式为______________________ 。
⑷ 工艺中五种物质的制备反应中,不涉及氧化还原反应的步骤是“制________ ”。
⑸ “制KI(aq)”时,该温度下水的离子积为Kw=1.0×10-13,Ksp[Fe(OH)2]=9.0×10-15。
为避免0.9 mol·L-1 FeI2溶液中Fe2+水解生成胶状物吸附I-,起始加入K2CO3必须保持溶液的pH不大于______ 。
⑹ “制KIO3溶液”反应的离子方程式为__________________ 。

⑺ KCl、KIO3的溶解度曲线如图所示。流程中由“KIO3(aq)”得到KIO3晶体的操作步骤为_____________________ 。

⑴ 写出KIO3在日常生活中的一个重要应用
⑵ 检验“含碘废水”中是否含有单质I2的常用试剂是
⑶ 通入SO2的目的是将I2还原为I-,该反应的离子方程式为
⑷ 工艺中五种物质的制备反应中,不涉及氧化还原反应的步骤是“制
⑸ “制KI(aq)”时,该温度下水的离子积为Kw=1.0×10-13,Ksp[Fe(OH)2]=9.0×10-15。
为避免0.9 mol·L-1 FeI2溶液中Fe2+水解生成胶状物吸附I-,起始加入K2CO3必须保持溶液的pH不大于
⑹ “制KIO3溶液”反应的离子方程式为

⑺ KCl、KIO3的溶解度曲线如图所示。流程中由“KIO3(aq)”得到KIO3晶体的操作步骤为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
【推荐2】我国是稀土储量大国,氧化铈 是一种应用广泛的稀土氧化物。为节约和充分利用资源,以废料(主要含
是一种应用广泛的稀土氧化物。为节约和充分利用资源,以废料(主要含 ,还含少量的
,还含少量的 、
、 、
、 )为原料,通过如图工艺流程制备
)为原料,通过如图工艺流程制备 。
。

已知: 具有强氧化性,通常情况下不与无机酸反应。
具有强氧化性,通常情况下不与无机酸反应。
回答下列问题:
(1)“酸浸1”的目的是________________ ,“浸液A”中主要含有的阳离子为________ 。
(2)“酸浸2”中反应的离子方程式为________________________ ;该过程中用浓盐酸代替双氧水和稀硫酸也可反应,但不用浓盐酸的原因是________ ;“浸渣B”的主要成分的主要用途为_____________ (写一种)。
(3)“酸浸2”中Ce的浸出率与 、温度的关系如图所示,应选择的适宜条件为
、温度的关系如图所示,应选择的适宜条件为____________ 。

(4)取上述流程中得到的 产品1.000g,用高氯酸和磷酸的混合液加热溶解,冷却至室温后,与
产品1.000g,用高氯酸和磷酸的混合液加热溶解,冷却至室温后,与 标准溶液恰好完全反应(反应时存在关系式:
标准溶液恰好完全反应(反应时存在关系式: ,其他杂质均不反应),则该产品中
,其他杂质均不反应),则该产品中 的质量分数为
的质量分数为________ (填含c、V的表达式)。
 是一种应用广泛的稀土氧化物。为节约和充分利用资源,以废料(主要含
是一种应用广泛的稀土氧化物。为节约和充分利用资源,以废料(主要含 ,还含少量的
,还含少量的 、
、 、
、 )为原料,通过如图工艺流程制备
)为原料,通过如图工艺流程制备 。
。
已知:
 具有强氧化性,通常情况下不与无机酸反应。
具有强氧化性,通常情况下不与无机酸反应。回答下列问题:
(1)“酸浸1”的目的是
(2)“酸浸2”中反应的离子方程式为
(3)“酸浸2”中Ce的浸出率与
 、温度的关系如图所示,应选择的适宜条件为
、温度的关系如图所示,应选择的适宜条件为
(4)取上述流程中得到的
 产品1.000g,用高氯酸和磷酸的混合液加热溶解,冷却至室温后,与
产品1.000g,用高氯酸和磷酸的混合液加热溶解,冷却至室温后,与 标准溶液恰好完全反应(反应时存在关系式:
标准溶液恰好完全反应(反应时存在关系式: ,其他杂质均不反应),则该产品中
,其他杂质均不反应),则该产品中 的质量分数为
的质量分数为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐3】硫代硫酸钠可用于照相业作定影剂、纸浆漂白作脱氯剂等。实验室用SO2通入Na2S和Na2CO3的混合液中来制备硫代硫酸钠。
本实验对Na2S纯度要求较高,利用图1所示的装置可将工业级的Na2S提纯。已知Na2S常温下微溶于酒精,加热时溶解度迅速增大,杂质不溶于酒精。提纯过程为:将已称量好的工业级Na2S放入圆底烧瓶中,加入一定质量的酒精和少量水。按图1所示装配所需仪器,向冷凝管通入冷却水,同时水浴加热。待烧瓶中固体不再减少时,停止加热。将烧瓶取下,立即趁热过滤,再冷却结晶,抽滤。将所得固体洗涤、干燥,得到Na2S•9H2O晶体。

(1)下列说法不正确 的是___ 。
A.将晶体转移至布氏漏斗时,若器壁上粘有少量晶体,应用冷水淋洗
B.抽滤时,为防止滤纸穿孔,可适当关小水龙头或多加一层滤纸
C.洗涤时,可用一定浓度的乙醇溶液洗涤晶体,目的是洗除晶体表面的杂质,易于得到干燥晶体
D.为加快产品的干燥,可高温烘干
E.在提纯过程中“趁热过滤”操作的目的是防止硫化钠结晶析出而损失、去除杂质
(2)用图2所示装置制取Na2S2O3,其中盛放Na2SO3固体的玻璃仪器名称是________ ,三颈烧瓶中发生反应的化学方程式__________ 。

(3)硫代硫酸钠样品中Na2S2O3•5H2O的纯度(质量分数)可通过氧化还原滴定法测定,相关反应方程式为2Na2S2O3+I2=2NaI+Na2S4O6。准确称取W g样品于锥形瓶中,用适量蒸馏水溶解,并滴加淀粉溶液作指示剂。用0.1000 mol/L碘的标准溶液进行滴定。请回答:
①达到滴定终点的标志是_______ 。
②滴定起始和终点的液面位置如图3,则消耗碘的标准溶液体积为_______ mL,产品纯度为________ (设Na2S2O3•5H2O相对分子质量为M)。

③若滴定时振荡不充分,刚看到溶液局部变色就停止滴定,则会使样品中Na2S2O3•5H2O的纯度的测量结果________ (填“偏高”“偏低”或“不变”)。
本实验对Na2S纯度要求较高,利用图1所示的装置可将工业级的Na2S提纯。已知Na2S常温下微溶于酒精,加热时溶解度迅速增大,杂质不溶于酒精。提纯过程为:将已称量好的工业级Na2S放入圆底烧瓶中,加入一定质量的酒精和少量水。按图1所示装配所需仪器,向冷凝管通入冷却水,同时水浴加热。待烧瓶中固体不再减少时,停止加热。将烧瓶取下,立即趁热过滤,再冷却结晶,抽滤。将所得固体洗涤、干燥,得到Na2S•9H2O晶体。

(1)下列说法
A.将晶体转移至布氏漏斗时,若器壁上粘有少量晶体,应用冷水淋洗
B.抽滤时,为防止滤纸穿孔,可适当关小水龙头或多加一层滤纸
C.洗涤时,可用一定浓度的乙醇溶液洗涤晶体,目的是洗除晶体表面的杂质,易于得到干燥晶体
D.为加快产品的干燥,可高温烘干
E.在提纯过程中“趁热过滤”操作的目的是防止硫化钠结晶析出而损失、去除杂质
(2)用图2所示装置制取Na2S2O3,其中盛放Na2SO3固体的玻璃仪器名称是

(3)硫代硫酸钠样品中Na2S2O3•5H2O的纯度(质量分数)可通过氧化还原滴定法测定,相关反应方程式为2Na2S2O3+I2=2NaI+Na2S4O6。准确称取W g样品于锥形瓶中,用适量蒸馏水溶解,并滴加淀粉溶液作指示剂。用0.1000 mol/L碘的标准溶液进行滴定。请回答:
①达到滴定终点的标志是
②滴定起始和终点的液面位置如图3,则消耗碘的标准溶液体积为

③若滴定时振荡不充分,刚看到溶液局部变色就停止滴定,则会使样品中Na2S2O3•5H2O的纯度的测量结果
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐1】谢弗勒尔盐(Cu2SO3·CuSO3·2H2O)是一种不溶于水、酸和乙醇的固体,100℃时发生分解。可由CuSO4·5H2O和SO2等为原料制备,实验装置如下图所示:
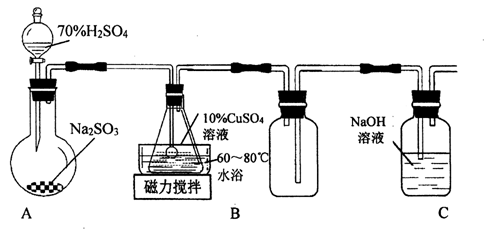
(1)装置A在常温下制取SO2时,用70%硫酸而不用稀硫酸和98%浓硫酸,其原因是________ 。
(2)装置B中发生反应的离子方程式为_________ 。
(3)装置C的作用是__________ 。
(4)从B中获得的固体需先用蒸馏水充分洗涤,再真空干燥。检验已洗涤完全的方法是________________ 。
(5)请补充完整由工业级氧化铜(含少量FeO)制备实验原料(纯净CuSO4·5H2O)的实验方案:向工业级氧化铜中边搅拌边加入稍过量的硫酸溶液,微热使其完全溶解,边搅拌边向其中滴入______ 溶液,加入适量纯净的________ 调节3.2<pH<4.2,静置,过滤,将滤液水浴加热蒸发浓缩至表面出现晶膜,冷却结晶,过滤,用95%酒精洗涤晶体2~3次,晾干,得到CuSO4·5H2O。
[已知:该溶液中氢氧化物开始沉淀与沉淀完全时的pH范围分别为:Fe(OH)2(5.8, 8.8); Cu(OH)2(4.2, 6.7); Fe(OH)3(1.1,3.2)]

(1)装置A在常温下制取SO2时,用70%硫酸而不用稀硫酸和98%浓硫酸,其原因是
(2)装置B中发生反应的离子方程式为
(3)装置C的作用是
(4)从B中获得的固体需先用蒸馏水充分洗涤,再真空干燥。检验已洗涤完全的方法是
(5)请补充完整由工业级氧化铜(含少量FeO)制备实验原料(纯净CuSO4·5H2O)的实验方案:向工业级氧化铜中边搅拌边加入稍过量的硫酸溶液,微热使其完全溶解,边搅拌边向其中滴入
[已知:该溶液中氢氧化物开始沉淀与沉淀完全时的pH范围分别为:Fe(OH)2(5.8, 8.8); Cu(OH)2(4.2, 6.7); Fe(OH)3(1.1,3.2)]
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐2】如图是工业上以制作印刷电路的废液 含
含 、
、 、
、 、
、 生产CuCl的流程:
生产CuCl的流程:
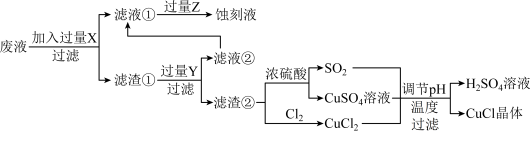
已知:CuCl是一种白色粉末,微溶于水、不溶于乙醇及稀硫酸,在空气中迅速被氧化为绿色,见光分解变成褐色。
请回答下列问题:
(1)流程中的滤渣①与Y反应和X与Y反应相比,单位时间内得到的气体多,其原因为______ 。
(2)滤液②需要加过量Z,检验Z过量的方法是______ 。
(3)写出生成CuCl的离子方程式:______ 。
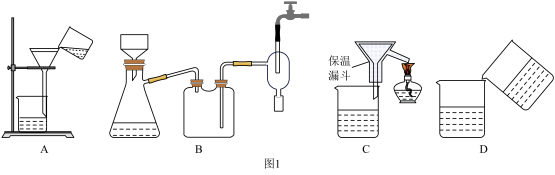
(4)为了提高CuCl产品的纯度,流程中的“过滤”操作适宜用下列装置 图
图 中的
中的______  填选项字母
填选项字母 ,过滤后,洗涤CuCl的试剂宜选用
,过滤后,洗涤CuCl的试剂宜选用______  填“无水乙醇”或“稀硫酸”
填“无水乙醇”或“稀硫酸”
 加入饱和NaCl溶液中会部分溶解生成
加入饱和NaCl溶液中会部分溶解生成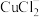 ,在一定温度下建立两个平衡:
,在一定温度下建立两个平衡:
I.CuCl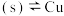
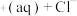
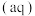
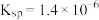
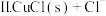
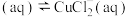
 。
。
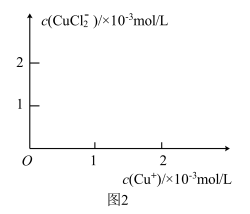
(5)分析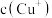 、
、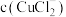 和
和 、K的数学关系,在图2中画出
、K的数学关系,在图2中画出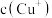 、
、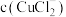 的关系曲线
的关系曲线________ (要求至少标出一个坐标点)
(6)氯化亚铜的定量分析:
①称取样品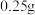 于250mL锥形瓶中,加入10mL过量的
于250mL锥形瓶中,加入10mL过量的 溶液,不断摇动:
溶液,不断摇动:
②待样品溶解后,加入20mL蒸馏水和2滴指示剂;
③立即用 硫酸铈标准溶液滴定至绿色为终点;
硫酸铈标准溶液滴定至绿色为终点;
④重复三次,消耗硫酸铈溶液的平均体积为 。
。
上述相应化学反应为 、
、 ,则样品中CuCl的纯度为
,则样品中CuCl的纯度为______  保留三位有效数字
保留三位有效数字 。
。
 含
含 、
、 、
、 、
、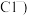 生产CuCl的流程:
生产CuCl的流程:
已知:CuCl是一种白色粉末,微溶于水、不溶于乙醇及稀硫酸,在空气中迅速被氧化为绿色,见光分解变成褐色。
请回答下列问题:
(1)流程中的滤渣①与Y反应和X与Y反应相比,单位时间内得到的气体多,其原因为
(2)滤液②需要加过量Z,检验Z过量的方法是
(3)写出生成CuCl的离子方程式:
(4)为了提高CuCl产品的纯度,流程中的“过滤”操作适宜用下列装置
 图
图 中的
中的 填选项字母
填选项字母 ,过滤后,洗涤CuCl的试剂宜选用
,过滤后,洗涤CuCl的试剂宜选用 填“无水乙醇”或“稀硫酸”
填“无水乙醇”或“稀硫酸”

 加入饱和NaCl溶液中会部分溶解生成
加入饱和NaCl溶液中会部分溶解生成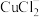 ,在一定温度下建立两个平衡:
,在一定温度下建立两个平衡:I.CuCl
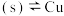
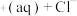
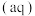
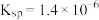
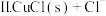
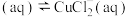
 。
。(5)分析
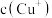 、
、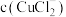 和
和 、K的数学关系,在图2中画出
、K的数学关系,在图2中画出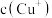 、
、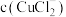 的关系曲线
的关系曲线
(6)氯化亚铜的定量分析:
①称取样品
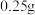 于250mL锥形瓶中,加入10mL过量的
于250mL锥形瓶中,加入10mL过量的 溶液,不断摇动:
溶液,不断摇动:②待样品溶解后,加入20mL蒸馏水和2滴指示剂;
③立即用
 硫酸铈标准溶液滴定至绿色为终点;
硫酸铈标准溶液滴定至绿色为终点;④重复三次,消耗硫酸铈溶液的平均体积为
 。
。上述相应化学反应为
 、
、 ,则样品中CuCl的纯度为
,则样品中CuCl的纯度为 保留三位有效数字
保留三位有效数字 。
。
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐3】某化学研究性学习小组设想探究铜的常见化学性质,过程设计如下:
[提出猜想]
问题1:在周期表中,铜与铝的位置很接近,铜不如铝活泼,氢氧化铝具有两性,氢氧化铜有两性吗?
问题2:铁和铜都有变价,一般情况下,正二价铁的稳定性小于正三价的铁,正一价的铜稳定性也小于正二价的铜吗?
问题3:氧化铜有氧化性,能被H2、CO还原,它能被氮的某种气态氢化物还原吗?
[实验探究]
Ⅰ.解决问题1:
(1)需用到的药品除铜、铝、1mol/LCuSO4溶液、稀H2SO4外还需___________ (填试剂化学式);
(2)配制1 mol/LCuSO4溶液25mL,选用的仪器除烧杯、天平、玻璃棒、量筒、胶头滴管外,还有_________________ (填仪器名称);
(3)为达到目的,你认为应进行哪些相关实验?(实验内容和步骤)
①制备Cu(OH)2; ②_______________________________________________________
Ⅱ.解决问题2的实验步骤和现象如下:取一定量制得的氢氧化铜周体,于坩埚中灼烧,当温度达到80~100℃得到黑色同体粉末;继续加热至1000℃以上,黑色粉末全部变成红色粉末氧化亚铜;取适量红色氧化亚铜粉末于洁净试管中,加入过量的稀硫酸或盐酸,得到蓝色溶液,同时观察到试管底还有红色固体存在。根据以上实验及现象:
(4)写出氧化亚铜与稀硫酸(或盐酸)反应的离子方程式:_________________________________ ;
(5)从实验Ⅱ可得出的结论是__________________________________________________________ 。
Ⅲ.解决问题3:
设计如下装置:(夹持装置未画出)
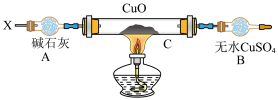
当某种氮的气态氢化物(X)缓缓通过灼热的氧化铜,观察到氧化铜由黑色变成了红色,无水硫酸铜变成蓝色,生成物中还有一种无污染的气体Y;将X通入红热的CuO燃烧管完全反应后,消耗0.01 mol X,测得B装置增重0.36 g,并收集到单质气体Y0.28 g;
(6)研究小组同学确证燃烧管生成的红色物质是铜,你认为他们确证的方法是________________ ;
(7)X气体的摩尔质量为_____________ ;
(8)C中发生反应的化学方程式:______________________________________________________ 。
[提出猜想]
问题1:在周期表中,铜与铝的位置很接近,铜不如铝活泼,氢氧化铝具有两性,氢氧化铜有两性吗?
问题2:铁和铜都有变价,一般情况下,正二价铁的稳定性小于正三价的铁,正一价的铜稳定性也小于正二价的铜吗?
问题3:氧化铜有氧化性,能被H2、CO还原,它能被氮的某种气态氢化物还原吗?
[实验探究]
Ⅰ.解决问题1:
(1)需用到的药品除铜、铝、1mol/LCuSO4溶液、稀H2SO4外还需
(2)配制1 mol/LCuSO4溶液25mL,选用的仪器除烧杯、天平、玻璃棒、量筒、胶头滴管外,还有
(3)为达到目的,你认为应进行哪些相关实验?(实验内容和步骤)
①制备Cu(OH)2; ②
Ⅱ.解决问题2的实验步骤和现象如下:取一定量制得的氢氧化铜周体,于坩埚中灼烧,当温度达到80~100℃得到黑色同体粉末;继续加热至1000℃以上,黑色粉末全部变成红色粉末氧化亚铜;取适量红色氧化亚铜粉末于洁净试管中,加入过量的稀硫酸或盐酸,得到蓝色溶液,同时观察到试管底还有红色固体存在。根据以上实验及现象:
(4)写出氧化亚铜与稀硫酸(或盐酸)反应的离子方程式:
(5)从实验Ⅱ可得出的结论是
Ⅲ.解决问题3:
设计如下装置:(夹持装置未画出)

当某种氮的气态氢化物(X)缓缓通过灼热的氧化铜,观察到氧化铜由黑色变成了红色,无水硫酸铜变成蓝色,生成物中还有一种无污染的气体Y;将X通入红热的CuO燃烧管完全反应后,消耗0.01 mol X,测得B装置增重0.36 g,并收集到单质气体Y0.28 g;
(6)研究小组同学确证燃烧管生成的红色物质是铜,你认为他们确证的方法是
(7)X气体的摩尔质量为
(8)C中发生反应的化学方程式:
您最近一年使用:0次
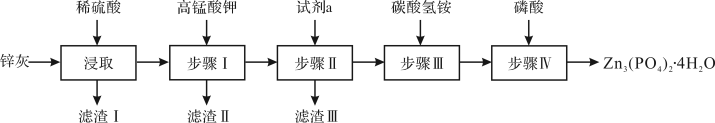
【推荐1】四水合磷酸锌[Zn3(PO4)2·4H2O,摩尔质量为457 g·mol-1,难溶于水] 是一种性能优良的绿色环保防锈颜料。实验室以锌灰(含ZnO、PbO、CuO、FeO、Fe2O3、SiO2等)为原料制备Zn3(PO4)2·4H2O的流程如下,回答下列问题:
已知:6NH4HCO3 + 3ZnSO4 ZnCO3·2Zn(OH)2·H2O↓ + 3(NH4)2SO4 + 5CO2↑
ZnCO3·2Zn(OH)2·H2O↓ + 3(NH4)2SO4 + 5CO2↑
ZnCO3·2Zn(OH)2·H2O + 2H3PO4 Zn3(PO4)2·4H2O + 2H2O + CO2↑
Zn3(PO4)2·4H2O + 2H2O + CO2↑
(1)滤渣Ⅰ的主要成分为________ ;步骤Ⅰ中,需先将溶液的pH调至5.1,此时应选择的最佳试剂是________ ;
a.氨水 b.氢氧化钠 c.氧化锌 d.氢氧化钡
滴加KMnO4溶液后有MnO2生成,该反应的离子方程式为________ ;试剂a为________ ;步骤Ⅳ反应结束后,得到Zn3(PO4)2·4H2O的操作包括________ 和干燥。
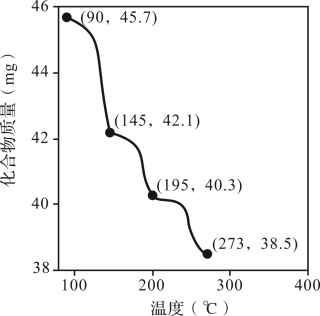
(2)称取45.7 mg Zn3(PO4)2·4H2O进行热重分析,化合物质量随温度的变化关系如图所示,为获得Zn3(PO4)2·2H2O和Zn3(PO4)2·H2O的混合产品,烘干时的温度范围为________ 。
a.90~145℃ b.145~195℃ c.195~273℃ d.>273℃
(3)为测定产品中Zn3(PO4)2·4H2O的含量,进行如下实验,已知滴定过程中Zn2+与H2Y2−按1:1反应。
步骤Ⅰ:准确称取0.4570 g产品于烧杯中,加入适量盐酸使其溶解,将溶液转移至100 mL容量瓶,定容。
步骤Ⅱ:移取20.00 mL上述溶液于锥形瓶中,加入指示剂,在pH = 5~6的缓冲溶液中用0.02000mol·L-1 Na2H2Y标准溶液滴定至终点,测得Na2H2Y标准溶液的用量为27.60 mL。
步骤Ⅱ中移取溶液时所使用的玻璃仪器为________ ;产品中Zn3(PO4)2·4H2O的质量分数为_______ 。下列操作中,导致产品中Zn3(PO4)2·4H2O含量测定值偏低的是________ 。
a.步骤I中定容时俯视刻度线
b.步骤I中转移溶液时未洗涤烧杯
c.步骤II中滴定管未用Na2H2Y标准溶液润洗
d.步骤II中滴定前滴定管内无气泡,滴定结束后有气泡
已知:6NH4HCO3 + 3ZnSO4
 ZnCO3·2Zn(OH)2·H2O↓ + 3(NH4)2SO4 + 5CO2↑
ZnCO3·2Zn(OH)2·H2O↓ + 3(NH4)2SO4 + 5CO2↑ZnCO3·2Zn(OH)2·H2O + 2H3PO4
 Zn3(PO4)2·4H2O + 2H2O + CO2↑
Zn3(PO4)2·4H2O + 2H2O + CO2↑(1)滤渣Ⅰ的主要成分为
a.氨水 b.氢氧化钠 c.氧化锌 d.氢氧化钡
滴加KMnO4溶液后有MnO2生成,该反应的离子方程式为
(2)称取45.7 mg Zn3(PO4)2·4H2O进行热重分析,化合物质量随温度的变化关系如图所示,为获得Zn3(PO4)2·2H2O和Zn3(PO4)2·H2O的混合产品,烘干时的温度范围为
a.90~145℃ b.145~195℃ c.195~273℃ d.>273℃

(3)为测定产品中Zn3(PO4)2·4H2O的含量,进行如下实验,已知滴定过程中Zn2+与H2Y2−按1:1反应。
步骤Ⅰ:准确称取0.4570 g产品于烧杯中,加入适量盐酸使其溶解,将溶液转移至100 mL容量瓶,定容。
步骤Ⅱ:移取20.00 mL上述溶液于锥形瓶中,加入指示剂,在pH = 5~6的缓冲溶液中用0.02000mol·L-1 Na2H2Y标准溶液滴定至终点,测得Na2H2Y标准溶液的用量为27.60 mL。
步骤Ⅱ中移取溶液时所使用的玻璃仪器为
a.步骤I中定容时俯视刻度线
b.步骤I中转移溶液时未洗涤烧杯
c.步骤II中滴定管未用Na2H2Y标准溶液润洗
d.步骤II中滴定前滴定管内无气泡,滴定结束后有气泡
您最近一年使用:0次
【推荐2】Ⅰ.高效净水剂聚合氯化铝铁(PAFC)的组成可表示为[AlFe(OH)nCl6﹣n]m,该物质广泛应用于日常生活用水和工业废水的处理。该物质可溶于盐酸产生相应的金属阳离子。为检测PAFC中铝和铁元素的含量,采用如图所示流程进行:

回答下列问题:
⑴PAFC中铁元素的化合价为_____ ,如何检验该元素的存在___________________
⑵步骤I中的试剂A是_______________ (从“氢氧化钠溶液”、“氨水”中选择)步骤Ⅲ中的试剂B是_____________ ,离子方程式是__________
⑶步骤Ⅱ的操作是______________________
Ⅱ. ⑴甲同学用氢氧化钠溶液和氯化亚铁溶液制备氢氧化亚铁沉淀,该同学将氢氧化钠溶液加入氯化亚铁溶液中,观察到的现象是____________ ,反应过程中发生反应的化学方程式是_________ 。乙同学通过如下改进制备氢氧化亚铁:

实验提供的试剂:铁屑、3mol/L硫酸溶液、NaOH溶液。请回答下列问题:
⑵①分液漏斗中盛装的试剂是______________ 溶液 (从“H2SO4”和“NaOH”中选择)。
②实验开始时应将止水夹E___________ (从“打开”和“关闭”中选择)。

回答下列问题:
⑴PAFC中铁元素的化合价为
⑵步骤I中的试剂A是
⑶步骤Ⅱ的操作是
Ⅱ. ⑴甲同学用氢氧化钠溶液和氯化亚铁溶液制备氢氧化亚铁沉淀,该同学将氢氧化钠溶液加入氯化亚铁溶液中,观察到的现象是

实验提供的试剂:铁屑、3mol/L硫酸溶液、NaOH溶液。请回答下列问题:
⑵①分液漏斗中盛装的试剂是
②实验开始时应将止水夹E
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
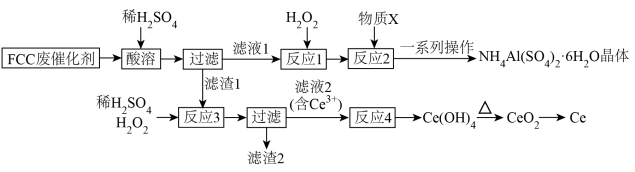
【推荐3】催化裂化(FCC)是石油精炼中最重要的转化之一。FCC催化剂中含有多种金属元素,一种针对FCC废催化剂(含较多的 、铁铝的氧化物和少量其他可溶于酸的物质,固载在玻璃纤维上)综合回收利用的工艺流程如下:
、铁铝的氧化物和少量其他可溶于酸的物质,固载在玻璃纤维上)综合回收利用的工艺流程如下:
已知:① 不溶于稀硫酸,也不溶于NaOH溶液;②常温下
不溶于稀硫酸,也不溶于NaOH溶液;②常温下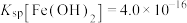 ,
,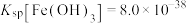 ,
,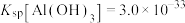 。
。 。
。
回答下列问题:
(1)已知基态Ce原子价层电子排布式为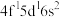 ,它有
,它有__________ 个未成对电子,它的最高正化合价为__________ 。
(2)物质X为__________ ,若利用pH传感器监测反应2,当
__________ 时, 已沉淀完全(
已沉淀完全(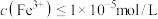 时视为沉淀完全)。
时视为沉淀完全)。
(3)反应3的化学反应方程式为______________________________ ,其中 的作用与反应1中的
的作用与反应1中的 作用
作用__________ (填“相同”或“不相同”)。
(4)从溶液中获得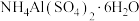 晶体的“一系列操作”包括
晶体的“一系列操作”包括__________ 、过滤、洗涤、常温晾干。 的空间构型为
的空间构型为__________ 。
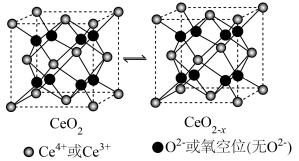
(5)氧化铈( )是一种重要的光催化材料,光催化过程中立方晶胞的组成变化如图所示,则每个
)是一种重要的光催化材料,光催化过程中立方晶胞的组成变化如图所示,则每个 晶胞中
晶胞中 个数为
个数为__________ 。
 、铁铝的氧化物和少量其他可溶于酸的物质,固载在玻璃纤维上)综合回收利用的工艺流程如下:
、铁铝的氧化物和少量其他可溶于酸的物质,固载在玻璃纤维上)综合回收利用的工艺流程如下:
已知:①
 不溶于稀硫酸,也不溶于NaOH溶液;②常温下
不溶于稀硫酸,也不溶于NaOH溶液;②常温下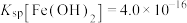 ,
,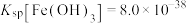 ,
,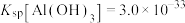 。
。 。
。回答下列问题:
(1)已知基态Ce原子价层电子排布式为
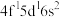 ,它有
,它有(2)物质X为

 已沉淀完全(
已沉淀完全(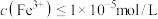 时视为沉淀完全)。
时视为沉淀完全)。(3)反应3的化学反应方程式为
 的作用与反应1中的
的作用与反应1中的 作用
作用(4)从溶液中获得
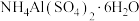 晶体的“一系列操作”包括
晶体的“一系列操作”包括 的空间构型为
的空间构型为(5)氧化铈(
 )是一种重要的光催化材料,光催化过程中立方晶胞的组成变化如图所示,则每个
)是一种重要的光催化材料,光催化过程中立方晶胞的组成变化如图所示,则每个 晶胞中
晶胞中 个数为
个数为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐1】三卤化硼是物质结构化学的研究热点,也是重要的化工原料。三氯化硼(BCl3)可用于制取乙硼烷(B2H6),也可作有机合成的催化剂。
查阅资料:①BCl3的沸点为12.5 ℃,熔点为-107.3 ℃;②2B+6HCl 2BCl3↑+3H2↑;③硼与铝的性质相似,也能与氢氧化钠溶液反应。
2BCl3↑+3H2↑;③硼与铝的性质相似,也能与氢氧化钠溶液反应。
设计实验:某同学设计如图所示装置利用氯气和单质硼反应制备三氯化硼:

请回答下列问题:
(1)硼在周期表的位置是__________________________ ;
(2)E装置的作用是___________________________ 。如果拆去B装置,可能的后果是______________________ 。
(3)实验中可以用一个盛装_____________ (填试剂名称)的干燥管代替F和G装置,使实验更简便。
(4)三氯化硼遇水剧烈反应生成硼酸(H3BO3)和白雾,写出该反应的化学方程式:______________ ;
(5)为了顺利完成实验,正确的操作是________ (填序号).
①先点燃A处酒精灯,后点燃D处酒精灯
②先点燃D处酒精灯,后点燃A处酒精灯
③同时点燃A、D处酒精灯
(6)请你补充完整下面的简易实验,以验证制得的产品中是否含有硼粉:取少量样品于试管中,滴加浓________ (填化学式)溶液,若有气泡产生,则样品中含有硼粉;若无气泡产生,则样品中无硼粉,写出硼粉与滴加试剂的化学方程式___________________________ 。
查阅资料:①BCl3的沸点为12.5 ℃,熔点为-107.3 ℃;②2B+6HCl
 2BCl3↑+3H2↑;③硼与铝的性质相似,也能与氢氧化钠溶液反应。
2BCl3↑+3H2↑;③硼与铝的性质相似,也能与氢氧化钠溶液反应。设计实验:某同学设计如图所示装置利用氯气和单质硼反应制备三氯化硼:

请回答下列问题:
(1)硼在周期表的位置是
(2)E装置的作用是
(3)实验中可以用一个盛装
(4)三氯化硼遇水剧烈反应生成硼酸(H3BO3)和白雾,写出该反应的化学方程式:
(5)为了顺利完成实验,正确的操作是
①先点燃A处酒精灯,后点燃D处酒精灯
②先点燃D处酒精灯,后点燃A处酒精灯
③同时点燃A、D处酒精灯
(6)请你补充完整下面的简易实验,以验证制得的产品中是否含有硼粉:取少量样品于试管中,滴加浓
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐2】铁黄是一种重要的颜料,化学式为Fe2O3·xH2O,广泛用于涂料、橡胶、塑料、文教用品等工业。实验室模拟工业利用硫酸渣(含Fe2O3及少量的CaO、MgO等)和黄铁矿粉(主要成分为FeS2)制备铁黄的流程如下:
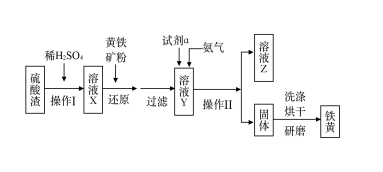
(1)操作Ⅰ与操作Ⅱ中都用到玻璃棒,玻璃棒在两种操作中的作用分别是______________ 、________________ 。
(2)试剂a最好选用__________________ (供选择使用的有:铝粉、空气、浓HNO3);
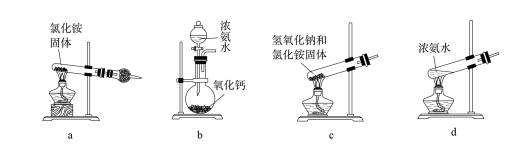
(3)上述步骤中需用到氨气。下列装置可用于实验室制氨气的是_____ (填序号)。
(4)查阅资料知,在不同温度下Fe2O3被CO还原,产物可能为Fe3O4、FeO或Fe,固体质量与反应温度的关系如下图所示。
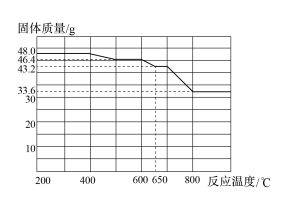
根据图像推断670℃时Fe2O3还原产物的化学式为_________ ,并设计一个简单的实验,证明该还原产物的成分(简述实验操作、现象和结论)_____________________________
仪器自选。可供选择的试剂:稀硫酸、稀盐酸、H2O2溶液、NaOH溶液、KSCN溶液。

(1)操作Ⅰ与操作Ⅱ中都用到玻璃棒,玻璃棒在两种操作中的作用分别是
(2)试剂a最好选用
(3)上述步骤中需用到氨气。下列装置可用于实验室制氨气的是

(4)查阅资料知,在不同温度下Fe2O3被CO还原,产物可能为Fe3O4、FeO或Fe,固体质量与反应温度的关系如下图所示。

根据图像推断670℃时Fe2O3还原产物的化学式为
仪器自选。可供选择的试剂:稀硫酸、稀盐酸、H2O2溶液、NaOH溶液、KSCN溶液。
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐3】I.工业生产硝酸的尾气中含有氮氧化物 (假设仅为NO和
(假设仅为NO和 的混合物),影响生态环境。
的混合物),影响生态环境。
(1)氮氧化物 对环境主要影响有两点
对环境主要影响有两点_______ 、_______ 。
II.工业上可用氨催化吸收法处理 ,反应原理为:
,反应原理为: (未配平),某化学兴趣小组模拟该处理过程的实验装置如图:
(未配平),某化学兴趣小组模拟该处理过程的实验装置如图:
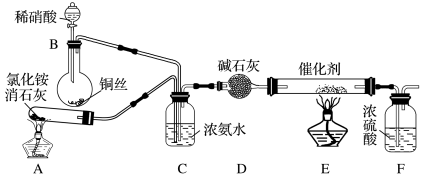
(2)装置B中发生反应的离子方程式为_______ 。
(3)装置C的作用有两个:一个作用是通过气泡产生的速率来控制反应物的比例,另一个作用是_______ 。
(4)反应 可用于处理
可用于处理 。当转移3.6mol电子时,消耗
。当转移3.6mol电子时,消耗 的物质的量为
的物质的量为_______ 。
III.工业上也常用NaOH溶液吸收法处理 ,发生的反应为:
,发生的反应为:


(5)将2240mL(标准状况)NO和 的混合气体溶于200mLNaOH溶液中,恰好完全反应,并无气体放出,则NaOH溶液物质的量浓度是
的混合气体溶于200mLNaOH溶液中,恰好完全反应,并无气体放出,则NaOH溶液物质的量浓度是 _______ 。
 (假设仅为NO和
(假设仅为NO和 的混合物),影响生态环境。
的混合物),影响生态环境。(1)氮氧化物
 对环境主要影响有两点
对环境主要影响有两点II.工业上可用氨催化吸收法处理
 ,反应原理为:
,反应原理为: (未配平),某化学兴趣小组模拟该处理过程的实验装置如图:
(未配平),某化学兴趣小组模拟该处理过程的实验装置如图:
(2)装置B中发生反应的离子方程式为
(3)装置C的作用有两个:一个作用是通过气泡产生的速率来控制反应物的比例,另一个作用是
(4)反应
 可用于处理
可用于处理 。当转移3.6mol电子时,消耗
。当转移3.6mol电子时,消耗 的物质的量为
的物质的量为III.工业上也常用NaOH溶液吸收法处理
 ,发生的反应为:
,发生的反应为:

(5)将2240mL(标准状况)NO和
 的混合气体溶于200mLNaOH溶液中,恰好完全反应,并无气体放出,则NaOH溶液物质的量浓度是
的混合气体溶于200mLNaOH溶液中,恰好完全反应,并无气体放出,则NaOH溶液物质的量浓度是
您最近一年使用:0次



