Bi2O3常用作可见光催化剂,NaBiO3是一种强氧化剂。以辉铋矿(主要成分是Bi2S3,含少量的Bi2O3、SiO2和铁的氧化物)为原料制备Bi2O3和NaBiO3的流程如下:
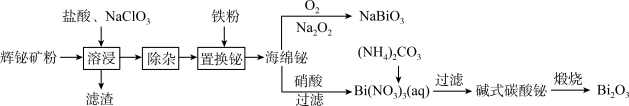
已知:①Bi2O3能溶于酸;②碱式碳酸铋的化学组成:(BiO)2CO3;③Bi2S3+6HCl+NaClO3=2BiCl3+3S+NaCl+3H2O。
Ⅰ.请回答下列问题:
(1)滤渣的成分有_______ (填化学式,下同);“溶浸”时可能产生一种有毒气体单质,它是_______ 。
(2)“溶浸”时浸出速率与温度的关系如图所示。
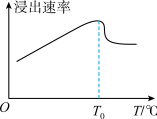
温度高于T0℃时,浸出速率突然减小的原因是_______ 。
(3)若将“置换铋”的反应设计成原电池,则负极反应式为_______ 。
(4)写出“煅烧”中反应的化学方程式:_______ 。
(5)实验室常用下列方法鉴别Mn2+:在硫酸酸化的MnSO4溶液中加入NaBiO3粉末(难溶于水),溶液变成紫红色,还原产物为Bi3+,该反应的离子方程式为_______ 。
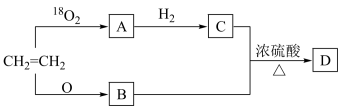
Ⅱ.石油是重要的化工原料,被称为“工业的血液”。下图中A的产量被用作衡量一个国家石油化工产业发展水平的标志。回答下列问题:

(6)过程②这种获得有机化工原料的方法在工业上叫做_______ ,物质D中含有的官能团名称为_______ ,过程③发生的反应类型是_______ 。
(7)石油气的成分中含有一种电子总数为42的烷烃,该烷烃共有_______ 种同分异构体,其中一氯代物共有4种的名称是_______ 。
(8)以淀粉为原料经水解生成葡萄糖,葡萄糖在酒化酶的作用下可分解生成B,写出生成B的化学方程式_______ 。实验室实现过程④反应的化学方程式为_______ 。
(9)实验室常用下列装置实现过程⑥发生的化学反应。

①实验时,先在大试管中加入B、浓硫酸、D的混合物,再加入_______ 。
②反应结束后,将收集到的产品倒入分液漏斗中振荡、静置、分液,_______ 从分液漏斗上口倒出。
③相对于a装置,用b装置进行制备的缺点有_______ (答一条即可)。

已知:①Bi2O3能溶于酸;②碱式碳酸铋的化学组成:(BiO)2CO3;③Bi2S3+6HCl+NaClO3=2BiCl3+3S+NaCl+3H2O。
Ⅰ.请回答下列问题:
(1)滤渣的成分有
(2)“溶浸”时浸出速率与温度的关系如图所示。

温度高于T0℃时,浸出速率突然减小的原因是
(3)若将“置换铋”的反应设计成原电池,则负极反应式为
(4)写出“煅烧”中反应的化学方程式:
(5)实验室常用下列方法鉴别Mn2+:在硫酸酸化的MnSO4溶液中加入NaBiO3粉末(难溶于水),溶液变成紫红色,还原产物为Bi3+,该反应的离子方程式为
Ⅱ.石油是重要的化工原料,被称为“工业的血液”。下图中A的产量被用作衡量一个国家石油化工产业发展水平的标志。回答下列问题:

(6)过程②这种获得有机化工原料的方法在工业上叫做
(7)石油气的成分中含有一种电子总数为42的烷烃,该烷烃共有
(8)以淀粉为原料经水解生成葡萄糖,葡萄糖在酒化酶的作用下可分解生成B,写出生成B的化学方程式
(9)实验室常用下列装置实现过程⑥发生的化学反应。

①实验时,先在大试管中加入B、浓硫酸、D的混合物,再加入
②反应结束后,将收集到的产品倒入分液漏斗中振荡、静置、分液,
③相对于a装置,用b装置进行制备的缺点有
2023高三·全国·专题练习 查看更多[2]
更新时间:2023-12-15 19:22:21
|
相似题推荐
【推荐1】冶金厂的炉渣中主要成分为CuO、Cu、Ag、Bi、Pb,还含有少量的SiO2和Au,从炉渣中回收有价金属的一种工艺流程如图所示。

回答下列问题:
(1)氧化浸取时加入H2O2的目的是__________________________ (只要回答出一点即可)。
(2)熔炼时加入Na2CO3的目的是除硅,该过程的化学方程式是_____________________________ 。
(3)加入NaOH溶液的目的是调节溶液的pH ,水解时通入水蒸气的目的是_______________________ 。
(4)流程中加入N2H4·H2O还原得到银的化学方程式是_____________________________ 。
(5)沉银和铅时,已知Ksp(AgCl)=1.8×10-10,Ksp(PbCl2)=1.8×10-5,当AgCl和PbCl2共沉且c(Pb2+)∶c(Ag+)=107时,溶液中的c(Cl-)=________ mol·L-1。
(6)用流程中得到的铅制取Pb(NO3)2。 用石墨作电极,电解Pb(NO3)2和Cu( NO3)2的混合溶液制取PbO2,阳极发生的电极反应式是_______________________ ,若电解液中不加入Cu( NO3)2,阴极反应式是______________________ ,这样做的主要缺点是____________________________________ 。

回答下列问题:
(1)氧化浸取时加入H2O2的目的是
(2)熔炼时加入Na2CO3的目的是除硅,该过程的化学方程式是
(3)加入NaOH溶液的目的是调节溶液的pH ,水解时通入水蒸气的目的是
(4)流程中加入N2H4·H2O还原得到银的化学方程式是
(5)沉银和铅时,已知Ksp(AgCl)=1.8×10-10,Ksp(PbCl2)=1.8×10-5,当AgCl和PbCl2共沉且c(Pb2+)∶c(Ag+)=107时,溶液中的c(Cl-)=
(6)用流程中得到的铅制取Pb(NO3)2。 用石墨作电极,电解Pb(NO3)2和Cu( NO3)2的混合溶液制取PbO2,阳极发生的电极反应式是
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐2】溴及其化合物应用广泛,以下两种方法均可从海水中提取溴。
(1)吹出法(主要流程如下):
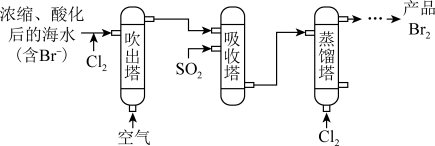
①海水中的Br-经氧化、吹出、吸收后可实现_______ 目的。
②补全吸收塔中反应的化学方程式:_______ 口Br2+口 _______+口_______=口_______+口HBr
③蒸馏塔中控制温度不超过100° C,原因是_______ 。
④已知海水中溴的浓度是64 mg·L-1,经该方法处理后1 m3海水最终得到38.4g Br2,则溴的总提取率为_______ 。
(2)聚四氟乙烯气态膜法(基本原理如图所示):

①经处理后的含Br2海水透过膜孔与NaOH吸收液发生反应,离子方程式是_______ 。得到富集液后再加酸、精馏可得Br2。
②聚四氟乙烯气态膜法与吹出法相比,优点是_______ (写出一条即可)。
(1)吹出法(主要流程如下):

①海水中的Br-经氧化、吹出、吸收后可实现
②补全吸收塔中反应的化学方程式:
③蒸馏塔中控制温度不超过100° C,原因是
④已知海水中溴的浓度是64 mg·L-1,经该方法处理后1 m3海水最终得到38.4g Br2,则溴的总提取率为
(2)聚四氟乙烯气态膜法(基本原理如图所示):

①经处理后的含Br2海水透过膜孔与NaOH吸收液发生反应,离子方程式是
②聚四氟乙烯气态膜法与吹出法相比,优点是
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
解题方法
【推荐3】A、B、D、E、X是原子序数依次增大的五种短周期元素。A是周期表中相对原子质量最小的元素,A、B能形成两种液态化合物 和
和 。D是短周期中原子半径最大的主族元素,E的周期序数和族序数相等,D、X的原子最外层电子数之和为8。回答下列问题:(用化学用语填空)
。D是短周期中原子半径最大的主族元素,E的周期序数和族序数相等,D、X的原子最外层电子数之和为8。回答下列问题:(用化学用语填空)
(1) 的电子式为
的电子式为__________ ;离子半径D__________ B(填“>”或“<”)。
(2)如图所示,将少量X单质的水溶液分别滴入盛有不同试剂的试管中。

管a中发生反应的化学方程式为__________ ,该反应可用于制备漂白液。
②试管b中的实验现象为__________ ,说明X的非金属性强于碘元素,从原子结构的角度解释其原因是__________ 。
(3)镓 与E为同主族元素,氮化镓
与E为同主族元素,氮化镓 作为第三代半导体材料,具有耐高温、耐高电压等特性。下列相关说法中,正确的是
作为第三代半导体材料,具有耐高温、耐高电压等特性。下列相关说法中,正确的是__________ (填字母序号)。
a. 位于元素周期表的第四周期
位于元素周期表的第四周期
b. 中
中 的化合价为
的化合价为
c. 的离子半径小于
的离子半径小于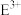 的离子半径
的离子半径
(4)工业上用 处理中性废水中的
处理中性废水中的 ,使其转化为
,使其转化为 沉淀除去,X被还原至最低价,该反应的离子方程式为
沉淀除去,X被还原至最低价,该反应的离子方程式为__________ 。
 和
和 。D是短周期中原子半径最大的主族元素,E的周期序数和族序数相等,D、X的原子最外层电子数之和为8。回答下列问题:(用化学用语填空)
。D是短周期中原子半径最大的主族元素,E的周期序数和族序数相等,D、X的原子最外层电子数之和为8。回答下列问题:(用化学用语填空) (1)
 的电子式为
的电子式为(2)如图所示,将少量X单质的水溶液分别滴入盛有不同试剂的试管中。

管a中发生反应的化学方程式为
②试管b中的实验现象为
(3)镓
 与E为同主族元素,氮化镓
与E为同主族元素,氮化镓 作为第三代半导体材料,具有耐高温、耐高电压等特性。下列相关说法中,正确的是
作为第三代半导体材料,具有耐高温、耐高电压等特性。下列相关说法中,正确的是a.
 位于元素周期表的第四周期
位于元素周期表的第四周期b.
 中
中 的化合价为
的化合价为
c.
 的离子半径小于
的离子半径小于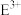 的离子半径
的离子半径(4)工业上用
 处理中性废水中的
处理中性废水中的 ,使其转化为
,使其转化为 沉淀除去,X被还原至最低价,该反应的离子方程式为
沉淀除去,X被还原至最低价,该反应的离子方程式为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐1】I.二甲醚(DME)被誉为“21世纪的清洁燃料”。由合成气制备二甲醚的主要原理如下:
①CO(g)+2H2(g)⇌CH3OH(g) ∆H1=-90.7 kJ·mol-1
②2CH3OH(g)⇌CH3OCH3(g)+H2O(g) ∆H2=-23.5 kJ·mol-1
③CO(g)+H2O(g)⇌CO2(g)+H2(g) ∆H3=-41.2kJ·mol-1
回答下列问题:
(1)则反应3H2(g)+3CO(g)⇌CH3OCH3(g)+CO2(g)的∆H=_______ kJ·mol-1。
(2)二甲醚燃料电池的工作原理如图所示:
该电池负极的电极反应式为_______ 。
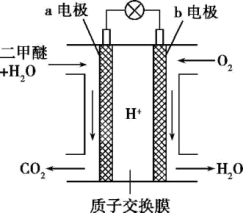
II .某研究小组用NaOH溶液吸收二氧化硫后,将得到的Na2SO3溶液进行电解,其中阴阳膜组合电解装置如图所示,电极材料为石墨。
①a表示_______ (填“阴”或“阳”)膜。A-E分别代表原料或产品,其中C为稀硫酸,E为氢气,则A为_______ 溶液(填写化学式)。
②阳极电极反应式为_______ 。
III. 次磷酸钠(NaH2PO2)可用于化学镀镍,即通过化学反应在塑料镀件表面沉积镍-磷合金。化学镀镍的溶液中含有Ni2+和H2PO ,在酸性条件下发生以下镀镍反应:
,在酸性条件下发生以下镀镍反应:
Ni2++_______H2PO +_______=_______Ni+_______H2PO
+_______=_______Ni+_______H2PO +_______
+_______
①请配平上述方程式________ 。
②反应中,若生成1mol H2PO ,反应中转移电子的数目为
,反应中转移电子的数目为_______ 。
①CO(g)+2H2(g)⇌CH3OH(g) ∆H1=-90.7 kJ·mol-1
②2CH3OH(g)⇌CH3OCH3(g)+H2O(g) ∆H2=-23.5 kJ·mol-1
③CO(g)+H2O(g)⇌CO2(g)+H2(g) ∆H3=-41.2kJ·mol-1
回答下列问题:
(1)则反应3H2(g)+3CO(g)⇌CH3OCH3(g)+CO2(g)的∆H=
(2)二甲醚燃料电池的工作原理如图所示:

该电池负极的电极反应式为
II .某研究小组用NaOH溶液吸收二氧化硫后,将得到的Na2SO3溶液进行电解,其中阴阳膜组合电解装置如图所示,电极材料为石墨。

①a表示
②阳极电极反应式为
III. 次磷酸钠(NaH2PO2)可用于化学镀镍,即通过化学反应在塑料镀件表面沉积镍-磷合金。化学镀镍的溶液中含有Ni2+和H2PO
 ,在酸性条件下发生以下镀镍反应:
,在酸性条件下发生以下镀镍反应:Ni2++_______H2PO
 +_______=_______Ni+_______H2PO
+_______=_______Ni+_______H2PO +_______
+_______①请配平上述方程式
②反应中,若生成1mol H2PO
 ,反应中转移电子的数目为
,反应中转移电子的数目为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐2】工业燃烧煤、石油等化石燃料释放出大量氮氧化物(NOx)、CO2、SO2等气体,严重污染空气。对废气进行脱硝、脱碳和脱硫处理可实现绿色环保、废物利用。
Ⅰ.脱硝:
已知:H2的燃烧热为285.8kJ·mol-1;N2(g)+2O2(g)=2NO2(g) ΔH=+133kJ·mol-1 H2O(g)=H2O(l) ΔH=-44kJ·mol-1;催化剂存在下,H2还原NO2生成水蒸气和其他无毒物质的热化学方程式为:_______
Ⅱ.脱碳:
向2L密闭容器中加入2molCO2和6molH2,在适当的催化剂作用下发生反应:CO2(g)+3H2(g)⇌CH3OH(l)+H2O(l) ΔH<0
(1)下列叙述能说明此反应达到平衡状态的是_______
A.混合气体的平均相对分子质量保持不变
B.CO2和H2的体积分数保持不变
C.CO2和H2的转化率相等
D.混合气体的密度保持不变
E.1molCO2生成的同时有3molH-H键断裂
(2)改变温度,使反应CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g) ΔH<0中的所有物质都为气态。起始温度、体积相同(T1℃、2L密闭容器)。反应过程中部分数据见表:
达到平衡时,反应Ⅰ、Ⅱ对比:平衡常数K(Ⅰ)_______ K(Ⅱ)(填“﹥”“<”或“=”)。对反应Ⅰ,前10min内的平均反应速率v(CH3OH)=_______ 。
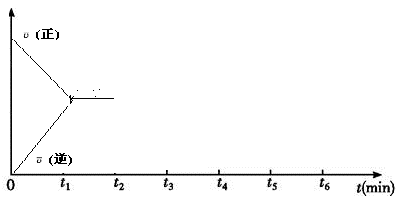
(3)该反应的速率随时间(0~t2)变化如图所示,在t2时将容器容积缩小一倍,t3时达到平衡,t4时降低温度,t5时达到平衡,请画出t2~t6反应速率随时间的变化曲线_____ 。
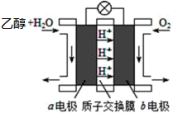
(4)如图是由“乙醇-空气”形成的绿色燃料电池的工作原理示意图,写出以石墨为电极的电池工作时负极的电极反应式_______
(5)根据有关图象,说法正确的是_______
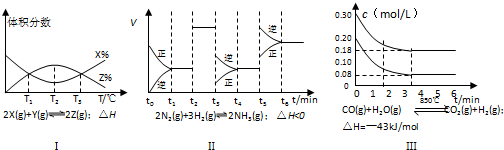
A.由图Ⅰ知,反应在T1、T3处达到平衡,且该反应的∆H<0
B.由图Ⅱ知,反应在t6时,NH3体积分数最大
C. 由图Ⅱ知,t3时采取降低反应温度的措施
D.Ⅲ在10L容器、850℃时反应,由图知,到4min时,反应放出51.6kJ的热量
Ⅰ.脱硝:
已知:H2的燃烧热为285.8kJ·mol-1;N2(g)+2O2(g)=2NO2(g) ΔH=+133kJ·mol-1 H2O(g)=H2O(l) ΔH=-44kJ·mol-1;催化剂存在下,H2还原NO2生成水蒸气和其他无毒物质的热化学方程式为:
Ⅱ.脱碳:
向2L密闭容器中加入2molCO2和6molH2,在适当的催化剂作用下发生反应:CO2(g)+3H2(g)⇌CH3OH(l)+H2O(l) ΔH<0
(1)下列叙述能说明此反应达到平衡状态的是
A.混合气体的平均相对分子质量保持不变
B.CO2和H2的体积分数保持不变
C.CO2和H2的转化率相等
D.混合气体的密度保持不变
E.1molCO2生成的同时有3molH-H键断裂
(2)改变温度,使反应CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g) ΔH<0中的所有物质都为气态。起始温度、体积相同(T1℃、2L密闭容器)。反应过程中部分数据见表:
| 反应条件 | 反应时间 | CO2(mol) | H2(mol) | CH3OH(mol) | H2O(mol) |
| 反应Ⅰ:恒温恒容 | 0min | 2 | 6 | 0 | 0 |
| 10min | 4.5 | ||||
| 20min | 1 | ||||
| 30min | 1 | ||||
| 反应Ⅱ:绝热恒容 | 0min | 0 | 0 | 2 | 2 |
(3)该反应的速率随时间(0~t2)变化如图所示,在t2时将容器容积缩小一倍,t3时达到平衡,t4时降低温度,t5时达到平衡,请画出t2~t6反应速率随时间的变化曲线

(4)如图是由“乙醇-空气”形成的绿色燃料电池的工作原理示意图,写出以石墨为电极的电池工作时负极的电极反应式

(5)根据有关图象,说法正确的是

A.由图Ⅰ知,反应在T1、T3处达到平衡,且该反应的∆H<0
B.由图Ⅱ知,反应在t6时,NH3体积分数最大
C. 由图Ⅱ知,t3时采取降低反应温度的措施
D.Ⅲ在10L容器、850℃时反应,由图知,到4min时,反应放出51.6kJ的热量
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐3】 转化利用对化解全球环境生态危机助力全球“碳达峰、碳中和”目标的实现具有重要意义。化学工作者致力于将
转化利用对化解全球环境生态危机助力全球“碳达峰、碳中和”目标的实现具有重要意义。化学工作者致力于将 转化为各种化工原料。
转化为各种化工原料。
Ⅰ.早在二十世纪初,工业上以 和
和 为原料在一定温度和压强下合成尿素。反应分两步:①
为原料在一定温度和压强下合成尿素。反应分两步:① 和
和 生成
生成 ;②
;② 分解生成尿素。
分解生成尿素。
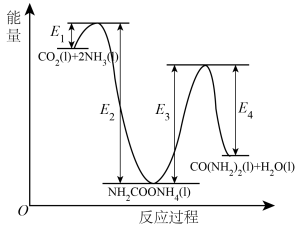
(1)活化能:反应①反应___________ ②(填“>”、“<”或“=”);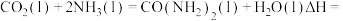
___________ (用含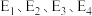 的式子表示)。
的式子表示)。
II.我国科学家研究 电池,取得了重大科研成果。
电池,取得了重大科研成果。 电池中,反应产物为
电池中,反应产物为 ;和单质碳,正极
;和单质碳,正极 电还原后与锂离子结合形成
电还原后与锂离子结合形成 按以下4个步骤进行:
按以下4个步骤进行:
①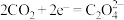 ;
;
②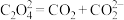 ;
;
③___________;
④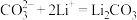
(2)写出步骤③中 与
与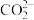 反应的离子方程式
反应的离子方程式___________ 。
III.利用 和重整技术可获得合成气(主要成分为
和重整技术可获得合成气(主要成分为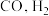 ),重整过程中反应的热化学方程式如下:
),重整过程中反应的热化学方程式如下:
反应i: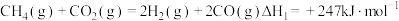
反应ii: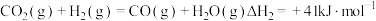
不同配比随温度变化对出口合成气中 的影响如下图所示
的影响如下图所示
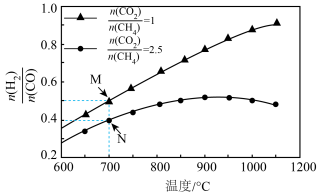
(3)对于反应 ,试比较
,试比较 点和
点和 点
点 的转化率:
的转化率:
___________  (填“>”、“<”或“=”下同);平衡常数
(填“>”、“<”或“=”下同);平衡常数
___________  ,当
,当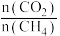 一定,有利于提高
一定,有利于提高 平衡转化率的反应条件是
平衡转化率的反应条件是___________ (填序号)。
A.高温高压 B.高温低压 C.低温高压 D.低温低压
(4)当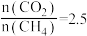 ,温度高于
,温度高于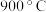 ,
, 减小的原因可能是
减小的原因可能是___________ 。
 转化利用对化解全球环境生态危机助力全球“碳达峰、碳中和”目标的实现具有重要意义。化学工作者致力于将
转化利用对化解全球环境生态危机助力全球“碳达峰、碳中和”目标的实现具有重要意义。化学工作者致力于将 转化为各种化工原料。
转化为各种化工原料。Ⅰ.早在二十世纪初,工业上以
 和
和 为原料在一定温度和压强下合成尿素。反应分两步:①
为原料在一定温度和压强下合成尿素。反应分两步:① 和
和 生成
生成 ;②
;② 分解生成尿素。
分解生成尿素。
(1)活化能:反应①反应
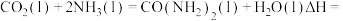
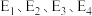 的式子表示)。
的式子表示)。II.我国科学家研究
 电池,取得了重大科研成果。
电池,取得了重大科研成果。 电池中,反应产物为
电池中,反应产物为 ;和单质碳,正极
;和单质碳,正极 电还原后与锂离子结合形成
电还原后与锂离子结合形成 按以下4个步骤进行:
按以下4个步骤进行:①
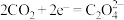 ;
;②
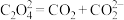 ;
;③___________;
④
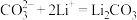
(2)写出步骤③中
 与
与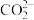 反应的离子方程式
反应的离子方程式III.利用
 和重整技术可获得合成气(主要成分为
和重整技术可获得合成气(主要成分为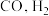 ),重整过程中反应的热化学方程式如下:
),重整过程中反应的热化学方程式如下:反应i:
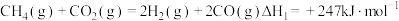
反应ii:
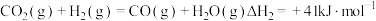
不同配比随温度变化对出口合成气中
 的影响如下图所示
的影响如下图所示
(3)对于反应
 ,试比较
,试比较 点和
点和 点
点 的转化率:
的转化率:
 (填“>”、“<”或“=”下同);平衡常数
(填“>”、“<”或“=”下同);平衡常数
 ,当
,当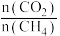 一定,有利于提高
一定,有利于提高 平衡转化率的反应条件是
平衡转化率的反应条件是A.高温高压 B.高温低压 C.低温高压 D.低温低压
(4)当
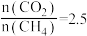 ,温度高于
,温度高于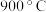 ,
, 减小的原因可能是
减小的原因可能是
您最近一年使用:0次
解答题-有机推断题
|
适中
(0.65)
解题方法
【推荐1】以淀粉为主要原料可以制得多种有机物,其合成路线如图所示:
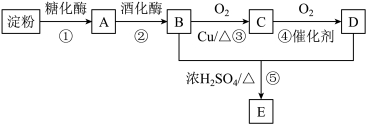
已知:A属于单糖,D能跟NaHCO3溶液反应产生CO2。
回答下列问题:
(1)A的分子式为_______ ,其中官能团的名称为_______ ;C的结构简式为_______ 。
(2)⑤的反应类型为_______ 。
(3)简述实验室中检验物质A的实验试剂、操作和现象_______ 。
(4)写出反应③的化学方程式:_______ 。
(5)与E具有相同官能团且互为同分异构体的有机物有3种,其中一种为HCOOCH2CH2CH3,另外两种物质的结构简式为_______ 。

已知:A属于单糖,D能跟NaHCO3溶液反应产生CO2。
回答下列问题:
(1)A的分子式为
(2)⑤的反应类型为
(3)简述实验室中检验物质A的实验试剂、操作和现象
(4)写出反应③的化学方程式:
(5)与E具有相同官能团且互为同分异构体的有机物有3种,其中一种为HCOOCH2CH2CH3,另外两种物质的结构简式为
您最近一年使用:0次
解答题-有机推断题
|
适中
(0.65)
解题方法
【推荐2】已知:有机物A的产量可以用来衡量一个国家的石油化工发展水平。现以A为主要原料合成乙酸乙酯,其合成路线如图所示。
(1)D中官能团的名称是______ ;反应①的反应类型是______ 反应。
(2)反应④的化学方程式是_________________________________________ 。
(3)某同学用如图所示的实验装置制取少量乙酸乙酯。实验结束后,试管甲中上层为透明的、不溶于水的油状液体,下层为饱和碳酸钠溶液。
①实验开始时,试管甲中的导管不伸入液面下的原因是______________ 。
②上述实验中饱和碳酸钠溶液的作用是(填字母)_______ 。
A.中和乙酸并吸收部分乙醇
B.乙酸乙酯在饱和碳酸钠溶液中的溶解度比在水中更小,有利于分层析出
C.加速酯的生成,提高其产率

(1)D中官能团的名称是
(2)反应④的化学方程式是
(3)某同学用如图所示的实验装置制取少量乙酸乙酯。实验结束后,试管甲中上层为透明的、不溶于水的油状液体,下层为饱和碳酸钠溶液。
①实验开始时,试管甲中的导管不伸入液面下的原因是
②上述实验中饱和碳酸钠溶液的作用是(填字母)
A.中和乙酸并吸收部分乙醇
B.乙酸乙酯在饱和碳酸钠溶液中的溶解度比在水中更小,有利于分层析出
C.加速酯的生成,提高其产率
您最近一年使用:0次
解答题-有机推断题
|
适中
(0.65)
名校
解题方法
【推荐3】普罗帕酮为广谱高效膜抑制性抗心律失常药。化合物I是合成普罗帕酮的前驱体,其合成路线如下:

已知:CH3COCH3+CH3CHO CH3COCH=CHCH3+H2O
CH3COCH=CHCH3+H2O
回答下列问题:
(1)H的分子式为_______ ;化合物E中含氧官能团的名称是_______ 。
(2)由G生成H的反应类型是______________ 。
(3)F的结构简式为________________________ 。
(4)B与银氨溶液反应的化学方程式为_________ 。
(5)由D生成E的化学方程式为__________ 。
(6)芳香族化合物M与E互为同分异构体,M可水解,且1 mol M最多可消耗2 mol NaOH,则M的结构共有______ 种;其中能发生银镜反应,且在核磁共振氢谱上显示4组峰,峰面积之比为3:2:2:1的M的结构简式为_________ 。

已知:CH3COCH3+CH3CHO
 CH3COCH=CHCH3+H2O
CH3COCH=CHCH3+H2O回答下列问题:
(1)H的分子式为
(2)由G生成H的反应类型是
(3)F的结构简式为
(4)B与银氨溶液反应的化学方程式为
(5)由D生成E的化学方程式为
(6)芳香族化合物M与E互为同分异构体,M可水解,且1 mol M最多可消耗2 mol NaOH,则M的结构共有
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
解题方法
【推荐1】乙烯是重要的有机化工原料,其产量是衡量国家石油化工水平发展的标志。以乙烯和淀粉为原料可以实现下列转化:
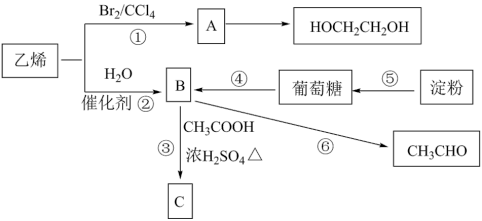
(1)乙烯的电子式________________ 。
(2)反应①的反应类型为_____________________ 。
(3)写出反应③的化学方程式:_____________________ 。
(4)写出反应④的化学方程式:_______________________________ 。
(5)上述物质中,能发生银镜反应的物质有__________________________ (写名称)。
(6)丙烯( )与乙烯具有相似的化学性质。
)与乙烯具有相似的化学性质。
①聚丙烯的结构简式为________________________ 。
②在一定条件下丙烯与H2O的加成产物可能为__________________________________ 。

(1)乙烯的电子式
(2)反应①的反应类型为
(3)写出反应③的化学方程式:
(4)写出反应④的化学方程式:
(5)上述物质中,能发生银镜反应的物质有
(6)丙烯(
 )与乙烯具有相似的化学性质。
)与乙烯具有相似的化学性质。①聚丙烯的结构简式为
②在一定条件下丙烯与H2O的加成产物可能为
您最近一年使用:0次
解答题-有机推断题
|
适中
(0.65)
解题方法
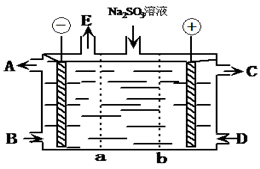
【推荐2】已知有机化合物A只含C、H两种元素且能使溴水褪色,A、B、C、D、E有如下关系:
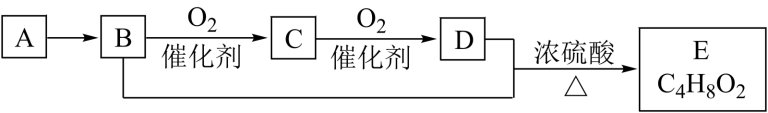
(1)化合物C的结构简式_______ ,化合物D中官能团的名称_______ 。
(2)化合物E的名称_______ ,写出与E同类的任意一种同分异构体的结构简式_______ 。
(3)B+D→E的反应属于_______ 反应。
(4)写出B→A的化学方程式_______ 。

(1)化合物C的结构简式
(2)化合物E的名称
(3)B+D→E的反应属于
(4)写出B→A的化学方程式
您最近一年使用:0次