近年来,废旧锂离子电池的回收成为目前新能源产业重要的发展方向。某锂离子二次电池的正极材料主要为 ,还含有少量Al、Fe、Mn、Ni的化合物。通过如图流程利用废旧锂离子电池制备草酸钴晶体(
,还含有少量Al、Fe、Mn、Ni的化合物。通过如图流程利用废旧锂离子电池制备草酸钴晶体(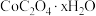 ):
):
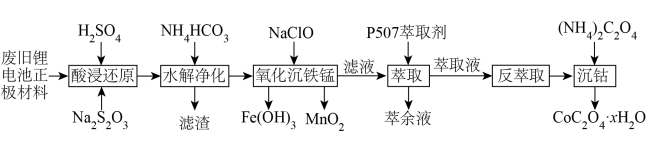
已知该工艺条件下,有关金属离子沉淀完全(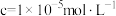 )的pH见表:
)的pH见表:
回答下列问题:
(1)“酸浸还原”时, 发生的反应中氧化产物为硫酸盐的化学方程式为
发生的反应中氧化产物为硫酸盐的化学方程式为_______ 。
(2)水解净化的“滤渣”成分_______ 。
(3)氧化过滤的目的是沉铁和沉锰,其操作为控制体系的pH在4~5,加入NaClO溶液。写出其中沉铁的离子方程式_______ ;实际生产中,随着反应时间的延长,锰和铁的沉淀率逐渐增大,但钴的损失量也随之增大,可能的原因为:_______ 。
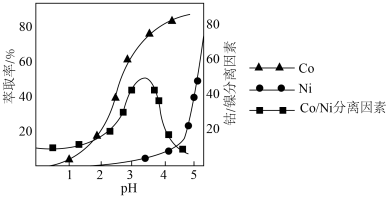
(4)利用“P507萃取剂”从“滤液”中分离 。萃取时,Co、Ni的浸出率和钴/镍分离因素与水相pH的如图所示。Co/Ni分离因素越大,表明萃取剂对Co/Ni分离效果越好。由图可知,萃取时的最佳水相pH为_______(填字母)。
。萃取时,Co、Ni的浸出率和钴/镍分离因素与水相pH的如图所示。Co/Ni分离因素越大,表明萃取剂对Co/Ni分离效果越好。由图可知,萃取时的最佳水相pH为_______(填字母)。
 ,还含有少量Al、Fe、Mn、Ni的化合物。通过如图流程利用废旧锂离子电池制备草酸钴晶体(
,还含有少量Al、Fe、Mn、Ni的化合物。通过如图流程利用废旧锂离子电池制备草酸钴晶体(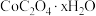 ):
):
已知该工艺条件下,有关金属离子沉淀完全(
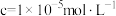 )的pH见表:
)的pH见表:| 离子 |  |  |  |  |  |  |
| pH | 9.3 | 3.2 | 9.0 | 4.7 | 10.1 | 8.9 |
(1)“酸浸还原”时,
 发生的反应中氧化产物为硫酸盐的化学方程式为
发生的反应中氧化产物为硫酸盐的化学方程式为(2)水解净化的“滤渣”成分
(3)氧化过滤的目的是沉铁和沉锰,其操作为控制体系的pH在4~5,加入NaClO溶液。写出其中沉铁的离子方程式
(4)利用“P507萃取剂”从“滤液”中分离
 。萃取时,Co、Ni的浸出率和钴/镍分离因素与水相pH的如图所示。Co/Ni分离因素越大,表明萃取剂对Co/Ni分离效果越好。由图可知,萃取时的最佳水相pH为_______(填字母)。
。萃取时,Co、Ni的浸出率和钴/镍分离因素与水相pH的如图所示。Co/Ni分离因素越大,表明萃取剂对Co/Ni分离效果越好。由图可知,萃取时的最佳水相pH为_______(填字母)。
| A.2.5 | B.3.0 | C.3.5 | D.4.0 |
更新时间:2024-01-21 16:26:03
|
相似题推荐
解答题-工业流程题
|
较难
(0.4)
名校
解题方法
【推荐1】锌是生命中不可或缺的微量元素,有“生命火花”之称。硫酸锌常用作动植物补锌试剂,工业上,硫酸锌可由菱锌矿制备,菱锌矿的主要成分为ZnCO3,杂质为SiO2以及Ca、Mg、Fe、Cu等的化合物。其制备流程如图:

本题中所涉及离子的氢氧化物溶度积常数如表:
回答下列问题:
(1)菱锌矿焙烧生成氧化锌的化学方程式为_______ 。
(2)为了提高锌的浸取效果,可采取的措施有_______ 、_______ 。
(3)加入物质X调节溶液pH=5,以下试剂能实现该目的是_______ 。
A.NH3•H2O B.Ca(OH)2 C.NaOH D.MgO
滤渣①的主要成分是_______ 。
(4)向80~90℃的滤液①中分批加入适量KMnO4溶液充分反应后过滤,滤渣②中有MnO2,该反应的离子方程式为_______ 。
(5)滤液②中加入锌粉的目的是_______ 。
(6)滤渣④与浓H2SO4反应可以释放HF并循环利用,同时得到的副产物是_______ 。
(7)硫酸锌溶液与过量氨水反应可生成配离子[Zn(NH3)4]2+,其结构如图所示:

①请在结构图中用箭头标出配位键_______ 。
②该配离子所含配体的分子空间构型为_______ 。

本题中所涉及离子的氢氧化物溶度积常数如表:
| 离子 | Fe3+ | Zn2+ | Cu2+ | Fe2+ | Mg2+ |
| Ksp | 4.0×10-38 | 6.7×10-17 | 2.2×10-20 | 8.0×10-16 | 1.8×10-11 |
(1)菱锌矿焙烧生成氧化锌的化学方程式为
(2)为了提高锌的浸取效果,可采取的措施有
(3)加入物质X调节溶液pH=5,以下试剂能实现该目的是
A.NH3•H2O B.Ca(OH)2 C.NaOH D.MgO
滤渣①的主要成分是
(4)向80~90℃的滤液①中分批加入适量KMnO4溶液充分反应后过滤,滤渣②中有MnO2,该反应的离子方程式为
(5)滤液②中加入锌粉的目的是
(6)滤渣④与浓H2SO4反应可以释放HF并循环利用,同时得到的副产物是
(7)硫酸锌溶液与过量氨水反应可生成配离子[Zn(NH3)4]2+,其结构如图所示:

①请在结构图中用箭头标出配位键
②该配离子所含配体的分子空间构型为
您最近一年使用:0次
解答题-无机推断题
|
较难
(0.4)
名校
解题方法
【推荐2】为探究固体化合物X(含四种短周期元素)的组成和性质,设计并完成如下实验:

已知:白色固体A是一种优质的耐高温材料;无色溶液D只含一种溶质且为正盐。请回答:
(1)无色溶液D中溶质的阳离子结构示意图是______ 。
(2)白色固体A→无色溶液B的离子方程式是______ 。
(3)X中含有的元素是H、O和______ (填元素符号),X的化学式是______ 。

已知:白色固体A是一种优质的耐高温材料;无色溶液D只含一种溶质且为正盐。请回答:
(1)无色溶液D中溶质的阳离子结构示意图是
(2)白色固体A→无色溶液B的离子方程式是
(3)X中含有的元素是H、O和
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
名校
解题方法
【推荐3】硫化氢的回收、转化是环境保护和资源利用的重要研究课题。
(1)H2S溶于水分步电离出HS-、S2-。产生HS-的电离方程式是____ 。
(2)脱除H2S有多种方法。
①沉淀法。
将H2S气体通入ZnSO4溶液,只产生少量白色ZnS沉淀,即反应不完全。如果在ZnSO4溶液中事先加入CH3COONa,再通入H2S气体,则可得大量ZnS沉淀。
a.ZnSO4溶液吸收H2S的离子反应方程式是_____ 。
b.加入CH3COONa后得到大量ZnS沉淀的原因是____ 。
②沉淀氧化法。过程如图所示:
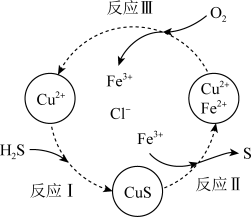
a.反应Ⅱ的离子方程式是____ 。
b.资料1:Cu2+在反应Ⅲ中起催化作用:
i.Cu2++Fe2+=Cu++Fe3+
ii._____ (将反应ii补充完整)
c.在温度一定和不补加溶液的条件下,缓慢通入混合气体,并充分搅拌。欲使生成的硫单质中不含CuS,可采取的措施有____ 。
d.下面实验证实了资料1,Cu2+能提高反应Ⅲ的速率。
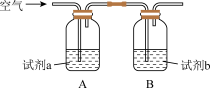
i.试剂a是___ ,试剂b是___ 。
ii.Cu2+提高反应Ⅲ速率的实验证据是____ 。
(1)H2S溶于水分步电离出HS-、S2-。产生HS-的电离方程式是
(2)脱除H2S有多种方法。
①沉淀法。
将H2S气体通入ZnSO4溶液,只产生少量白色ZnS沉淀,即反应不完全。如果在ZnSO4溶液中事先加入CH3COONa,再通入H2S气体,则可得大量ZnS沉淀。
a.ZnSO4溶液吸收H2S的离子反应方程式是
b.加入CH3COONa后得到大量ZnS沉淀的原因是
②沉淀氧化法。过程如图所示:

a.反应Ⅱ的离子方程式是
b.资料1:Cu2+在反应Ⅲ中起催化作用:
i.Cu2++Fe2+=Cu++Fe3+
ii.
c.在温度一定和不补加溶液的条件下,缓慢通入混合气体,并充分搅拌。欲使生成的硫单质中不含CuS,可采取的措施有
d.下面实验证实了资料1,Cu2+能提高反应Ⅲ的速率。

i.试剂a是
ii.Cu2+提高反应Ⅲ速率的实验证据是
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
名校
【推荐1】天津港“8.12”爆炸事故中,因爆炸冲击导致氰化钠有少量泄漏,可通过喷洒硫代硫酸钠溶液来处理,以减轻污染。某化学兴趣小组在实验室制备硫代硫酸钠,并探究硫代硫酸钠的性质及氰化钠废水的处理。
【实验一】实验室通过如下图(a)所示装置制备Na2S2O3·5H2O
已知:Na2S2O3在酸性溶液中不能稳定存在,有关物质的溶解度曲线如图(b)所示,
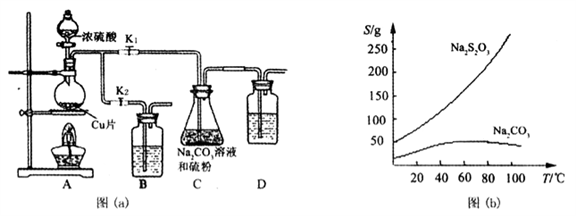
步骤1:如图连接好装置后,检查A、C装置气密性的操作是__________ 。
步骤2:加入药品,打开K1、关闭K2,加热。装置B、D中的药品可选用下列__________ (填编号)
A. NaOH溶液 B.浓H2SO4 C.酸性KMnO4溶液 D.饱和NaHCO3溶液
步骤3:C中混合液被气流搅动,反应一段时间后,硫粉的量逐渐减少。当C中溶液的pH在7至10时,打开K2、关闭K1并停止加热,C中溶液要控制pH的原因是__________ 。
步骤4:先将C中的混合液过滤,再将滤液经过加热浓缩,趁热过滤,最后将滤液__________ 得到产品。
【实验二】Na2 S2O3的性质及废水处理:
(1)向足量的新制氯水中滴加少量Na2 S2O3溶液,氯水颜色变浅,检查反应后溶液中含有硫酸根,写出该反应的离子方程式__________ 。
(2)氰化钠与硫代硫酸钠的反应为:NaCN + Na2S2O3=NaSCN + Na2SO3;已知:NaSCN中S为-2价,处理掉lmolNaCN,碳原子失去电子的物质的量为__________ 。
(3)废水中的CN-也可在催化剂作用下先用NaClO氧化成CNO-,再在酸性条件下继续用NaClO将CNO-氧化成两种对环境无污染的气体。则后一步反应的离子方程式为:
__________ 。
三、计算题
【实验一】实验室通过如下图(a)所示装置制备Na2S2O3·5H2O
已知:Na2S2O3在酸性溶液中不能稳定存在,有关物质的溶解度曲线如图(b)所示,

步骤1:如图连接好装置后,检查A、C装置气密性的操作是
步骤2:加入药品,打开K1、关闭K2,加热。装置B、D中的药品可选用下列
A. NaOH溶液 B.浓H2SO4 C.酸性KMnO4溶液 D.饱和NaHCO3溶液
步骤3:C中混合液被气流搅动,反应一段时间后,硫粉的量逐渐减少。当C中溶液的pH在7至10时,打开K2、关闭K1并停止加热,C中溶液要控制pH的原因是
步骤4:先将C中的混合液过滤,再将滤液经过加热浓缩,趁热过滤,最后将滤液
【实验二】Na2 S2O3的性质及废水处理:
(1)向足量的新制氯水中滴加少量Na2 S2O3溶液,氯水颜色变浅,检查反应后溶液中含有硫酸根,写出该反应的离子方程式
(2)氰化钠与硫代硫酸钠的反应为:NaCN + Na2S2O3=NaSCN + Na2SO3;已知:NaSCN中S为-2价,处理掉lmolNaCN,碳原子失去电子的物质的量为
(3)废水中的CN-也可在催化剂作用下先用NaClO氧化成CNO-,再在酸性条件下继续用NaClO将CNO-氧化成两种对环境无污染的气体。则后一步反应的离子方程式为:
三、计算题
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
解题方法
【推荐2】氧化钪用于电子工业、激光及超导材料、合金添加剂等。以赤泥(含有 、
、 、
、 、
、 、
、 等)为原料提取
等)为原料提取 的工艺流程如图所示:
的工艺流程如图所示:

已知:① 为二(2-乙基己基)磷酸酯,属于磷类萃取剂;
为二(2-乙基己基)磷酸酯,属于磷类萃取剂;
②TBP为中性磷类萃取剂;
③ ,
,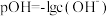 。
。
回答下列问题:
(1)“酸浸”产生的“滤渣”主要成分包括富钛浸渣和___________ (填化学式),为提高“酸浸”效率,可采取的措施有___________ (任写两条)。
(2)图1、图2所示分别为酸浸时温度和酸浸时间对酸浸率的影响,根据图中信息确定最佳反应条件:______________________ ;超过70℃,浸出率下降的原因是___________ 。

(3)常温下,进行“反萃取1”需调整反萃取液的pH,已知 浓度小于等于
浓度小于等于 时沉淀完全,当
时沉淀完全,当 恰好沉淀完全时,溶液的pOH为
恰好沉淀完全时,溶液的pOH为___________ (用代数式表示,不用化简)。
(4)写出“沉钪”过程中发生反应的离子方程式:___________ ;“灼烧”过程中发生反应的化学方程式为___________ 。
(5)“水相1”中含有金属阳离子 、
、 ,经过萃取除铁后,将溶液蒸发结晶,煅烧,即可得到氧化铝。用惰性电极电解熔融氧化铝制取铝时,需要加入冰晶石(
,经过萃取除铁后,将溶液蒸发结晶,煅烧,即可得到氧化铝。用惰性电极电解熔融氧化铝制取铝时,需要加入冰晶石( ),其目的是
),其目的是_____________ ,当外电路转移30mol电子时,理论上阴极获得铝的质量为___________ g。
 、
、 、
、 、
、 、
、 等)为原料提取
等)为原料提取 的工艺流程如图所示:
的工艺流程如图所示:
已知:①
 为二(2-乙基己基)磷酸酯,属于磷类萃取剂;
为二(2-乙基己基)磷酸酯,属于磷类萃取剂;②TBP为中性磷类萃取剂;
③
 ,
,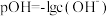 。
。回答下列问题:
(1)“酸浸”产生的“滤渣”主要成分包括富钛浸渣和
(2)图1、图2所示分别为酸浸时温度和酸浸时间对酸浸率的影响,根据图中信息确定最佳反应条件:

(3)常温下,进行“反萃取1”需调整反萃取液的pH,已知
 浓度小于等于
浓度小于等于 时沉淀完全,当
时沉淀完全,当 恰好沉淀完全时,溶液的pOH为
恰好沉淀完全时,溶液的pOH为(4)写出“沉钪”过程中发生反应的离子方程式:
(5)“水相1”中含有金属阳离子
 、
、 ,经过萃取除铁后,将溶液蒸发结晶,煅烧,即可得到氧化铝。用惰性电极电解熔融氧化铝制取铝时,需要加入冰晶石(
,经过萃取除铁后,将溶液蒸发结晶,煅烧,即可得到氧化铝。用惰性电极电解熔融氧化铝制取铝时,需要加入冰晶石( ),其目的是
),其目的是
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
名校
【推荐3】用镍铂合金废料(主要成分为 、
、 ,含少量
,含少量 和难溶于硫酸的重金属)回收镍和铂的一种工艺流程如下:
和难溶于硫酸的重金属)回收镍和铂的一种工艺流程如下:

(1)“酸浸”后分离出的溶液中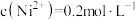 ,
, ,当溶液中离子浓度
,当溶液中离子浓度 时可认为沉淀完全,则“调pH”应控制pH的范围是
时可认为沉淀完全,则“调pH”应控制pH的范围是_______ 。(设“调pH”时溶液体积不变){已知: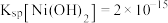 、
、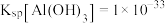 }
}
(2)“控温氧化”时控制其他条件一定, 的产率与温度和时间的关系如图所示。20℃、40℃时反应后所得滤液主要为
的产率与温度和时间的关系如图所示。20℃、40℃时反应后所得滤液主要为 、
、 和
和 ,60℃时反应后所得滤液主要为
,60℃时反应后所得滤液主要为 、
、 、
、 和
和 。反应相同时间,60℃时
。反应相同时间,60℃时 的产率低于40℃时,原因可能是
的产率低于40℃时,原因可能是_______ 。

(3)“含 滤渣”中的
滤渣”中的 可以用王水(体积比3∶1的浓盐酸和浓硝酸的混合液)浸出。浸出时有
可以用王水(体积比3∶1的浓盐酸和浓硝酸的混合液)浸出。浸出时有 和
和 生成。向
生成。向 溶液中加入
溶液中加入 会生成
会生成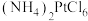 沉淀。
沉淀。
①写出浸出时 所发生反应的化学方程式:
所发生反应的化学方程式:_______ 。
②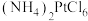 在一定温度下可以分解生成
在一定温度下可以分解生成 。
。 存在顺式和反式两种结构。请在如图的两个结构中,选择其中一个,填入相应的基团表示
存在顺式和反式两种结构。请在如图的两个结构中,选择其中一个,填入相应的基团表示 的顺式结构
的顺式结构_______ 。

(4) 产品中可能含少量
产品中可能含少量 ,为测定
,为测定 的纯度,进行如下实验:称取5.000g样品,加入足量硫酸后,再加入100
的纯度,进行如下实验:称取5.000g样品,加入足量硫酸后,再加入100 1.000
1.000
 标准溶液,充分反应,加水定容至200
标准溶液,充分反应,加水定容至200 。取出20.00
。取出20.00 ,用0.1
,用0.1
 标准溶液滴定,到达滴定终点时消耗
标准溶液滴定,到达滴定终点时消耗 标准溶液10.00
标准溶液10.00 。实验过程中发生反应如下:
。实验过程中发生反应如下:
 (未配平)
(未配平)
 (未配平)
(未配平)
试通过计算确定 的质量分数,并写出计算过程
的质量分数,并写出计算过程_______ 。
 、
、 ,含少量
,含少量 和难溶于硫酸的重金属)回收镍和铂的一种工艺流程如下:
和难溶于硫酸的重金属)回收镍和铂的一种工艺流程如下:
(1)“酸浸”后分离出的溶液中
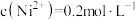 ,
, ,当溶液中离子浓度
,当溶液中离子浓度 时可认为沉淀完全,则“调pH”应控制pH的范围是
时可认为沉淀完全,则“调pH”应控制pH的范围是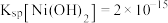 、
、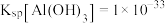 }
}(2)“控温氧化”时控制其他条件一定,
 的产率与温度和时间的关系如图所示。20℃、40℃时反应后所得滤液主要为
的产率与温度和时间的关系如图所示。20℃、40℃时反应后所得滤液主要为 、
、 和
和 ,60℃时反应后所得滤液主要为
,60℃时反应后所得滤液主要为 、
、 、
、 和
和 。反应相同时间,60℃时
。反应相同时间,60℃时 的产率低于40℃时,原因可能是
的产率低于40℃时,原因可能是
(3)“含
 滤渣”中的
滤渣”中的 可以用王水(体积比3∶1的浓盐酸和浓硝酸的混合液)浸出。浸出时有
可以用王水(体积比3∶1的浓盐酸和浓硝酸的混合液)浸出。浸出时有 和
和 生成。向
生成。向 溶液中加入
溶液中加入 会生成
会生成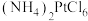 沉淀。
沉淀。①写出浸出时
 所发生反应的化学方程式:
所发生反应的化学方程式:②
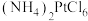 在一定温度下可以分解生成
在一定温度下可以分解生成 。
。 存在顺式和反式两种结构。请在如图的两个结构中,选择其中一个,填入相应的基团表示
存在顺式和反式两种结构。请在如图的两个结构中,选择其中一个,填入相应的基团表示 的顺式结构
的顺式结构
(4)
 产品中可能含少量
产品中可能含少量 ,为测定
,为测定 的纯度,进行如下实验:称取5.000g样品,加入足量硫酸后,再加入100
的纯度,进行如下实验:称取5.000g样品,加入足量硫酸后,再加入100 1.000
1.000
 标准溶液,充分反应,加水定容至200
标准溶液,充分反应,加水定容至200 。取出20.00
。取出20.00 ,用0.1
,用0.1
 标准溶液滴定,到达滴定终点时消耗
标准溶液滴定,到达滴定终点时消耗 标准溶液10.00
标准溶液10.00 。实验过程中发生反应如下:
。实验过程中发生反应如下: (未配平)
(未配平) (未配平)
(未配平)试通过计算确定
 的质量分数,并写出计算过程
的质量分数,并写出计算过程
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
解题方法
【推荐1】V2O5是接触法制硫酸的重要催化剂,工业上生产V2O5的工艺流程如下:

(1)步骤①所得废渣与NaOH溶液反应的离子反应方程式为_______________________ ;
(2)步骤②、③的变化过程可简化为(下式R表示VO2+,HA表示有机萃取剂):
R2(SO4)n(水层)+2nHA(有机层)2RAn(有机层)+nH2SO4(水层),
①实验室中步骤②、③使用的主要仪器是_____________ ;
②步骤②中萃取时必须加入适量碱,其原因是_____________________________ ;
(3)步骤③中X试剂为_________ (填化学式),步骤④的目的是___________________ ;
(4)该工艺流程中,可以循环利用的物质有___________ 和____________ (填名称)。

(1)步骤①所得废渣与NaOH溶液反应的离子反应方程式为
(2)步骤②、③的变化过程可简化为(下式R表示VO2+,HA表示有机萃取剂):
R2(SO4)n(水层)+2nHA(有机层)2RAn(有机层)+nH2SO4(水层),
①实验室中步骤②、③使用的主要仪器是
②步骤②中萃取时必须加入适量碱,其原因是
(3)步骤③中X试剂为
(4)该工艺流程中,可以循环利用的物质有
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
【推荐2】工业以软锰矿(主要成分是MnO2,含有SiO2、Fe2O3等少量杂质)为主要原料制备高性能的磁性材料碳酸锰(MnCO3)。其工业流程如下:
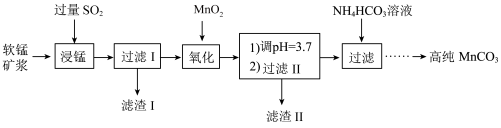
(1)浸锰过程中Fe2O3与SO2反应的离子方程式为Fe2O3+ SO2+2H+=2Fe2++ SO42-+ H2O,该反应是经历以下两步反应实现的。
ⅰ:Fe2O3 + 6H+ = 2Fe3++3H2O ⅱ: ......
写出ⅱ的离子方程式:____________________________________________ 。
(2)过滤Ⅰ所得滤液中主要存在的两种金属阳离子为_______ (填离子符号)。
(3)氧化过程中被MnO2氧化的物质有(写化学式):____________________ 。
(4)“浸锰”反应中往往有副产物MnS2O6生成,温度对“浸锰”反应的影响如图所示,为减少MnS2O6的生成,“浸锰”的适宜温度是_________ ;向过滤Ⅱ所得的滤液中加入NH4HCO3溶液时温度不宜太高的原因是______________________ 。
(5)加入NH4HCO3溶液后,生成MnCO3沉淀,同时还有气体生成,写出反应的离子方程式:_____________________ 。
(6)生成的MnCO3沉淀需经充分洗涤,检验洗涤是否完全的方法是_________________________________ 。

(1)浸锰过程中Fe2O3与SO2反应的离子方程式为Fe2O3+ SO2+2H+=2Fe2++ SO42-+ H2O,该反应是经历以下两步反应实现的。
ⅰ:Fe2O3 + 6H+ = 2Fe3++3H2O ⅱ: ......
写出ⅱ的离子方程式:
(2)过滤Ⅰ所得滤液中主要存在的两种金属阳离子为
(3)氧化过程中被MnO2氧化的物质有(写化学式):
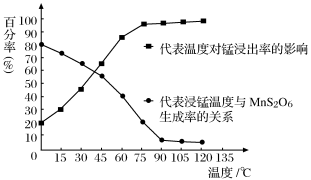
(4)“浸锰”反应中往往有副产物MnS2O6生成,温度对“浸锰”反应的影响如图所示,为减少MnS2O6的生成,“浸锰”的适宜温度是

(5)加入NH4HCO3溶液后,生成MnCO3沉淀,同时还有气体生成,写出反应的离子方程式:
(6)生成的MnCO3沉淀需经充分洗涤,检验洗涤是否完全的方法是
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
名校
【推荐3】下图的实验装置可用于研究SO2转化为SO3的转化率。已知:SO3的熔点是16.8℃,沸点是44.8℃。A处为SO2气体发生装置,C处为SO2与O2反应的装置。
(1).A处的化学反应方程式为__________________ ,仪器F的名称为___________________________ 。
(2).根据实验需要,应该在D、E处连接合适的装置。请从下图中选择,将所选装置的序号填入相应的空格,D:________________ ,E:______________ 。_____ %(用含a、b的代数式表示)。
(4).若Na2SO3变质,会影响到SO2的转化。现欲检验某Na2SO3样品是否变质,你的方法是____________________________________________________________________________________________ 。
(5).实验结束后,如果将收集了SO3的装置敞口露置于空气中,可看到装置出口处产生大量白雾,其原因是___________________________ 。

(1).A处的化学反应方程式为
(2).根据实验需要,应该在D、E处连接合适的装置。请从下图中选择,将所选装置的序号填入相应的空格,D:
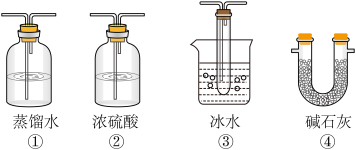
(4).若Na2SO3变质,会影响到SO2的转化。现欲检验某Na2SO3样品是否变质,你的方法是
(5).实验结束后,如果将收集了SO3的装置敞口露置于空气中,可看到装置出口处产生大量白雾,其原因是
您最近一年使用:0次



