已知常温下的反应:3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O。
(1)用双线桥表示电子转移情况:___________ 。
(2)HNO3在反应中体现酸性和___________ 性(填“氧化”或“还原”)。
(3)反应时氧化剂与还原剂个数比是___________ 。
(4)若有31.5克硝酸被还原,则产生标况下NO气体的体积是___________ L。
(1)用双线桥表示电子转移情况:
(2)HNO3在反应中体现酸性和
(3)反应时氧化剂与还原剂个数比是
(4)若有31.5克硝酸被还原,则产生标况下NO气体的体积是
更新时间:2024-01-29 18:13:03
|
相似题推荐
填空题
|
较易
(0.85)
【推荐1】化学与生活密切相关,回答下列问题:
(1)豆浆中加入适量胆水(含 等)能形成豆腐,是因为胶体遇电解质发生
等)能形成豆腐,是因为胶体遇电解质发生_______ 。
(2)铁与水难反应,但在高温条件下与水蒸气反应,生成的固体物质为_______ (写化学式)。
(3)明矾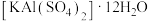 是一种常用净水剂。写出
是一种常用净水剂。写出 溶于水的电离方程式
溶于水的电离方程式_______ 。
(4)“84”消毒液与洁厕灵(主要成分为 )混用会生成有毒的氯气,反应方程式为
)混用会生成有毒的氯气,反应方程式为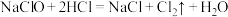 。该反应中还原剂是
。该反应中还原剂是_______ ,用双线桥表示该反应中电子转移方向和数目_______ 。
(5)硅胶常用作袋装食品的干燥剂,原因是_______ (用适当的文字描述)。
(1)豆浆中加入适量胆水(含
 等)能形成豆腐,是因为胶体遇电解质发生
等)能形成豆腐,是因为胶体遇电解质发生(2)铁与水难反应,但在高温条件下与水蒸气反应,生成的固体物质为
(3)明矾
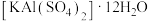 是一种常用净水剂。写出
是一种常用净水剂。写出 溶于水的电离方程式
溶于水的电离方程式(4)“84”消毒液与洁厕灵(主要成分为
 )混用会生成有毒的氯气,反应方程式为
)混用会生成有毒的氯气,反应方程式为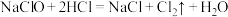 。该反应中还原剂是
。该反应中还原剂是(5)硅胶常用作袋装食品的干燥剂,原因是
您最近一年使用:0次
【推荐2】氧化还原反应原理在研究物质性质及物质转化方面具有重要的价值。
(1)人体正常的血红蛋白含有Fe2+,若误食亚硝酸盐(如NaNO2),则导致血红蛋白中的Fe2+转化为Fe3+而中毒,服用维生素C可解毒。根据氧化还原知识填空:
①Fe2+→Fe3+的转化时,Fe2+在反应中发生_______ 反应(填“氧化”或“还原”);
②“服用维生素C可使食物中的Fe3+转变成Fe2+”,这句话说明维生素C作_______ 剂(填“氧化”或“还原”)。
(2)砒霜(As2O3)可与Zn反应:As2O3+6Zn+6H2SO4=2AsH3+6ZnSO4+3H2O。其中,As2O3显示出来的性质是_______ (填“还原性”或“氧化性”),氧化产物是_______ 。
(3)钛金属具有硬度大、熔点高、常温下耐酸碱、耐腐蚀等优良的性能,被誉为“未来金属”。在工业上常常采用钠还原TiCl4的方法制取,该反应的反应方程式如下:TiCl4+4Na=Ti+4NaCl。
①用单线桥法标出上述化学方程式的电子转移情况_______ ;
②若4个Na全部参加反应,则该过程转移的电子是_______ 个。
(4)生活中若将“84”消毒液(有效成分是NaClO)和洁厕精(主要成分是HCl)混合,易产生黄绿色有毒气体Cl2。请将方程式补充完整:_______ 。
_______NaClO+_______HCl(浓) =_______NaCl+_______Cl2↑+_______H2O
(1)人体正常的血红蛋白含有Fe2+,若误食亚硝酸盐(如NaNO2),则导致血红蛋白中的Fe2+转化为Fe3+而中毒,服用维生素C可解毒。根据氧化还原知识填空:
①Fe2+→Fe3+的转化时,Fe2+在反应中发生
②“服用维生素C可使食物中的Fe3+转变成Fe2+”,这句话说明维生素C作
(2)砒霜(As2O3)可与Zn反应:As2O3+6Zn+6H2SO4=2AsH3+6ZnSO4+3H2O。其中,As2O3显示出来的性质是
(3)钛金属具有硬度大、熔点高、常温下耐酸碱、耐腐蚀等优良的性能,被誉为“未来金属”。在工业上常常采用钠还原TiCl4的方法制取,该反应的反应方程式如下:TiCl4+4Na=Ti+4NaCl。
①用单线桥法标出上述化学方程式的电子转移情况
②若4个Na全部参加反应,则该过程转移的电子是
(4)生活中若将“84”消毒液(有效成分是NaClO)和洁厕精(主要成分是HCl)混合,易产生黄绿色有毒气体Cl2。请将方程式补充完整:
_______NaClO+_______HCl(浓) =_______NaCl+_______Cl2↑+_______H2O
您最近一年使用:0次
填空题
|
较易
(0.85)
名校
【推荐3】某学习小组通过实验研究Na2O2与水的反应。
(1)甲同学认为ⅱ中溶液褪色是溶液a中存在较多的H2O2,H2O2与酚酞发生了反应,并实验证实了H2O2的存在;取少量溶液a,加入试剂____ (填化学式),有气体产生。
(2)乙同学查阅资料获悉:用KMnO4可以氧化H2O2并测定其含量。取20.00mL溶液,用稀H2SO4酸化,用0.002mol/LKMnO4溶液滴定,产生气体,溶液褪色,至终点时共消耗10.00mLKMnO4溶液。
①实验中,滴定时KMnO4溶液应装在____ (酸或碱)式滴定管中。
②配平并用用单线桥标出该反应电子转移的方向和数目:___
MnO +H2O2+H+=Mn2++O2↑+H2O
+H2O2+H+=Mn2++O2↑+H2O
③溶液a中c(H2O2)=____ mol/L。
| 操作 | 现象 |
| 向盛有4.0gNa2O2的烧杯中加入50mL蒸馏水 | 剧列反应,产生能使带火星木条复燃的气体,得到的无色溶液a |
| 向溶液a中滴入两滴酚酞 | ⅰ.溶液变红 ⅱ.10分钟后溶液颜色明显变浅,稍后,溶液变为无色 |
(1)甲同学认为ⅱ中溶液褪色是溶液a中存在较多的H2O2,H2O2与酚酞发生了反应,并实验证实了H2O2的存在;取少量溶液a,加入试剂
(2)乙同学查阅资料获悉:用KMnO4可以氧化H2O2并测定其含量。取20.00mL溶液,用稀H2SO4酸化,用0.002mol/LKMnO4溶液滴定,产生气体,溶液褪色,至终点时共消耗10.00mLKMnO4溶液。
①实验中,滴定时KMnO4溶液应装在
②配平并用用单线桥标出该反应电子转移的方向和数目:
MnO
 +H2O2+H+=Mn2++O2↑+H2O
+H2O2+H+=Mn2++O2↑+H2O③溶液a中c(H2O2)=
您最近一年使用:0次
填空题
|
较易
(0.85)
名校
【推荐1】一种用于食品加热的发热包,主要成分为CaO、铝粉、 。使用时向发热包加适量水,就能持续放热,温度可达100℃以上。可能发生的反应如下:
。使用时向发热包加适量水,就能持续放热,温度可达100℃以上。可能发生的反应如下:
ⅰ、
ⅱ、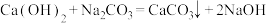
ⅲ、
(1)属于复分解反应的是______ (填序号)。
(2)反应ⅲ中,每1molAl发生反应,转移电子数为______ mol。
(3)使用时需要向发热包加水,水的作用是______ (写出两点即可)。
 。使用时向发热包加适量水,就能持续放热,温度可达100℃以上。可能发生的反应如下:
。使用时向发热包加适量水,就能持续放热,温度可达100℃以上。可能发生的反应如下:ⅰ、

ⅱ、
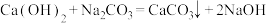
ⅲ、

(1)属于复分解反应的是
(2)反应ⅲ中,每1molAl发生反应,转移电子数为
(3)使用时需要向发热包加水,水的作用是
您最近一年使用:0次
填空题
|
较易
(0.85)
名校
【推荐2】已知实验室制氯气反应原理:MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O。
MnCl2+Cl2↑+2H2O。
①氧化剂和还原剂的物质的量之比为:_______
②浓盐酸在反应中显示出来的性质是________________
A.只有还原性 B.还原性和酸性 C.只有氧化性 D.氧化性和酸性
③在该反应中,若有2mol电子发生转移,在标准状况下,可生成Cl2的体积为_________ ,被氧化的盐酸为_______ mol。
 MnCl2+Cl2↑+2H2O。
MnCl2+Cl2↑+2H2O。①氧化剂和还原剂的物质的量之比为:
②浓盐酸在反应中显示出来的性质是
A.只有还原性 B.还原性和酸性 C.只有氧化性 D.氧化性和酸性
③在该反应中,若有2mol电子发生转移,在标准状况下,可生成Cl2的体积为
您最近一年使用:0次
填空题
|
较易
(0.85)
名校
【推荐1】一反应体系有反应物和生成物共7种物质:O2、KMnO4、MnSO4、H2SO4、H2O、H2O2、K2SO4。已知该反应中H2O2只发生如下过程:H2O2→O2,试回答下列问题:
(1)该反应中的氧化剂是________ 。
(2)该反应中,发生还原反应的过程是_________ 。
(3)该反应中,氧化产物与还原产物的物质的量之比是______ 。
(4)若反应转移了0.3mol电子,则产生的气体在标准状况下的体积为______ 。
(1)该反应中的氧化剂是
(2)该反应中,发生还原反应的过程是
(3)该反应中,氧化产物与还原产物的物质的量之比是
(4)若反应转移了0.3mol电子,则产生的气体在标准状况下的体积为
您最近一年使用:0次
【推荐2】在反应Cu+4HNO3=Cu(NO3)2+2NO2↑+2H2O中,氧化剂是___________ ,氧化产物是___________ ,还原产物是___________ ,______ 元素的化合价升高,该元素的原子___________ 电子,______ 发生氧化反应;该反应转移1mol电子时,消耗铜的物质的量为 ___________ mol。
您最近一年使用:0次
【推荐3】在Cu+HNO3 ———— Cu(NO3)2+NO↑+4H2O反应中,
(1)______ 元素被氧化, ______ 是氧化剂;
(2)______ 是氧化产物, ______ 发生氧化反应;
(3)被还原的HNO3与参加反应的HNO3物质的量之比是______ ;
(4)用双线桥标出该反应电子转移的方向和数目:
3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O_____________________________________ ;
(5)当有8mol HNO3被还原时,反应转移___________ 个电子;
(6)写出该反应的离子反应方程式___________________________ 。
(1)
(2)
(3)被还原的HNO3与参加反应的HNO3物质的量之比是
(4)用双线桥标出该反应电子转移的方向和数目:
3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O
(5)当有8mol HNO3被还原时,反应转移
(6)写出该反应的离子反应方程式
您最近一年使用:0次



