 常用于制钡盐和立德粉,也作橡胶硫化剂。实验室利用下图装置探究制取
常用于制钡盐和立德粉,也作橡胶硫化剂。实验室利用下图装置探究制取 时气体产物的成分(夹持仪器略去),并测定固体产品的纯度。
时气体产物的成分(夹持仪器略去),并测定固体产品的纯度。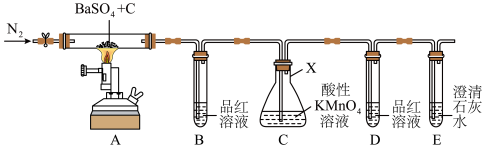
(1)仪器
 的名称为
的名称为(2)一段时间后,
 中品红溶液褪色,
中品红溶液褪色, 中溶液颜色变淡,
中溶液颜色变淡, 、
、 中无明显现象,则实验生成的气体为
中无明显现象,则实验生成的气体为 中发生反应的离子方程式是
中发生反应的离子方程式是(3)该装置的明显缺陷是
(4)测定
 样品纯度的实验步骤如下:
样品纯度的实验步骤如下:Ⅰ.称取
 样品,加水溶解,配制成
样品,加水溶解,配制成 溶液;
溶液;Ⅱ.取一锥形瓶,向其中加入
 醋酸溶液、
醋酸溶液、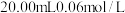 碘溶液、
碘溶液、 Ⅰ中所配制的溶液,待其充分反应(硫元素完全转化为硫单质);
Ⅰ中所配制的溶液,待其充分反应(硫元素完全转化为硫单质);Ⅲ.向充分反应后的溶液中,加入
 滴淀粉溶液,用
滴淀粉溶液,用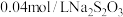 标准溶液滴定至终点,消耗
标准溶液滴定至终点,消耗 溶液
溶液 (
( )。
)。①滴定终点时的现象为
②样品中
 的纯度为
的纯度为 (保留三位有效数字)。
(保留三位有效数字)。③下列情况会导致测定
 的纯度偏小的是
的纯度偏小的是a.称量样品时,发生了潮解
b.配制
 溶液时,未洗涤烧杯
溶液时,未洗涤烧杯c.达滴定终点时,俯视读数
更新时间:2024-02-14 20:02:12
|
相似题推荐
解答题-实验探究题
|
适中
(0.65)
【推荐1】二氧化氯 是国际上公认的一种安全、低毒的绿色消毒剂。熔点为-59.5℃,沸点为11.0℃,极易溶于水,高浓度时极易爆炸,低浓度时爆炸性降低。某化学兴趣小组设计如图装置制备二氧化氯。回答下列问题:
是国际上公认的一种安全、低毒的绿色消毒剂。熔点为-59.5℃,沸点为11.0℃,极易溶于水,高浓度时极易爆炸,低浓度时爆炸性降低。某化学兴趣小组设计如图装置制备二氧化氯。回答下列问题:
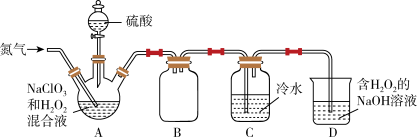
(1)装置B的作用是_______ ;制备 时,还有一种气体产生,该气体是
时,还有一种气体产生,该气体是_______ ;装置C使用冷水吸收二氧化氯的目的是_______ 。
(2)向装置A中通入氮气时流速不能过快,也不能过慢,其原因是_______ 。
(3)装置D吸收尾气,其产物之一是 。该反应的化学方程式为
。该反应的化学方程式为_______ 。
(4)测定装置C中二氧化氯溶液的浓度,步骤如下:
第一步:取20.00mL装置C中的溶液于锥形瓶中,向其中加入过量酸性KI溶液,发生反应: 。
。
第二步:加入淀粉作指示剂,向其中逐滴加入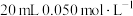 的
的 溶液至达到滴定终点,发生反应:
溶液至达到滴定终点,发生反应: 。
。
①第二步中滴定终点的标志是_______ 。
②装置C中二氧化氯溶液浓度为_______  。
。
③第二步若使用的 溶液配制已久,则测定的结果可能会
溶液配制已久,则测定的结果可能会_______ (填“偏低”、“偏高”或“无影响”)。
 是国际上公认的一种安全、低毒的绿色消毒剂。熔点为-59.5℃,沸点为11.0℃,极易溶于水,高浓度时极易爆炸,低浓度时爆炸性降低。某化学兴趣小组设计如图装置制备二氧化氯。回答下列问题:
是国际上公认的一种安全、低毒的绿色消毒剂。熔点为-59.5℃,沸点为11.0℃,极易溶于水,高浓度时极易爆炸,低浓度时爆炸性降低。某化学兴趣小组设计如图装置制备二氧化氯。回答下列问题:
(1)装置B的作用是
 时,还有一种气体产生,该气体是
时,还有一种气体产生,该气体是(2)向装置A中通入氮气时流速不能过快,也不能过慢,其原因是
(3)装置D吸收尾气,其产物之一是
 。该反应的化学方程式为
。该反应的化学方程式为(4)测定装置C中二氧化氯溶液的浓度,步骤如下:
第一步:取20.00mL装置C中的溶液于锥形瓶中,向其中加入过量酸性KI溶液,发生反应:
 。
。第二步:加入淀粉作指示剂,向其中逐滴加入
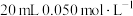 的
的 溶液至达到滴定终点,发生反应:
溶液至达到滴定终点,发生反应: 。
。①第二步中滴定终点的标志是
②装置C中二氧化氯溶液浓度为
 。
。③第二步若使用的
 溶液配制已久,则测定的结果可能会
溶液配制已久,则测定的结果可能会
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐2】氯及其化合物在工农业生产和日常生活中用途十分广泛。实验室制备氯气和漂白剂(有效成分为NaClO)的装置如图1所示。
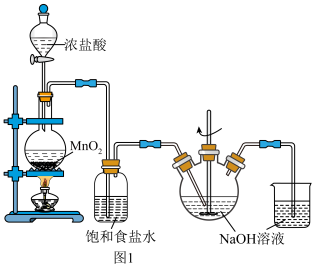
(1)在圆底烧瓶里加入MnO2,通过_______ (填写仪器名称)再加入适量的浓盐酸后加热,发生反应的化学方程式为_______ 。
(2)烧杯中NaOH溶液的作用是_______ 。
(3)设计实验探究反应条件对制备Cl2的影响:
①Ⅰ中溶液呈浅棕色是由于MnO2与浓盐酸发生了复分解反应,反应的方程式为_______ 。
②为探究Ⅲ中无明显现象的原因,又设计了实验Ⅳ,如图2所示:
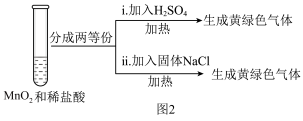
将实验Ⅲ、Ⅳ作对比,得出的结论是_______ 。
(4)实验中发现三颈烧瓶中生成物各物质的量和溶液的温度随时间的变化如图3所示。t1分钟后发生的主要反应的化学方程式为_______ 。

(5)NaClO是一种强氧化剂,有很强的杀菌、漂白作用,还可以用来氧化去除水体中的污染物。
①用NaClO处理废水中水合肼(N2H4•H2O),使其转化成无毒的氮气。写出反应的化学方程式:_______ 。
②NaClO处理高氯(含高浓度Cl-)废水中的有机物时,ClO-将有机物氧化为无毒物质。实验发现,当废水是“酸性”时,NaClO处理高氯废水时,有机物氧化率较低,其原因是_______ 。

(1)在圆底烧瓶里加入MnO2,通过
(2)烧杯中NaOH溶液的作用是
(3)设计实验探究反应条件对制备Cl2的影响:
| 实验 | 操作 | 现象 |
| Ⅰ | 常温下将MnO2和12mol•L-1的浓盐酸混合 | 溶液呈浅棕色,略有刺激性气味 |
| Ⅱ | 将Ⅰ中混合物过滤,加热滤液 | 生成大量黄绿色气体 |
| Ⅲ | 加热MnO2和4mol•L-1的稀盐酸混合物 | 无明显现象 |
②为探究Ⅲ中无明显现象的原因,又设计了实验Ⅳ,如图2所示:

将实验Ⅲ、Ⅳ作对比,得出的结论是
(4)实验中发现三颈烧瓶中生成物各物质的量和溶液的温度随时间的变化如图3所示。t1分钟后发生的主要反应的化学方程式为

(5)NaClO是一种强氧化剂,有很强的杀菌、漂白作用,还可以用来氧化去除水体中的污染物。
①用NaClO处理废水中水合肼(N2H4•H2O),使其转化成无毒的氮气。写出反应的化学方程式:
②NaClO处理高氯(含高浓度Cl-)废水中的有机物时,ClO-将有机物氧化为无毒物质。实验发现,当废水是“酸性”时,NaClO处理高氯废水时,有机物氧化率较低,其原因是
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐3】氨氮废水中氮元素主要以 、NH3形式存在,氨氮废水会造成水体富营养化。可用沉淀法处理氨氮废水并获得缓释肥料磷酸镁铵(MgNH4PO4),过程如下。
、NH3形式存在,氨氮废水会造成水体富营养化。可用沉淀法处理氨氮废水并获得缓释肥料磷酸镁铵(MgNH4PO4),过程如下。

已知:
(1)写出 的电子式
的电子式_______ 。
(2)经处理后,分离磷酸镁铵所用的方法是_______ 。
(3)处理氨氮废水时(氮元素以 形式存在),磷酸盐可选用Na2HPO4,主要生成MgNH4PO4沉淀,反应的离子方程式为
形式存在),磷酸盐可选用Na2HPO4,主要生成MgNH4PO4沉淀,反应的离子方程式为_______ 。
(4)向此废水中加入磷酸盐和镁盐,使铵态氮的残留达到一级排放标准(≤1.0mg/L即≤7×10-5mol/L),且c( )=1.0×10-5mol/L,则沉淀后的废水中c(Mg2+)≥
)=1.0×10-5mol/L,则沉淀后的废水中c(Mg2+)≥_______ (保留两位有效数字)。
(5)pH过大会降低废水中氨氮的去除率,可能的原因是_______ 。
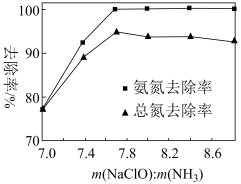
(6)使用次氯酸钠等氧化剂可以将污水中的NH3氧化除去,可以产生无色无味气体,该反应的化学方程式为_______ 。某条件下,次氯酸钠投加量对污水中的氮的去除率的影响如图所示,当m(NaClO):m(NH3)>7.7时,总氮除去率随m(NaClO):m(NH3)的增大不升反降的原因_______ 。
 、NH3形式存在,氨氮废水会造成水体富营养化。可用沉淀法处理氨氮废水并获得缓释肥料磷酸镁铵(MgNH4PO4),过程如下。
、NH3形式存在,氨氮废水会造成水体富营养化。可用沉淀法处理氨氮废水并获得缓释肥料磷酸镁铵(MgNH4PO4),过程如下。
已知:
| 物质 | MgNH4PO4 | Mg3(PO4)2 | Mg(OH)2 |
| 溶度积 | 2.5×10-13 | 1.04×1024 | 1.8×10-11 |
 的电子式
的电子式(2)经处理后,分离磷酸镁铵所用的方法是
(3)处理氨氮废水时(氮元素以
 形式存在),磷酸盐可选用Na2HPO4,主要生成MgNH4PO4沉淀,反应的离子方程式为
形式存在),磷酸盐可选用Na2HPO4,主要生成MgNH4PO4沉淀,反应的离子方程式为(4)向此废水中加入磷酸盐和镁盐,使铵态氮的残留达到一级排放标准(≤1.0mg/L即≤7×10-5mol/L),且c(
 )=1.0×10-5mol/L,则沉淀后的废水中c(Mg2+)≥
)=1.0×10-5mol/L,则沉淀后的废水中c(Mg2+)≥(5)pH过大会降低废水中氨氮的去除率,可能的原因是
(6)使用次氯酸钠等氧化剂可以将污水中的NH3氧化除去,可以产生无色无味气体,该反应的化学方程式为

您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐1】高铁酸钾(K2FeO4)是一种新型、高效、多功能绿色水处理剂,已知:
①NaClO在较高温度下发生歧化反应生成NaClO3。
②K2FeO4具有下列性质:可溶于水、微溶于浓KOH溶液;在强碱性溶液中比较稳定;在Fe3+催化作用下发生分解,在酸性至弱碱性条件下,能与水反应生成Fe(OH)3和O2实验室以次氯酸盐和铁盐为原料制备少量K2FeO4的操作步骤如下:
Ⅰ.制备NaClO强碱性饱和溶液:
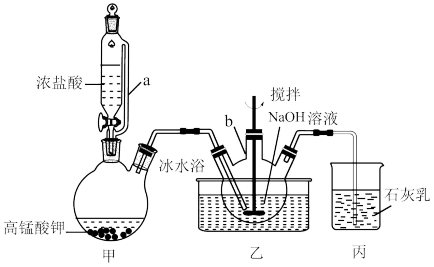
①将20mLNaOH溶液加入仪器b中,冷水浴冷却,通入Cl2,搅拌,直至溶液变为黄绿色且有少量白色晶体析出为止(装置如图所示)。
②将所得饱和NaClO倒入烧杯并置于冷水浴中,分几次加入20gNaOH固体并不断搅拌,过滤,得NaClO强碱性饱和溶液。
(1)甲装置中a管的作用是___ 。
(2)写出甲装置中反应的化学方程式___ 。
(3)石灰乳的作用是___ 。
(4)反应过程中用冷水浴冷却的原因是__ 。
Ⅱ.合成K2FeO4:
①称取5.05gFe(NO3)3·9H2O(相对分子质量为404)固体,在冷水浴中分批加入Ⅰ中所得滤液,并不断搅拌,反应1小时后溶液呈深紫红色(即Na2FeO4)。
②离心分离除去Na2FeO4水解得到的Fe(OH)3胶体,留上层清液(深紫红色).
③向②的上层清液中缓慢加入KOH饱和溶液50.00mL,冰水浴保持5min,过滤,得K2FeO4(M(K2FeO4)=198g/mol)粗产品。
④将粗产品重结晶,并洗涤,低温烘干,得纯产品2.13g。
(5)工业上常用废铁屑为原料制备Fe(NO3)3溶液,检验Fe3+所需试剂名称___ ,其反应原理为___ (用离子方程式表示);合成Na2FeO4的离子方程式为___ 。
(6)过程③加入饱和KOH溶液即可得到K2FeO4粗产品,析出K2FeO4固体,过滤、洗涤、干燥.洗涤操作所用最佳试剂为___ 。
A.水 B.无水乙醇 C.稀KOH溶液
(7)K2FeO4的产率为___ (保留至0.1%)。
①NaClO在较高温度下发生歧化反应生成NaClO3。
②K2FeO4具有下列性质:可溶于水、微溶于浓KOH溶液;在强碱性溶液中比较稳定;在Fe3+催化作用下发生分解,在酸性至弱碱性条件下,能与水反应生成Fe(OH)3和O2实验室以次氯酸盐和铁盐为原料制备少量K2FeO4的操作步骤如下:
Ⅰ.制备NaClO强碱性饱和溶液:
①将20mLNaOH溶液加入仪器b中,冷水浴冷却,通入Cl2,搅拌,直至溶液变为黄绿色且有少量白色晶体析出为止(装置如图所示)。

②将所得饱和NaClO倒入烧杯并置于冷水浴中,分几次加入20gNaOH固体并不断搅拌,过滤,得NaClO强碱性饱和溶液。
(1)甲装置中a管的作用是
(2)写出甲装置中反应的化学方程式
(3)石灰乳的作用是
(4)反应过程中用冷水浴冷却的原因是
Ⅱ.合成K2FeO4:
①称取5.05gFe(NO3)3·9H2O(相对分子质量为404)固体,在冷水浴中分批加入Ⅰ中所得滤液,并不断搅拌,反应1小时后溶液呈深紫红色(即Na2FeO4)。
②离心分离除去Na2FeO4水解得到的Fe(OH)3胶体,留上层清液(深紫红色).
③向②的上层清液中缓慢加入KOH饱和溶液50.00mL,冰水浴保持5min,过滤,得K2FeO4(M(K2FeO4)=198g/mol)粗产品。
④将粗产品重结晶,并洗涤,低温烘干,得纯产品2.13g。
(5)工业上常用废铁屑为原料制备Fe(NO3)3溶液,检验Fe3+所需试剂名称
(6)过程③加入饱和KOH溶液即可得到K2FeO4粗产品,析出K2FeO4固体,过滤、洗涤、干燥.洗涤操作所用最佳试剂为
A.水 B.无水乙醇 C.稀KOH溶液
(7)K2FeO4的产率为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐2】某化学兴趣小组按如下流程,进行海带中碘含量的测定。
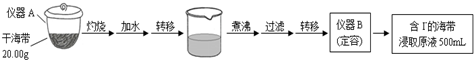
(1)写出仪器名称:A______ ,B______ 。
(2)取20.00 mL上述海带浸取原液,加稀H2SO4和足量KIO3,使I-和IO3-完全反应。再以淀粉为指示剂,用2.0×10-3mol/L的Na2S2O3溶液滴定,当I2恰好完全反应时,用去Na2S2O3溶液20.00mL。(已知:5I-+ IO3-+ 6H+=3I2 + 3H2O;I2 + 2S2O32-=2I-+ S4O62-)
①判断用Na2S2O3溶液滴定恰好完全反应的现象是______ 。
②计算该干海带中碘的质量分数______ 。(写出计算过程)

(1)写出仪器名称:A
(2)取20.00 mL上述海带浸取原液,加稀H2SO4和足量KIO3,使I-和IO3-完全反应。再以淀粉为指示剂,用2.0×10-3mol/L的Na2S2O3溶液滴定,当I2恰好完全反应时,用去Na2S2O3溶液20.00mL。(已知:5I-+ IO3-+ 6H+=3I2 + 3H2O;I2 + 2S2O32-=2I-+ S4O62-)
①判断用Na2S2O3溶液滴定恰好完全反应的现象是
②计算该干海带中碘的质量分数
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
【推荐3】某大型精炼铜厂,在电解铜的阳极泥中含有3-14℅Se元素,(Se和S同主族化学性质相似)以Se单质、Cu2Se存在,还含有稀有金属及贵金属。人体缺乏Se就会得“克山病”,Se也是制光电池的一种原料。从阳极泥中提取Se的流程如下:
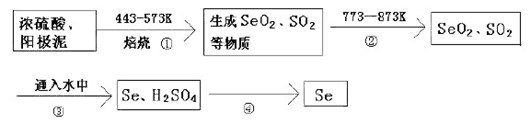
(1)流程②的目的是_________________ .流程④操作用到的玻璃仪器有烧杯、______________ 。
H2SeO3与SO2的离子反应方程式为_____________________________________ 。
(2)上述工业提取Se的流程中,SeO2、H2SO4(浓)、SO2的氧化性由强到弱的顺序是________________ 。工业提取Se的流程中,可循环利用的物质是_________________ 。
(3)称取5.000g电解铜阳极泥样品以合适方法溶解,配成250.00mL混酸溶液,移取上述溶液25.00mL于锥形瓶中,加入25.00mL0.01000mol·L-1KMnO4标准溶液{只发生Se(+4)转化为Se(+6)}。反应完全后,用0.05000mol·L-1Fe2+标准溶液滴至终点,消耗15.00mL,则电解铜阳极泥中Se的质量分数为____________ 。若用FeCl2溶液为Fe2+标准溶液滴至终点,对测定Se的质量分数结果是否有影响,理由是_____________ 。

(1)流程②的目的是
H2SeO3与SO2的离子反应方程式为
(2)上述工业提取Se的流程中,SeO2、H2SO4(浓)、SO2的氧化性由强到弱的顺序是
(3)称取5.000g电解铜阳极泥样品以合适方法溶解,配成250.00mL混酸溶液,移取上述溶液25.00mL于锥形瓶中,加入25.00mL0.01000mol·L-1KMnO4标准溶液{只发生Se(+4)转化为Se(+6)}。反应完全后,用0.05000mol·L-1Fe2+标准溶液滴至终点,消耗15.00mL,则电解铜阳极泥中Se的质量分数为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐1】烟道气中含有CO2、CO、NO、SO2,为测定其中NO的含量,设计如图实验装置:
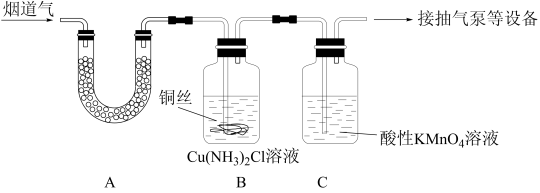
采样步骤如下:
I.检验装置气密性;
II.先通入氮气,再打开抽气泵用氮气置换装置内的空气;
III.通入V L烟道气,打开抽气泵;
IV.停止通入烟道气,关闭抽气泵。
已知:CuCl溶于浓氨水可得Cu(NH3)2Cl溶液,用Cu(NH3)2Cl溶液能保证完全吸收CO,但Cu(NH3)2Cl易被氧化。
回答下列问题:
(1)A装置中所盛试剂为_______ ,作用为_______ 。
(2)B装置中所盛铜丝的作用为_______ 。
(3)C装置中足量V1 mL c1 mol/L酸性KMnO4溶液,采样结束后,用c2 mol/L FeSO4标准溶液滴定剩余的酸性KMnO4溶液,终点时消耗V2 mL标准溶液。已知:NO被酸性KMnO4溶液氧化为NO , MnO
, MnO 被还原为Mn2+,其对Fe2+的干扰可忽略不计。
被还原为Mn2+,其对Fe2+的干扰可忽略不计。
①NO与酸性KMnO4溶液反应的离子方程式为_______ 。
②滴定终点的现象为_______ 。
③NO的含量为_______ mg·L-1(用含c1、V1、c2、V2、V的代数式表示,列出计算式即可)。
④若缺少步骤II,会使NO测定结果_______ (填“偏高”“偏低”或“无影响”)。
⑤若滴定终点俯视读数,会使NO测定结果_______ (填“偏高”“偏低”或“无影响”)。

采样步骤如下:
I.检验装置气密性;
II.先通入氮气,再打开抽气泵用氮气置换装置内的空气;
III.通入V L烟道气,打开抽气泵;
IV.停止通入烟道气,关闭抽气泵。
已知:CuCl溶于浓氨水可得Cu(NH3)2Cl溶液,用Cu(NH3)2Cl溶液能保证完全吸收CO,但Cu(NH3)2Cl易被氧化。
回答下列问题:
(1)A装置中所盛试剂为
(2)B装置中所盛铜丝的作用为
(3)C装置中足量V1 mL c1 mol/L酸性KMnO4溶液,采样结束后,用c2 mol/L FeSO4标准溶液滴定剩余的酸性KMnO4溶液,终点时消耗V2 mL标准溶液。已知:NO被酸性KMnO4溶液氧化为NO
 , MnO
, MnO 被还原为Mn2+,其对Fe2+的干扰可忽略不计。
被还原为Mn2+,其对Fe2+的干扰可忽略不计。①NO与酸性KMnO4溶液反应的离子方程式为
②滴定终点的现象为
③NO的含量为
④若缺少步骤II,会使NO测定结果
⑤若滴定终点俯视读数,会使NO测定结果
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐2】亚氯酸钠(NaClO2)是一种高效杀菌剂、漂白剂,广泛用于棉纺漂白、水处理、食品消毒等,消毒时本身被还原成Cl-。亚氯酸钠晶体的一种生产工艺如图:
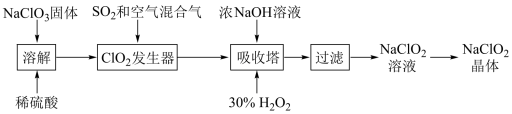
已知:①HClO3为强酸。②ClO2浓度过高时易发生分解爆炸。③NaClO2在温度高于60℃时易分解生成NaClO3和NaCl。
(1)现由浓硫酸配制240 mL“溶解”时所需的9 mol/L稀H2SO4溶液,需要用到的玻璃仪器有烧杯、玻璃棒、量筒、_______ 、_______ 。如果定容时仰视容量瓶刻度线,配制的溶液浓度会_______ (填“偏高”、“偏低”或“无影响”)。
(2)在“ClO2发生器”中,生成ClO2的离子方程式为_______ ;通入空气的作用是_______ 。
(3)“吸收塔”中H2O2在反应中作_______ (填“氧化剂”或“还原剂”)。
(4)为了测定产品中NaClO2的纯度,进行如下实验:准确称取1.000g上述产品,溶于水配成100.00mL溶液,取10.00mL待测液,加入过量KI溶液,酸性条件下发生反应: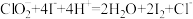 ,杂质不与I-反应。以淀粉作指示剂,再加入0.2000 mol∙L-1 Na2S2O3溶液,恰好完全反应时消耗的Na2S2O3溶液的体积为20.00mL。(已知:
,杂质不与I-反应。以淀粉作指示剂,再加入0.2000 mol∙L-1 Na2S2O3溶液,恰好完全反应时消耗的Na2S2O3溶液的体积为20.00mL。(已知: )。计算该样品的纯度为
)。计算该样品的纯度为_______ 。(填空并附计算过程)

已知:①HClO3为强酸。②ClO2浓度过高时易发生分解爆炸。③NaClO2在温度高于60℃时易分解生成NaClO3和NaCl。
(1)现由浓硫酸配制240 mL“溶解”时所需的9 mol/L稀H2SO4溶液,需要用到的玻璃仪器有烧杯、玻璃棒、量筒、
(2)在“ClO2发生器”中,生成ClO2的离子方程式为
(3)“吸收塔”中H2O2在反应中作
(4)为了测定产品中NaClO2的纯度,进行如下实验:准确称取1.000g上述产品,溶于水配成100.00mL溶液,取10.00mL待测液,加入过量KI溶液,酸性条件下发生反应:
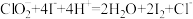 ,杂质不与I-反应。以淀粉作指示剂,再加入0.2000 mol∙L-1 Na2S2O3溶液,恰好完全反应时消耗的Na2S2O3溶液的体积为20.00mL。(已知:
,杂质不与I-反应。以淀粉作指示剂,再加入0.2000 mol∙L-1 Na2S2O3溶液,恰好完全反应时消耗的Na2S2O3溶液的体积为20.00mL。(已知: )。计算该样品的纯度为
)。计算该样品的纯度为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐3】硫代锑酸钠晶体(Na3SbS4·9H2O,M=481g·mol-1)为淡黄色晶体,不溶于乙醇、苯等有机溶剂,可溶于水,其水溶液呈强碱性,常用作生物碱试剂。实验室制备硫代锑酸钠的实验装置如图所示(夹持装置略去)。
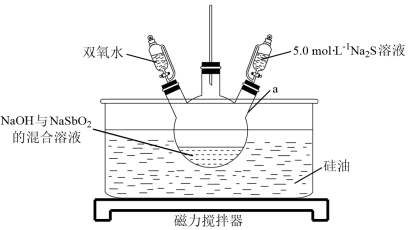
实验步骤如下:
I.按如图组装仪器,并将NaOH与NaSbO2的混合溶液加入仪器a中。
II.将硅油加热至60℃并保持恒温,缓慢滴加双氧水并不断搅拌,反应30min,制备NaSb(OH)6。
III.升高油浴温度至98~100℃,加热10min。
IV.维持温度为98~100℃,滴加5.0mol·L-1Na2S溶液,搅拌3h。
V.趁热过滤,滤液经冷却结晶、过滤、洗涤、干燥后,得到硫代锑酸钠晶体。
回答下列问题:
(1)仪器a的名称为____ ;长导管的作用为____ 。
(2)“步骤II”中,需控制反应温度为60℃的原因为____ ;“步骤III”的目的为____ 。
(3)“步骤IV”的化学方程式为____ 。
(4)“步骤V”中,洗涤晶体所选用的最佳试剂为____ (填选项字母)。
(5)硫代锑酸钠晶体中常混有Na2S杂质,实验室可采用下列实验步骤测定其纯度:
i.取9.62g硫代锑酸钠晶体与亚硫酸钠在沸水中发生反应(SbS +SO
+SO =SbS
=SbS +S2O
+S2O );
);
ii.用碳酸锌悬浊液除去硫化钠,反应一段时间后过滤;
iii.向滤液中滴加5mL淀粉溶液,用cmol·L-1的碘标准溶液滴定(I2+2S2O =2I-+S4O
=2I-+S4O )。
)。
①“步骤iii”中,达到滴定终点时的现象为____ 。
②达到滴定终点时,消耗VmL碘标准溶液,则样品中硫代锑酸钠晶体的纯度为____ %(用含c、V的代数式表示)。
③若省略“步骤ii”,会导致测得硫代锑酸钠晶体的纯度____ (填“偏低”、“偏高”或“无影响”)。

实验步骤如下:
I.按如图组装仪器,并将NaOH与NaSbO2的混合溶液加入仪器a中。
II.将硅油加热至60℃并保持恒温,缓慢滴加双氧水并不断搅拌,反应30min,制备NaSb(OH)6。
III.升高油浴温度至98~100℃,加热10min。
IV.维持温度为98~100℃,滴加5.0mol·L-1Na2S溶液,搅拌3h。
V.趁热过滤,滤液经冷却结晶、过滤、洗涤、干燥后,得到硫代锑酸钠晶体。
回答下列问题:
(1)仪器a的名称为
(2)“步骤II”中,需控制反应温度为60℃的原因为
(3)“步骤IV”的化学方程式为
(4)“步骤V”中,洗涤晶体所选用的最佳试剂为
| A.蒸馏水 | B.乙醇 | C.苯 | D.稀盐酸 |
i.取9.62g硫代锑酸钠晶体与亚硫酸钠在沸水中发生反应(SbS
 +SO
+SO =SbS
=SbS +S2O
+S2O );
);ii.用碳酸锌悬浊液除去硫化钠,反应一段时间后过滤;
iii.向滤液中滴加5mL淀粉溶液,用cmol·L-1的碘标准溶液滴定(I2+2S2O
 =2I-+S4O
=2I-+S4O )。
)。①“步骤iii”中,达到滴定终点时的现象为
②达到滴定终点时,消耗VmL碘标准溶液,则样品中硫代锑酸钠晶体的纯度为
③若省略“步骤ii”,会导致测得硫代锑酸钠晶体的纯度
您最近一年使用:0次



