水的电离平衡曲线如图所示。若以A点表示25℃时水在电离平衡时的离子浓度,当温度上升到100℃时,水的电离平衡状态为B点。
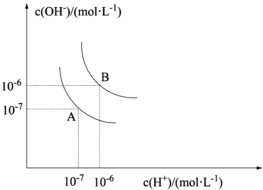
(1)在100℃时,Kw的表达式为_____ ,在此温度下,Kw的值为_____ mol2/L2.
(2)在室温下,将pH=9的Ba(OH)2溶液与pH=5的稀盐酸混合,欲使混合溶液pH=7,则Ba(OH)2溶液与盐酸的体积比为_____ ,物质的量浓度比为_____
(3)室温时将pH为3的硫酸溶液稀释5百万倍,稀释后溶液中,c( )和c(H+)之比约为
)和c(H+)之比约为_____ 。
Ⅱ.现有溶质为①CH3COOH,②HCl、③H2SO4的三种溶液,根据要求回答下列问题:
(4)写出①的电离方程式:_____ 。
(5)当它们pH相同时,其物质的量浓度最大的是_____ (填序号)。
(6)当它们的物质的量浓度相同时,其pH最小的是_____ (填序号)。
(7)在室温下,将c(H+)均为0.1mol/L的三种酸分别加水稀释至原来的10倍,c(H+)由大到小的顺序为_____ (填序号)。
(8)体积和物质的量浓度均相同的①②③三种酸溶液,分别与相同浓度的烧碱溶液恰好完全反应,所需烧碱溶液的体积比为_____ 。
(9)三种酸溶液的pH相同时,若消耗等量的Zn,则需三种酸溶液的体积大小关系为_____ (填序号)。

(1)在100℃时,Kw的表达式为
(2)在室温下,将pH=9的Ba(OH)2溶液与pH=5的稀盐酸混合,欲使混合溶液pH=7,则Ba(OH)2溶液与盐酸的体积比为
(3)室温时将pH为3的硫酸溶液稀释5百万倍,稀释后溶液中,c(
 )和c(H+)之比约为
)和c(H+)之比约为Ⅱ.现有溶质为①CH3COOH,②HCl、③H2SO4的三种溶液,根据要求回答下列问题:
(4)写出①的电离方程式:
(5)当它们pH相同时,其物质的量浓度最大的是
(6)当它们的物质的量浓度相同时,其pH最小的是
(7)在室温下,将c(H+)均为0.1mol/L的三种酸分别加水稀释至原来的10倍,c(H+)由大到小的顺序为
(8)体积和物质的量浓度均相同的①②③三种酸溶液,分别与相同浓度的烧碱溶液恰好完全反应,所需烧碱溶液的体积比为
(9)三种酸溶液的pH相同时,若消耗等量的Zn,则需三种酸溶液的体积大小关系为
更新时间:2024-04-04 02:41:05
|
相似题推荐
填空题
|
适中
(0.65)
解题方法
【推荐1】水的离子积常数Kw与温度t(℃)的关系如图所示:
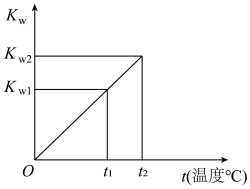
(1)若t1=25℃,则Kw1=_______ ;若t2=100℃时,Kw2=10-12,则此时0.05 mol·L-1的Ba(OH)2溶液的pH=______ ,此时溶液中水电离出的c(OH-)水=________ mol·L-1
(2)已知25℃时,0.1 L0.1 mol·L-1的NaA溶液的pH=10,则NaA溶液中所存在的平衡有:_______ 。溶液中各离子的物质的量浓度由大到小的顺序为:_______ 。
(3)25℃时,将pH=11的NaOH溶液与pH=4的硫酸溶液混合,若所得混合溶液pH=9,则NaOH溶液与硫酸溶液的体积比为______ 。

(1)若t1=25℃,则Kw1=
(2)已知25℃时,0.1 L0.1 mol·L-1的NaA溶液的pH=10,则NaA溶液中所存在的平衡有:
(3)25℃时,将pH=11的NaOH溶液与pH=4的硫酸溶液混合,若所得混合溶液pH=9,则NaOH溶液与硫酸溶液的体积比为
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】如表是不同温度下水的离子积数据:
试回答以下问题:
 若
若 ,则
,则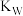
__________  填“
填“ ”、“
”、“ ”或“
”或“ ”
” ,作出此判断的理由是
,作出此判断的理由是__________ 。
 下,某
下,某 溶液中
溶液中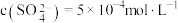 ,取该溶液
,取该溶液 ,加水稀释至
,加水稀释至 ,则稀释后溶液中
,则稀释后溶液中
__________ 。
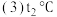 下,将
下,将 的苛性钠溶液
的苛性钠溶液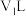 与
与 的稀硫酸
的稀硫酸 混合
混合 设混合后溶液的体积为原两溶液体积之和
设混合后溶液的体积为原两溶液体积之和 ,所得混合溶液的
,所得混合溶液的 ,则
,则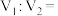
__________ 。此溶液中各种离子的浓度由大到小的排列顺序是__________________ 。
 分别向等体积、相同pH的HCl溶液和
分别向等体积、相同pH的HCl溶液和 溶液中加入足量的Zn粉,反应刚开始时产生
溶液中加入足量的Zn粉,反应刚开始时产生 的速率:
的速率: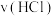
______ 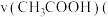 填“
填“ ”、“
”、“ ”或“
”或“ ”下同
”下同 ,反应完全后,所得氢气的质量:
,反应完全后,所得氢气的质量: 盐酸
盐酸_______  醋酸。
醋酸。
温度 | 25 |  |  |
| 水的离子积常数 |  | 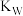 | 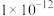 |
 若
若 ,则
,则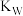
 填“
填“ ”、“
”、“ ”或“
”或“ ”
” ,作出此判断的理由是
,作出此判断的理由是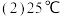 下,某
下,某 溶液中
溶液中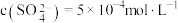 ,取该溶液
,取该溶液 ,加水稀释至
,加水稀释至 ,则稀释后溶液中
,则稀释后溶液中
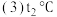 下,将
下,将 的苛性钠溶液
的苛性钠溶液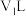 与
与 的稀硫酸
的稀硫酸 混合
混合 设混合后溶液的体积为原两溶液体积之和
设混合后溶液的体积为原两溶液体积之和 ,所得混合溶液的
,所得混合溶液的 ,则
,则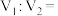
 分别向等体积、相同pH的HCl溶液和
分别向等体积、相同pH的HCl溶液和 溶液中加入足量的Zn粉,反应刚开始时产生
溶液中加入足量的Zn粉,反应刚开始时产生 的速率:
的速率: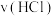
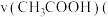 填“
填“ ”、“
”、“ ”或“
”或“ ”下同
”下同 ,反应完全后,所得氢气的质量:
,反应完全后,所得氢气的质量: 盐酸
盐酸 醋酸。
醋酸。
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐3】t℃时,某NaOH稀溶液中,c(H+)=10-amol/L,c(OH-)=10-bmol/L,已知a+b=12。
(1)该温度下,水的离子积常数Kw=________________ 。
(2)在该温度下,将100mL0.1mol/L的稀硫酸与100mL0.4mol/L的NaOH溶液混合后,溶液的pH=_________ ,此时该溶液中由水电离的c(OH-)=____________ 。
(3)该温度下,若100体积pH1=a的某强酸溶液与1体积pH2=b的某强碱溶液混合后溶液呈中性,则混合前,该强酸的pH1与强碱的pH2之间应满足的关系是______________ 。
(1)该温度下,水的离子积常数Kw=
(2)在该温度下,将100mL0.1mol/L的稀硫酸与100mL0.4mol/L的NaOH溶液混合后,溶液的pH=
(3)该温度下,若100体积pH1=a的某强酸溶液与1体积pH2=b的某强碱溶液混合后溶液呈中性,则混合前,该强酸的pH1与强碱的pH2之间应满足的关系是
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐1】在25℃时,将 的
的 溶液
溶液 与
与 的
的 溶液
溶液 混合,若所得溶液为中性,则
混合,若所得溶液为中性,则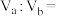
___________ 。
 的
的 溶液
溶液 与
与 的
的 溶液
溶液 混合,若所得溶液为中性,则
混合,若所得溶液为中性,则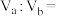
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】(1)某温度下纯水中c(H+)=2×10-7 mol/L,若温度不变,向水中滴入稀盐酸使c(H+)=5×10-6 mol/L,此时溶液中的c(OH-)=___ 8×10-9 mol/L,滴入盐酸后水的离子积______ 不变(填“变大”“变小”或“不变”,下同),水的电离度__________ 变小
(2)今有A. CH3COOH B. HCl C. H2SO4三种溶液,
①当它们pH相同时,其物质的量浓度由大到小是_______________ A>B>C(用字母表示,下同);
②体积和物质的量浓度相同的三种溶液,分别与同浓度的烧碱溶液恰好完全反应,所需烧碱溶液的体积由大到小为_______
(3)体积相同pH均等于12的氨水和NaOH溶液,分别加水稀释m倍、n倍,溶液的pH都变成9,则m与n的关系为_____________
(2)今有A. CH3COOH B. HCl C. H2SO4三种溶液,
①当它们pH相同时,其物质的量浓度由大到小是
②体积和物质的量浓度相同的三种溶液,分别与同浓度的烧碱溶液恰好完全反应,所需烧碱溶液的体积由大到小为
(3)体积相同pH均等于12的氨水和NaOH溶液,分别加水稀释m倍、n倍,溶液的pH都变成9,则m与n的关系为
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐3】Ⅰ.水在25℃和95℃时电离平衡曲线如图。

(1)25℃时水的电离平衡曲线应为___________ (“A”或“B”)。
(2)95℃时,若100体积pH=a的某强酸溶液与1体积pH=b的某强碱溶液混合后溶液呈中性;则a与b之间应满足的关系是___________ 。
(3)曲线A所对应的温度下,pH=2的HCl溶液和pH=11的某BOH溶液中,若水的电离程度分别用ɑ1、ɑ2表示,则ɑ1___________ ɑ2(填“大于”“小于”“等于”“无法确定”)
Ⅱ.醋酸钠一种常见的强碱弱酸盐
(4)醋酸钠在水溶液中水解的离子方程式___________ 。
(5)将物质的量浓度相同的盐酸与氨水混合后,溶液中的呈中性,则盐酸的体积___________ 氨水的体积(填“>”“<””或“=”)。
(6)pH相等的NaOH溶液与CH3COONa溶液,分别加热到相同的温度后,CH3COONa溶液的pH___________ NaOH溶液的pH(填“>”“<””或“=”)。

(1)25℃时水的电离平衡曲线应为
(2)95℃时,若100体积pH=a的某强酸溶液与1体积pH=b的某强碱溶液混合后溶液呈中性;则a与b之间应满足的关系是
(3)曲线A所对应的温度下,pH=2的HCl溶液和pH=11的某BOH溶液中,若水的电离程度分别用ɑ1、ɑ2表示,则ɑ1
Ⅱ.醋酸钠一种常见的强碱弱酸盐
(4)醋酸钠在水溶液中水解的离子方程式
(5)将物质的量浓度相同的盐酸与氨水混合后,溶液中的呈中性,则盐酸的体积
(6)pH相等的NaOH溶液与CH3COONa溶液,分别加热到相同的温度后,CH3COONa溶液的pH
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐1】在一定温度下,有a.盐酸 b.硫酸 c.醋酸三种酸:
(1)若三者c(H+)相同时,物质的量浓度由大到小的顺序是____________ 。
(2)同体积、同物质的量浓度的三种酸,中和NaOH的能力由大到小的顺序是______________ 。
(3)当三种酸物质的量浓度相同时,c(H+)由大到小的顺序是__________ 。
(4)当三者c(H+)相同且体积也相同时,分别放入足量的锌,相同状况下产生气体的体积由大到小的顺序是__________________ 。
(5)将c(H+)相同的三种酸均加水稀释至原来的100倍后,c(H+)由大到小的顺序是____________ 。
(6)当c(H+)相同、体积相同时,同时加入形状、密度、质量完全相同的锌,若产生相同体积的H2(相同状况),则开始时反应速率的大小关系为_______ 。反应所需时间的长短关系是________ 。
(1)若三者c(H+)相同时,物质的量浓度由大到小的顺序是
(2)同体积、同物质的量浓度的三种酸,中和NaOH的能力由大到小的顺序是
(3)当三种酸物质的量浓度相同时,c(H+)由大到小的顺序是
(4)当三者c(H+)相同且体积也相同时,分别放入足量的锌,相同状况下产生气体的体积由大到小的顺序是
(5)将c(H+)相同的三种酸均加水稀释至原来的100倍后,c(H+)由大到小的顺序是
(6)当c(H+)相同、体积相同时,同时加入形状、密度、质量完全相同的锌,若产生相同体积的H2(相同状况),则开始时反应速率的大小关系为
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】按要求回答下列问题:
(1)向 醋酸溶液中加入少量水,
醋酸溶液中加入少量水,
_____ (填“增大”“减小”或“不变”,下同),
_____ 。
(2)500mL 醋酸溶液a、500mL
醋酸溶液a、500mL 盐酸溶液b分别与足量Zn粉充分反应,初始反应速率a
盐酸溶液b分别与足量Zn粉充分反应,初始反应速率a_____ b(填“<”“>”或“=”,下同),溶液的导电能力a_____ b;最终产生氢气的质量a_____ b.
(3)已知25℃时部分弱电解质的电离平衡常数数据如表所示:
以下说法不正确的是_____(填字母)。
(4)向NaCN溶液中通入过量 气体,发生反应的离子方程式是
气体,发生反应的离子方程式是_____ 。
(1)向
 醋酸溶液中加入少量水,
醋酸溶液中加入少量水,

(2)500mL
 醋酸溶液a、500mL
醋酸溶液a、500mL 盐酸溶液b分别与足量Zn粉充分反应,初始反应速率a
盐酸溶液b分别与足量Zn粉充分反应,初始反应速率a(3)已知25℃时部分弱电解质的电离平衡常数数据如表所示:
| 化学式 |  |  | HClO | HCN |
| 电离平衡常数 |  | 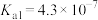  |  | 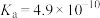 |
| A.向弱酸溶液中加入少量NaOH溶液,电离平衡常数变大 |
| B.多元弱酸的酸性主要由第一步电离决定 |
C.表中四种酸,酸性最强的是 |
D.向NaClO溶液中通入 气体,可以生成HClO 气体,可以生成HClO |
 气体,发生反应的离子方程式是
气体,发生反应的离子方程式是
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐3】现有①CH3COOH、②HCl两种溶液,用A、B、C选择填空:A.①>②;B.①<②;C.①=②。
(1)当它们pH相同时,其物质的量浓度_________ 。
(2)当它们的物质的量浓度相同时,其pH的关系是_________ 。
(3)中和等体积、等物质的量浓度的烧碱溶液,需同物质的量浓度的两种酸溶液的体积关系为_________ 。
(4)当它们pH相同、体积相同时,分别加入足量锌,相同状况下产生气体体积关系为_________ 。
(5)将pH相同的两种酸均稀释10倍后,pH关系为_________ 。
(1)当它们pH相同时,其物质的量浓度
(2)当它们的物质的量浓度相同时,其pH的关系是
(3)中和等体积、等物质的量浓度的烧碱溶液,需同物质的量浓度的两种酸溶液的体积关系为
(4)当它们pH相同、体积相同时,分别加入足量锌,相同状况下产生气体体积关系为
(5)将pH相同的两种酸均稀释10倍后,pH关系为
您最近一年使用:0次



