氢化镁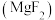 晶体广泛应用在光学、冶金、国防、医疗等领域。
晶体广泛应用在光学、冶金、国防、医疗等领域。
I.氟化镁晶胞是长方体,其结构如图所示:_______ 区(填“ ”“
”“ ”或“
”或“ ”)。
”)。
(2) 晶胞示意图中:离子半径:
晶胞示意图中:离子半径: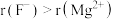 ,结合离子结构示意图解释原因:
,结合离子结构示意图解释原因:_____ 。
II.一种由 制备
制备 的工艺流程如图
的工艺流程如图
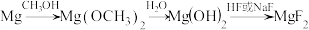
已知:ⅰ. 易溶于甲醇;
易溶于甲醇;
ⅱ.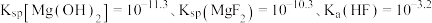
(3)上述流程中,可循环利用的物质是_______ 。
(4)比较相同条件下化学反应速率的大小:① 与
与 ;②
;② 与
与 。
。
 小组同学预测化学反应速率:①
小组同学预测化学反应速率:① ②,理由是甲基为
②,理由是甲基为_______ 基团,导致 键极性:
键极性: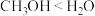 。
。
 实验表明化学反应速率:①
实验表明化学反应速率:① ②,分析其原因可能是
②,分析其原因可能是_______ 。
(5)上述流程中 开始转化为
开始转化为 所需氟化物的浓度:
所需氟化物的浓度: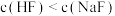 。结合沉淀溶解平衡分析原因:
。结合沉淀溶解平衡分析原因:_______ 。
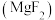 晶体广泛应用在光学、冶金、国防、医疗等领域。
晶体广泛应用在光学、冶金、国防、医疗等领域。I.氟化镁晶胞是长方体,其结构如图所示:
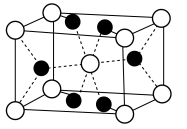
 ”“
”“ ”或“
”或“ ”)。
”)。(2)
 晶胞示意图中:离子半径:
晶胞示意图中:离子半径: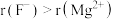 ,结合离子结构示意图解释原因:
,结合离子结构示意图解释原因:II.一种由
 制备
制备 的工艺流程如图
的工艺流程如图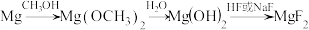
已知:ⅰ.
 易溶于甲醇;
易溶于甲醇;ⅱ.
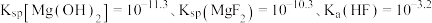
(3)上述流程中,可循环利用的物质是
(4)比较相同条件下化学反应速率的大小:①
 与
与 ;②
;② 与
与 。
。 小组同学预测化学反应速率:①
小组同学预测化学反应速率:① ②,理由是甲基为
②,理由是甲基为 键极性:
键极性: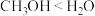 。
。 实验表明化学反应速率:①
实验表明化学反应速率:① ②,分析其原因可能是
②,分析其原因可能是(5)上述流程中
 开始转化为
开始转化为 所需氟化物的浓度:
所需氟化物的浓度: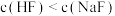 。结合沉淀溶解平衡分析原因:
。结合沉淀溶解平衡分析原因:
更新时间:2024-04-21 12:13:51
|
相似题推荐
填空题
|
适中
(0.65)
【推荐1】研究碳、氮、硫及其化合物的转化对改善环境有重大意义。回答下列问题:
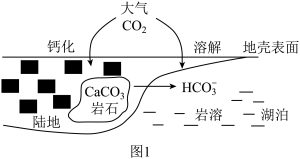
(1)某处碳循环如图1所示,CaCO3转化为HCO 的离子方程式为
的离子方程式为____ 。结合平衡移动原理分析CaCO3溶解的原因_____ 。
(2)利用“亚硫酸盐法”吸收工业废气中的SO2。常温下,将工业废气通入(NH4)2SO3溶液中,测得溶液pH与含硫组分物质的量分数[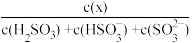 ]的变化关系如图2所示。
]的变化关系如图2所示。
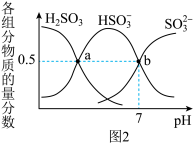
①Ka2(H2SO3)=_____ 。b点溶液中n(NH ):n(SO
):n(SO )=
)=____ 。
②常温下,Ka1(H2SO3)=1.5×10-2;Kb(NH3•H2O)=1.8×10-5。0.1mol•L-1的(NH4)2SO3溶液中离子浓度由大到小的顺序为____ (不考虑OH-)。
(3)尿素溶于水缓慢水解产生碳酸铵,碳酸铵溶液显碱性,原因是____ 。向浓度均为0.1mol•L-1的CdCl2和ZnCl2混合液中滴加碳酸铵溶液,当加入碳酸铵溶液至生成两种沉淀,则溶液中c(Zn2+):c(Cd2+)=____ 。[已知Ksp(CdCO3)=1.0×10-12,Ksp(ZnCO3)=1.5×10-10]
(4)工业废水中含有甲醛,某厂降解甲醛的反应机理如图3所示,则X表示的粒子是_____ 。

(1)某处碳循环如图1所示,CaCO3转化为HCO
 的离子方程式为
的离子方程式为
(2)利用“亚硫酸盐法”吸收工业废气中的SO2。常温下,将工业废气通入(NH4)2SO3溶液中,测得溶液pH与含硫组分物质的量分数[
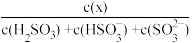 ]的变化关系如图2所示。
]的变化关系如图2所示。
①Ka2(H2SO3)=
 ):n(SO
):n(SO )=
)=②常温下,Ka1(H2SO3)=1.5×10-2;Kb(NH3•H2O)=1.8×10-5。0.1mol•L-1的(NH4)2SO3溶液中离子浓度由大到小的顺序为
(3)尿素溶于水缓慢水解产生碳酸铵,碳酸铵溶液显碱性,原因是
(4)工业废水中含有甲醛,某厂降解甲醛的反应机理如图3所示,则X表示的粒子是

您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐2】请运用所学知识判断,向1 mL0.1 mol/LAgNO3溶液中依次滴加1 mL0.1 mol/L的NaCl、NaBr、KI溶液时,会发生什么变化________ 。
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐3】沉淀溶解平衡在生产、科研和环保等领域有着许多应用。
(1)除去硫酸铜溶液中混有的少量铁离子,可向溶液中加入Cu(OH)2,调节溶液的PH,铁离子就会全部转化为Fe(OH)3沉淀除去。
已知:常温下Fe(OH)3的溶度积Ksp=8.0×10-38,Cu(OH)2的溶度积Ksp=3.0×10-20,通常认为残留在溶液中的离子浓度小等于1×10-5 mol•L-1时就认为沉淀完全,设溶液中CuSO4的浓度为3.0mol•L-1,通过计算确定应调节溶液的pH范围是______ 。(已知lg5=0.7)
(2)为了研究沉淀溶解平衡和沉淀转化,某同学查阅资料并设计如下实验。
资料:AgSCN是白色沉淀,相同温度下,溶解度AgSCN>AgI
①写出步骤2中溶液变为红色的离子方程式:____________________ 。
②步骤3中现象a是____________________________ 。
③用化学平衡原理解释步骤4中的实验现象:_________________________________ 。
(1)除去硫酸铜溶液中混有的少量铁离子,可向溶液中加入Cu(OH)2,调节溶液的PH,铁离子就会全部转化为Fe(OH)3沉淀除去。
已知:常温下Fe(OH)3的溶度积Ksp=8.0×10-38,Cu(OH)2的溶度积Ksp=3.0×10-20,通常认为残留在溶液中的离子浓度小等于1×10-5 mol•L-1时就认为沉淀完全,设溶液中CuSO4的浓度为3.0mol•L-1,通过计算确定应调节溶液的pH范围是
(2)为了研究沉淀溶解平衡和沉淀转化,某同学查阅资料并设计如下实验。
资料:AgSCN是白色沉淀,相同温度下,溶解度AgSCN>AgI
| 操作步骤 | 现象 |
| 步骤1:向2 mL 0.005 mol·L-1 AgNO3溶液中加入2 mL 0.005 mol·L-1 KSCN溶液,静置 | 出现白色沉淀 |
| 步骤2:取1 mL上层清液于试管中,滴加1滴2 mol·L-1 Fe(NO3)3溶液 | 溶液变为红色 |
| 步骤3:向步骤2的溶液中继续加入5滴3 mol·L-1 AgNO3溶液 | 现象a,溶液红色变浅 |
| 步骤4:向步骤1余下的浊液中加入5滴3 mol·L-1 KI溶液 | 出现黄色沉淀 |
①写出步骤2中溶液变为红色的离子方程式:
②步骤3中现象a是
③用化学平衡原理解释步骤4中的实验现象:
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐1】 、
、 、
、 、
、 、
、 代表
代表 种短周期元素,已知
种短周期元素,已知 、
、 、
、 处于相邻位置,
处于相邻位置, 、
、 同周期,
同周期, 、
、 同主族,其核外电子数之和为
同主族,其核外电子数之和为 、
、 为同一周期,
为同一周期,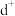 中各层电子数都是
中各层电子数都是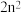 个,
个, 、
、 、
、 、
、 、
、 各元素最外层电子数和为
各元素最外层电子数和为 ,已知
,已知 和
和 形成
形成 种化合物
种化合物_______ 。
 、
、 、
、 、
、 、
、 代表
代表 种短周期元素,已知
种短周期元素,已知 、
、 、
、 处于相邻位置,
处于相邻位置, 、
、 同周期,
同周期, 、
、 同主族,其核外电子数之和为
同主族,其核外电子数之和为 、
、 为同一周期,
为同一周期,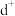 中各层电子数都是
中各层电子数都是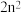 个,
个, 、
、 、
、 、
、 、
、 各元素最外层电子数和为
各元素最外层电子数和为 ,已知
,已知 和
和 形成
形成 种化合物
种化合物
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】铜是人类最早发现的金属,也是人类广泛使用的一种金属。铜及其化合物在工业、工程技术和工艺上有着广泛的应用。
(1)早期发现的天然准晶颗粒由Cu、Fe、Al三种金属元素组成。Fe元素位于元素周期表的____ 区。基态Al原子的L层电子排布图为___________ 。
(2)Cu2O为半导体材料,可由乙醛(CH3CHO)和新制氢氧化铜反应得到,同时可得到乙酸。乙醛中碳原子的杂化轨道类型为_________ ,1mol乙酸分子中含有的σ键的数目为____________ 。
(3)制造单晶硅太阳能电池片时,一般掺杂微量的铜、碳、硼、氮等。一价铜离子的电子排布式为____ 。碳、硼、氮元素的电负性由大到小的顺序是_____ 。(用元素符号表示)
(4)在络离子[Cu(NH3)4]2+中NH3的VSEPR模型为_________ 。
(5)铜银合金晶体具有面心立方最密堆积结构。在晶胞中,Cu原子位于面心,Ag原子位于顶点,若该晶胞边长为r pm,则合金的密度为____ g·cm-3(设阿伏伽德罗常数的值为NA)。
(1)早期发现的天然准晶颗粒由Cu、Fe、Al三种金属元素组成。Fe元素位于元素周期表的
(2)Cu2O为半导体材料,可由乙醛(CH3CHO)和新制氢氧化铜反应得到,同时可得到乙酸。乙醛中碳原子的杂化轨道类型为
(3)制造单晶硅太阳能电池片时,一般掺杂微量的铜、碳、硼、氮等。一价铜离子的电子排布式为
(4)在络离子[Cu(NH3)4]2+中NH3的VSEPR模型为
(5)铜银合金晶体具有面心立方最密堆积结构。在晶胞中,Cu原子位于面心,Ag原子位于顶点,若该晶胞边长为r pm,则合金的密度为
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐3】I. 填空:
(1)写出表示含有8个质子、10个中子的原子的化学符号:_________ 。
(2)元素周期表中位于第8纵行的铁元素属于_________ 族。
(3)元素周期表中最活泼的非金属元素位于第_________ 纵行。
(4)所含元素超过18种的周期是第_________ 周期。
II. 4种相邻主族短周期元素的相对位置如表,元素x的原子核外电子数是m的2倍,y的氧化物具有两性。
(1)元素x在周期表中的位置是第________ 周期、第________ 族。
(2)四种元素最高价氧化物的水化物中,酸性最强的是_____ ,碱性最强的是_____ (填化学式)。
(1)写出表示含有8个质子、10个中子的原子的化学符号:
(2)元素周期表中位于第8纵行的铁元素属于
(3)元素周期表中最活泼的非金属元素位于第
(4)所含元素超过18种的周期是第
II. 4种相邻主族短周期元素的相对位置如表,元素x的原子核外电子数是m的2倍,y的氧化物具有两性。
| m | n | ||
| x | y |
(1)元素x在周期表中的位置是第
(2)四种元素最高价氧化物的水化物中,酸性最强的是
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐1】下表为元素周期表的一部分,请根据元素①~⑧所处的位置回答下列问题:
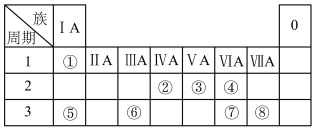
(1)元素④⑤⑧的离子半径由大到小的顺序为_______ (用离子符号表示)。
(2)元素⑦的原子结构示意图为_______ ,元素④⑦的最简单氢化物的稳定性关系为_______ (用化学式表示)。
(3)由元素④⑤组成原子个数比为1:1的化合物中含_______ (填“离子键”、“共价键”或“离子键和共价键”),将78g该化合物投入98g水中,所得溶液的质量分数为_______ 。
(4)元素②⑦⑧的最高价含氧酸的酸性最强的是_______ (填化学式),该酸与元素⑥的最高价氧化物对应的水化物反应的离子方程式是_______ 。
(5)由元素①③组成的含 和
和 的分子的电子式分别是
的分子的电子式分别是_______ 、_______ 。

(1)元素④⑤⑧的离子半径由大到小的顺序为
(2)元素⑦的原子结构示意图为
(3)由元素④⑤组成原子个数比为1:1的化合物中含
(4)元素②⑦⑧的最高价含氧酸的酸性最强的是
(5)由元素①③组成的含
 和
和 的分子的电子式分别是
的分子的电子式分别是
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】下表是部分元素周期表的结构图,请根据要求回答下列问题。
(1)以上元素的最高价氧化物对应的水化物中,酸性最强的酸是_______ (填化学式)。
(2)元素④、⑤所形成的简单离子半径较大的是_______ (用化学符号表示)。
(3)由①、③、⑧三种元素以原子个数比4:1:1形成的化合物中含有的化学键类型是_____ 。
(4)A、B均为以上某两种元素组成的含四个原子核的分子,A中有10个电子,B中有18个电子,则A的电子式_____ ,B的结构式_____ 。
(5)元素⑤、⑥的最高价氧化物对应水化物之间反应的离子方程式_______ 。
(6)已知周期表中存在对角相似规则,如Li与Mg在周期表中处于对角线位置则化学性质相似。根据“对角线规则”,铍(Be)的性质与上述六种元素中的_______ (填名称)相似,能溶于氢氧化钠溶液,请写出氢氧化铍与氢氧化钠溶液反应的化学方程式_______ 。
族 周期 | IA | 0 | ||||||
| 1 | ① | IIA | IIIA | IVA | VA | VIA | VIIA | |
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ||||
(2)元素④、⑤所形成的简单离子半径较大的是
(3)由①、③、⑧三种元素以原子个数比4:1:1形成的化合物中含有的化学键类型是
(4)A、B均为以上某两种元素组成的含四个原子核的分子,A中有10个电子,B中有18个电子,则A的电子式
(5)元素⑤、⑥的最高价氧化物对应水化物之间反应的离子方程式
(6)已知周期表中存在对角相似规则,如Li与Mg在周期表中处于对角线位置则化学性质相似。根据“对角线规则”,铍(Be)的性质与上述六种元素中的
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐3】下表为元素周期表的一部分,列出10种元素在周期表中的位置。用化学符号回答下列问题:
(1)10种元素中,第一电离能最大的元素是___________ ,电负性最小的金属元素是___________ 。
(2)①③⑤三种元素最高价氧化物对应的水化物中,碱性最强的是___________ 。
(3)②③④三种元素形成的离子,离子半径由大到小的顺序是___________ 。
(4)①和⑨的最高价氧化物对应水化物的化学式分别为___________ 、___________ 。
(5)①和⑤的最高价氧化物对应水化物相互反应的离子方程式为___________ 。
(6)用电子式表示第三周期元素中由电负性最小的元素和电负性最大的元素形成化合物的过程:___________ 。
(7)⑨元素的价层电子轨道表示式为___________ 。
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
| 第二周期 | ⑥ | ⑦ | ||||||
| 第三周期 | ① | ③ | ⑤ | ⑧ | ⑩ | |||
| 第四周期 | ② | ④ | ⑨ |
(2)①③⑤三种元素最高价氧化物对应的水化物中,碱性最强的是
(3)②③④三种元素形成的离子,离子半径由大到小的顺序是
(4)①和⑨的最高价氧化物对应水化物的化学式分别为
(5)①和⑤的最高价氧化物对应水化物相互反应的离子方程式为
(6)用电子式表示第三周期元素中由电负性最小的元素和电负性最大的元素形成化合物的过程:
(7)⑨元素的价层电子轨道表示式为
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐1】2022年9月,中国科学家首次在嫦娥五号带回的月壤中发现新矿物,并命名为“嫦娥石”。“嫦娥石”属于陨磷钠镁钙石族,其中一种物质的化学式为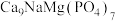 。请回答下列问题:
。请回答下列问题:
(1)钠在火焰上灼烧的黄光是一种_______ (填字母)。
a.吸收光谱 b.发射光谱
(2)某同学把O原子价电子的轨道表示式写成了以下形式: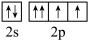 ,这种写法违背了
,这种写法违背了_______ 。
(3)P原子最高能级电子的电子云轮廓形状为_______ ,其价电子排布式为_______ ,电负性P_______ O(填“>”或“<”)。
(4)PCl3分子空间结构为_______ ,PCl3与Cl2反应生成PCl5,PCl5结构为 ,PCl5是
,PCl5是_______ 分子(填“极性”或“非极性”),其中P原子的杂化类型是_______ (填字母序号)。
a.sp b.sp2 c.sp3 d.sp3d
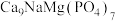 。请回答下列问题:
。请回答下列问题:(1)钠在火焰上灼烧的黄光是一种
a.吸收光谱 b.发射光谱
(2)某同学把O原子价电子的轨道表示式写成了以下形式:
 ,这种写法违背了
,这种写法违背了(3)P原子最高能级电子的电子云轮廓形状为
(4)PCl3分子空间结构为
 ,PCl5是
,PCl5是a.sp b.sp2 c.sp3 d.sp3d
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】(1)柠檬酸的结构简式如图甲, 柠檬酸分子中碳原子与氧原子形成的
柠檬酸分子中碳原子与氧原子形成的 键的数目为
键的数目为_______  。
。
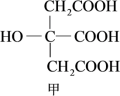
(2) 中,存在
中,存在_______ (填序号)。
A.离子键 B. 键 C.
键 C. 键 D.氢键
键 D.氢键
(3) 具有较高的熔点(872℃),其化学键类型是
具有较高的熔点(872℃),其化学键类型是_______ ; 不溶于有机溶剂而
不溶于有机溶剂而 、
、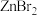 、
、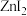 能够溶于乙醇、乙醚等有机溶剂,原因是
能够溶于乙醇、乙醚等有机溶剂,原因是_______ 。
(4) 分子中
分子中 键与
键与 键的数目比
键的数目比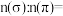
_______ 。
 柠檬酸分子中碳原子与氧原子形成的
柠檬酸分子中碳原子与氧原子形成的 键的数目为
键的数目为 。
。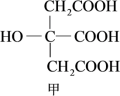
(2)
 中,存在
中,存在A.离子键 B.
 键 C.
键 C. 键 D.氢键
键 D.氢键(3)
 具有较高的熔点(872℃),其化学键类型是
具有较高的熔点(872℃),其化学键类型是 不溶于有机溶剂而
不溶于有机溶剂而 、
、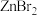 、
、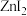 能够溶于乙醇、乙醚等有机溶剂,原因是
能够溶于乙醇、乙醚等有机溶剂,原因是(4)
 分子中
分子中 键与
键与 键的数目比
键的数目比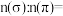
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐3】在极性分子中,正电荷重心与负电荷重心间的距离称为偶极长,通常用 表示。极性分子的极性强弱与偶极长和电荷量(
表示。极性分子的极性强弱与偶极长和电荷量(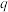 )有关,一般用偶极矩(
)有关,一般用偶极矩(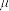 )来衡量。分子的偶极矩是偶极长和电荷量的乘积,即
)来衡量。分子的偶极矩是偶极长和电荷量的乘积,即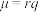 。在非极性分子中,其正、负电荷重心重合,故
。在非极性分子中,其正、负电荷重心重合,故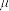 为0。试回答下列问题:
为0。试回答下列问题:
(1)HCl、CS2、H2S、SO2四种分子中 的有
的有______________________________ 。
(2)实验测得: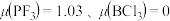
①由此可知,PF3分子的空间构型为____________________ ;
②BCl3分子的空间构型为____________________ ,中心原子的杂化方式为____________________ 。
(3)治癌药物 具有平面四边形结构,Pt处在四边形中心,NH3和Cl分别处在四边形的4个顶点。已知该化合物有两种同分异构体,棕黄色化合物的
具有平面四边形结构,Pt处在四边形中心,NH3和Cl分别处在四边形的4个顶点。已知该化合物有两种同分异构体,棕黄色化合物的 ,淡黄色化合物的
,淡黄色化合物的 。试写出两种同分异构体的结构简式:
。试写出两种同分异构体的结构简式:____________________ (棕黄色)、____________________ (淡黄色),在水中溶解度较大的是____________________ (填结构简式)。
 表示。极性分子的极性强弱与偶极长和电荷量(
表示。极性分子的极性强弱与偶极长和电荷量(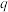 )有关,一般用偶极矩(
)有关,一般用偶极矩(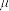 )来衡量。分子的偶极矩是偶极长和电荷量的乘积,即
)来衡量。分子的偶极矩是偶极长和电荷量的乘积,即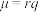 。在非极性分子中,其正、负电荷重心重合,故
。在非极性分子中,其正、负电荷重心重合,故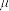 为0。试回答下列问题:
为0。试回答下列问题:(1)HCl、CS2、H2S、SO2四种分子中
 的有
的有(2)实验测得:
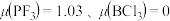
①由此可知,PF3分子的空间构型为
②BCl3分子的空间构型为
(3)治癌药物
 具有平面四边形结构,Pt处在四边形中心,NH3和Cl分别处在四边形的4个顶点。已知该化合物有两种同分异构体,棕黄色化合物的
具有平面四边形结构,Pt处在四边形中心,NH3和Cl分别处在四边形的4个顶点。已知该化合物有两种同分异构体,棕黄色化合物的 ,淡黄色化合物的
,淡黄色化合物的 。试写出两种同分异构体的结构简式:
。试写出两种同分异构体的结构简式:
您最近一年使用:0次



