X、Y、Z、P、Q是原子序数依次增大的短周期主族元素,其中X的一种核素没有中子,Y的单质是空气的主要成分,Z和Q同主族且Q的原子序数是Z的二倍,在短周期元素中P的金属性最强。回答下列问题:
(1)X、Y、Z三种元素的原子半径从大到小的顺序为_______ (用元素符号表示)。
(2)Y、Z的简单氢化物中较不稳定的是_______ (填化学式),P和Q的最高价氧化物对应水化物的化学方程式为_______ 。
(3)M是由X、Z两种元素组成的含有10个电子的分子,M的电子式为_______ ,M分解反应过程中,反应物中化学键断裂吸收的总能量_______ 生成物中化学键形成放出的能量(填“大于”、“小于”或“等于”)。
(4)已知化合物PX与水反应生成氢气,因此可将其用作野外生存的生氢剂。
①该反应的化学方程式为_______ 。
②该反应中的氧化剂是_______ 还原剂是_______ 。
③反应中涉及到化学键的断裂和形成,其中包括_______ 填序号)。
a.离子键 b.极性共价键 c.非极性共价键 d.氢键
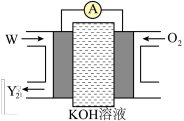
(5)化合物W是由X、Y两种元素组成的含有18个电子的分子,是一种应用广泛的化工原料,常用作火箭和燃料电池的燃料,一种W燃料电池的工作原理如下图所示。放电一段时间,电解质溶液中OH﹣的物质的量浓度_______ (填“增大”“减小”或“不变”),负极反应式为_______ 。
(1)X、Y、Z三种元素的原子半径从大到小的顺序为
(2)Y、Z的简单氢化物中较不稳定的是
(3)M是由X、Z两种元素组成的含有10个电子的分子,M的电子式为
(4)已知化合物PX与水反应生成氢气,因此可将其用作野外生存的生氢剂。
①该反应的化学方程式为
②该反应中的氧化剂是
③反应中涉及到化学键的断裂和形成,其中包括
a.离子键 b.极性共价键 c.非极性共价键 d.氢键
(5)化合物W是由X、Y两种元素组成的含有18个电子的分子,是一种应用广泛的化工原料,常用作火箭和燃料电池的燃料,一种W燃料电池的工作原理如下图所示。放电一段时间,电解质溶液中OH﹣的物质的量浓度
更新时间:2024-05-08 06:05:25
|
相似题推荐
解答题-原理综合题
|
较易
(0.85)
名校
解题方法
【推荐1】甲醛有毒,被世界卫生组织列为一类致癌物。但甲醛是重要的工业原料,在化工、纺织、医疗等领域有广泛应用。
Ⅰ.回收利用 是一种减弱温室效应的有效途径。科学家研究发现可利用回收的
是一种减弱温室效应的有效途径。科学家研究发现可利用回收的 与
与 反应制备甲醛。
反应制备甲醛。
已知:①甲醛的燃烧热为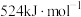
② 的燃烧热为
的燃烧热为
③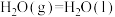
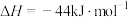
(1) 与
与 制备甲醛的反应:
制备甲醛的反应:

_______ 。
(2)在2L恒容密闭容器中通入0.2mol 和0.4mol
和0.4mol ,在三种不同条件下发生(1)中反应,测得
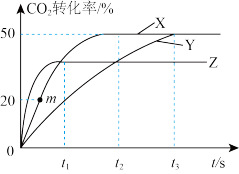
,在三种不同条件下发生(1)中反应,测得 的转化率与时间的关系如图所示。曲线X对应温度下反应的平衡常数K=
的转化率与时间的关系如图所示。曲线X对应温度下反应的平衡常数K=_______ ,由曲线Y到曲线X采取的措施可能是_______ ;由曲线Z到曲线X采取的措施可能是_______ 。
(3)反应速率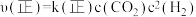 ,
,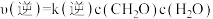 ,
, 、
、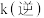 分别为正、逆向反应速率常数,计算m点
分别为正、逆向反应速率常数,计算m点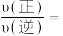
_______ 。
Ⅱ.甲醇直接脱氢是工业上合成甲醛的一种新方法,该法得到无水甲醛的同时得到副产品氢气。
(4)在一个2L恒容密闭容器中投入2mol ,在催化剂作用下发生反应:
,在催化剂作用下发生反应: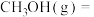
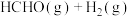
 ,同时存在副反应:
,同时存在副反应: 。
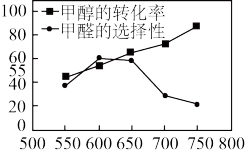
。 。20min后,测得甲醇的转化率与甲醛的选择性分别与温度的关系如图所示。温度高于650℃,甲醇的转化率升高,甲醛的产率
。20min后,测得甲醇的转化率与甲醛的选择性分别与温度的关系如图所示。温度高于650℃,甲醇的转化率升高,甲醛的产率_______ ,原因可能是_______ 。
(5)甲醛被称为室内污染“第一杀手”。室内甲醛的含量可以通过传感器来监测。一种燃料电池型甲醛气体传感器的工作原理如图所示,则a电极反应式为_______ 。国家标准是室内甲醛不能超过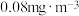 ,传感器在
,传感器在 室内空间测定,电路中有
室内空间测定,电路中有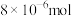 电子通过,该室内甲醛含量为
电子通过,该室内甲醛含量为_______ 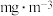 。
。

Ⅰ.回收利用
 是一种减弱温室效应的有效途径。科学家研究发现可利用回收的
是一种减弱温室效应的有效途径。科学家研究发现可利用回收的 与
与 反应制备甲醛。
反应制备甲醛。已知:①甲醛的燃烧热为
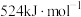
②
 的燃烧热为
的燃烧热为
③
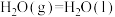
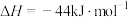
(1)
 与
与 制备甲醛的反应:
制备甲醛的反应:

(2)在2L恒容密闭容器中通入0.2mol
 和0.4mol
和0.4mol ,在三种不同条件下发生(1)中反应,测得
,在三种不同条件下发生(1)中反应,测得 的转化率与时间的关系如图所示。曲线X对应温度下反应的平衡常数K=
的转化率与时间的关系如图所示。曲线X对应温度下反应的平衡常数K=
(3)反应速率
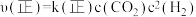 ,
,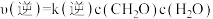 ,
, 、
、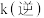 分别为正、逆向反应速率常数,计算m点
分别为正、逆向反应速率常数,计算m点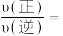
Ⅱ.甲醇直接脱氢是工业上合成甲醛的一种新方法,该法得到无水甲醛的同时得到副产品氢气。
(4)在一个2L恒容密闭容器中投入2mol
 ,在催化剂作用下发生反应:
,在催化剂作用下发生反应: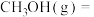
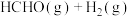
 ,同时存在副反应:
,同时存在副反应: 。
。 。20min后,测得甲醇的转化率与甲醛的选择性分别与温度的关系如图所示。温度高于650℃,甲醇的转化率升高,甲醛的产率
。20min后,测得甲醇的转化率与甲醛的选择性分别与温度的关系如图所示。温度高于650℃,甲醇的转化率升高,甲醛的产率
(5)甲醛被称为室内污染“第一杀手”。室内甲醛的含量可以通过传感器来监测。一种燃料电池型甲醛气体传感器的工作原理如图所示,则a电极反应式为
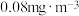 ,传感器在
,传感器在 室内空间测定,电路中有
室内空间测定,电路中有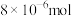 电子通过,该室内甲醛含量为
电子通过,该室内甲醛含量为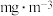 。
。
您最近一年使用:0次
解答题-原理综合题
|
较易
(0.85)
解题方法
【推荐2】现代社会人类的一切活动都离不开能量,许多能量的利用与化学反应中的能量变化密切相关。
Ⅰ.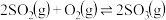 是工业制硫酸的主要反应之一,研究该反应的速率和限度有着重要的现实意义。
是工业制硫酸的主要反应之一,研究该反应的速率和限度有着重要的现实意义。
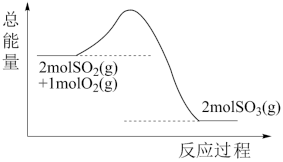
(1)反应过程的能量变化如图所示,该反应为_______ (填“放热”或“吸热”)反应。
(2)一定条件下,在2L密闭容器中加入4mol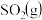 、6mol
、6mol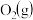 和2mol
和2mol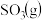 发生上述反应,在2min末达到平衡,测得
发生上述反应,在2min末达到平衡,测得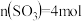 。
。
①0~2min内的平均反应速率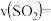
_______  。
。
②2min末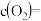
_______  。
。
③若其他条件不变,将容器的容积扩大至3L,该化学反应速率将_______ (填“增大”“不变”或“减小”)。
④恒温恒容下,能说明该反应达到化学平衡状态的是_______ (填字母序号)。
a.
b.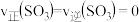
c.混合气体的压强不再变化
d.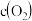 不再变化
不再变化
e.单位时间内生成nmol 的同时生成2nmol
的同时生成2nmol
Ⅱ.完成下列问题
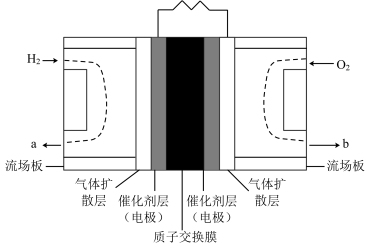
(3)氢氧燃料电池是公认的最适合载人航天器的化学能源。如图所示为第二代质子( )交换膜燃料电池,电池装置上加装冷凝水接收装置,应接在位置
)交换膜燃料电池,电池装置上加装冷凝水接收装置,应接在位置_______ (填“a”或“b”)处。正极电极反应式:_______ ;负极电极反应式:_______ 。
Ⅰ.
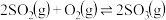 是工业制硫酸的主要反应之一,研究该反应的速率和限度有着重要的现实意义。
是工业制硫酸的主要反应之一,研究该反应的速率和限度有着重要的现实意义。
(1)反应过程的能量变化如图所示,该反应为
(2)一定条件下,在2L密闭容器中加入4mol
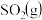 、6mol
、6mol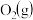 和2mol
和2mol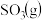 发生上述反应,在2min末达到平衡,测得
发生上述反应,在2min末达到平衡,测得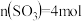 。
。①0~2min内的平均反应速率
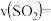
 。
。②2min末
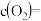
 。
。③若其他条件不变,将容器的容积扩大至3L,该化学反应速率将
④恒温恒容下,能说明该反应达到化学平衡状态的是
a.

b.
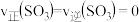
c.混合气体的压强不再变化
d.
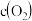 不再变化
不再变化e.单位时间内生成nmol
 的同时生成2nmol
的同时生成2nmol
Ⅱ.完成下列问题
(3)氢氧燃料电池是公认的最适合载人航天器的化学能源。如图所示为第二代质子(
 )交换膜燃料电池,电池装置上加装冷凝水接收装置,应接在位置
)交换膜燃料电池,电池装置上加装冷凝水接收装置,应接在位置
您最近一年使用:0次
解答题-原理综合题
|
较易
(0.85)
解题方法
【推荐3】氮是地球上含量丰富的一种元素,氮及其化合物在生产、生活中有着重要作用。
(1)如图是N2(g)和H2(g)反应生成1molNH3(g)过程中能量变化示意图,请写出N2和H2反应的热化学方程式:____________________________________ 。
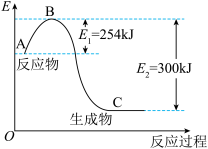
(2)已知化学键键能是形成或断裂1mol化学键放出或吸收的能量,单位为kJ·mol-1。
试根据表中及(1)的图中数据计算N—H键的键能为________ kJ·mol-1。
(3)用NH3催化还原NOx还可以消除氮氧化物的污染。例如:
4NH3(g)+3O2(g)=2N2(g)+6H2O(g)ΔH1=-akJ·mol-1①
N2(g)+O2(g)=2NO(g)ΔH2=-bkJ·mol-1②
若1molNH3还原NO至N2,则该反应过程中的反应热ΔH3=________ kJ·mol-1(用含a、b的式子表示)。
(4)氨气在纯氧中燃烧,生成一种单质和水。科学家利用此原理,设计成氨气-氧气燃料电池,则通入氨气的电极在碱性条件下发生反应的电极反应式为____________ 。
(1)如图是N2(g)和H2(g)反应生成1molNH3(g)过程中能量变化示意图,请写出N2和H2反应的热化学方程式:

(2)已知化学键键能是形成或断裂1mol化学键放出或吸收的能量,单位为kJ·mol-1。
| 化学键 | H—H | N≡N |
| 键能/kJ·mol-1 | 435 | 943 |
(3)用NH3催化还原NOx还可以消除氮氧化物的污染。例如:
4NH3(g)+3O2(g)=2N2(g)+6H2O(g)ΔH1=-akJ·mol-1①
N2(g)+O2(g)=2NO(g)ΔH2=-bkJ·mol-1②
若1molNH3还原NO至N2,则该反应过程中的反应热ΔH3=
(4)氨气在纯氧中燃烧,生成一种单质和水。科学家利用此原理,设计成氨气-氧气燃料电池,则通入氨气的电极在碱性条件下发生反应的电极反应式为
您最近一年使用:0次
解答题-结构与性质
|
较易
(0.85)
名校
解题方法
【推荐1】几种主族元素在周期表中的位置如下:
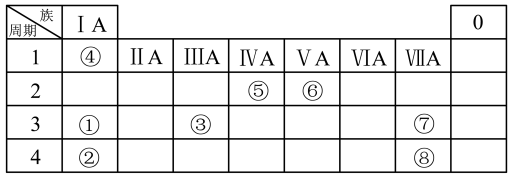
根据上表回答下列问题:
(1)⑥元素的氢化物是_______ (填化学式)。
(2)①③⑦三种元素原子半径由大到小的顺序是_______ (用元素符号表示);②⑥⑦三种元素离子半径由大到小的顺序是_______ (用元素符号表示)。
(3)表中某元素原子的核外电子层数是最外层电子数的3倍,该元素的原子结构示意图为_______ ,该元素在周期表中的位置是_______ 。
(4)①②③三种元素最高价氧化物对应水化物碱性最强的是_______ (填化学式),①与水反应的化学方程式为_______ 。
(5)⑦的非金属性强于⑧,下列表述中能证明这一事实的是_______ (填字母,下同)。
a.⑦的氢化物比⑧的氢化物稳定
b.⑦最高价氧化物对应的水化物的酸性强于⑧最高价氧化物对应的水化物的酸性
c.⑦的单质能将⑧从其钠盐溶液中置换出来

根据上表回答下列问题:
(1)⑥元素的氢化物是
(2)①③⑦三种元素原子半径由大到小的顺序是
(3)表中某元素原子的核外电子层数是最外层电子数的3倍,该元素的原子结构示意图为
(4)①②③三种元素最高价氧化物对应水化物碱性最强的是
(5)⑦的非金属性强于⑧,下列表述中能证明这一事实的是
a.⑦的氢化物比⑧的氢化物稳定
b.⑦最高价氧化物对应的水化物的酸性强于⑧最高价氧化物对应的水化物的酸性
c.⑦的单质能将⑧从其钠盐溶液中置换出来
您最近一年使用:0次
解答题-无机推断题
|
较易
(0.85)
解题方法
【推荐2】2022年是门捷列夫发现元素周期律 153 周年,下图为元素周期表的一部分。门捷列夫预言了多种当时未知的元素,T 为其中之一、L在地壳中含量排第二位,广泛应用于信息技术等领域。
(1)写出J的原子结构示意图___________ 。
(2)下列说法不正确的是___________。
(3)已知JQ2结构中只含有极性共价键,试画出其结构式:___________ (用元素符号表示)。
(4)非金属性Q___________ M(用<、=、>来表示),判断依据是(试用一个化学方程式来表示)___________ 。
| X | Y | Z | ||
| L | J | Q | ||
| T | M |
(2)下列说法不正确的是___________。
| A.T元素的单质具有半导体的特性,T与Z元素可形成化合物TZ2 |
| B.Q、J的氧化物的水化物酸性:J<Q |
| C.用pH试纸测得Q单质的水溶液pH=3 |
| D.原子半径大小:L>J>Z |
(4)非金属性Q
您最近一年使用:0次
解答题-无机推断题
|
较易
(0.85)
解题方法
【推荐3】已知短周期元素A、B、C、D、E、F六种元素,它们的原子序数由A到F依次增大。在周期表中,A的原子半径最小。B元素的原子最外层电子数是内层电子数的两倍,C为地壳中含量最多的元素,D是原子半径最大的短周期主族元素,D单质燃烧时呈现黄色火焰,D的单质在高温下与C的单质充分反应,可以得到与E单质颜色相同的淡黄色固态化合物。D与F形成的离子化合物DF是常用的调味品。试根据以上叙述回答:
(1)元素名称:A____ ;B____ ;C____ ;D____ 。
(2)E元素在周期表中的位置:____ 。
(3)F离子结构示意图:____ 。
(4)C、D两元素1:1组成的化合物的电子式是:____ 。
(5)写出BC2与过量氢氧化钠反应的方程式:____ 。
(6)C单质与D单质常温下发生反应的产物是:_____ ,C、D组成的一种化合物与水发生氧化还原反应的化学方程式为:____ 。
(7)能说明E的非金属性比F的非金属性____ (填“强”或“弱”)的事实是:____ 。(只举一例即可)
(1)元素名称:A
(2)E元素在周期表中的位置:
(3)F离子结构示意图:
(4)C、D两元素1:1组成的化合物的电子式是:
(5)写出BC2与过量氢氧化钠反应的方程式:
(6)C单质与D单质常温下发生反应的产物是:
(7)能说明E的非金属性比F的非金属性
您最近一年使用:0次
【推荐1】前四周期元素X、Y、Z、R核电荷数逐渐增加这四种元素的核电荷数之和为58;Y原子的M层p轨道有3个未成对电子;Z与Y同周期,且在该周期中电负性最大;R原子的L层电子数与最外层电子数之比为4:1,其d轨道中的电子数与最外层电子数之比为5:2。回答下列问题:
(1)R基态原子的核外电子排布式为______ 。
(2)Z元素的最高价氧化物对应的水化物化学式是______ 。
(3)Y、Z分别与X形成最简单共价化合物A、B,A与B相比,稳定性较差的是______ 。(写分子式)
(1)R基态原子的核外电子排布式为
(2)Z元素的最高价氧化物对应的水化物化学式是
(3)Y、Z分别与X形成最简单共价化合物A、B,A与B相比,稳定性较差的是
您最近一年使用:0次
解答题-无机推断题
|
较易
(0.85)
【推荐2】短周期主族元素 、
、 、
、 、
、 、
、 的原子序数依次增大,
的原子序数依次增大, 与
与 同主族,
同主族, 的原子内层电子数是其最外层电子数的2倍,
的原子内层电子数是其最外层电子数的2倍, 是地壳中含量最多的元素,
是地壳中含量最多的元素, 的最高正化合价与负化合价的绝对值相差2,
的最高正化合价与负化合价的绝对值相差2, 的原子最外层电子数等于
的原子最外层电子数等于 、
、 、
、 的原子最外层电子数之和。请回答下列问题:
的原子最外层电子数之和。请回答下列问题:
(1)写出下列元素的名称:
_______ ,
_______ ,
_______ 。
(2) 与氢组成的化合物,其分子的空间结构是
与氢组成的化合物,其分子的空间结构是_______ 形。
(3) 与
与 相比,金属性较强的是
相比,金属性较强的是_______ (填元素符号),能证明该结论的一个事实_______ 。
 、
、 、
、 、
、 、
、 的原子序数依次增大,
的原子序数依次增大, 与
与 同主族,
同主族, 的原子内层电子数是其最外层电子数的2倍,
的原子内层电子数是其最外层电子数的2倍, 是地壳中含量最多的元素,
是地壳中含量最多的元素, 的最高正化合价与负化合价的绝对值相差2,
的最高正化合价与负化合价的绝对值相差2, 的原子最外层电子数等于
的原子最外层电子数等于 、
、 、
、 的原子最外层电子数之和。请回答下列问题:
的原子最外层电子数之和。请回答下列问题:(1)写出下列元素的名称:



(2)
 与氢组成的化合物,其分子的空间结构是
与氢组成的化合物,其分子的空间结构是(3)
 与
与 相比,金属性较强的是
相比,金属性较强的是
您最近一年使用:0次
解答题-无机推断题
|
较易
(0.85)
名校
【推荐3】已知短周期主族元素A、B、C、D、E分布在三个周期,B、C最外层电子数相同,E原子序数大于C,其中E的简单离子半径在同周期中最小,C单质极易与常见无色无味液态物质发生置换反应且做氧化剂,短周期中D的最高价氧化物的水化物的碱性最强。回答下列问题:
(1)D在周期表中的位置是___________ ,D与A形成化合物的电子式为___________ 。
(2)B、C、D简单离子的半径由大到小的顺序为___________ (填离子符号),写出B离子的结构示意图___________ 。
(3)E的单质与D的最高价氧化物的水化物反应的离子方程式___________ 。
(1)D在周期表中的位置是
(2)B、C、D简单离子的半径由大到小的顺序为
(3)E的单质与D的最高价氧化物的水化物反应的离子方程式
您最近一年使用:0次
解答题-无机推断题
|
较易
(0.85)
【推荐1】表中是元素周期表的一部分,列出了①~⑪号元素,请用化学用语回答下列问题。
(1)①-⑨元素中,金属性最强的是____ ,其某种氧化物可用于呼吸面具中氧气来源,请写出该氧化物与二氧化碳反应的化学方程式____ 。
(2)上述元素的最高价氧化物对应的水化物中呈两性的氢氧化物是____ 。
(3)元素②的简单氢化物的电子式为____ ;②的简单氢化物与其最高价含氧酸反应的产物化学键为____ 。
(4)⑨和⑪简单氢化物的稳定性较强的是____ (填化学式)。
| 族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 2 | ① | ② | ③ | ④ | ||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |||
| 4 | ⑩ | ⑪ |
(2)上述元素的最高价氧化物对应的水化物中呈两性的氢氧化物是
(3)元素②的简单氢化物的电子式为
(4)⑨和⑪简单氢化物的稳定性较强的是
您最近一年使用:0次
解答题-无机推断题
|
较易
(0.85)
解题方法
【推荐2】A、B、C、D、E为原子序数依次增大的同周期短周期元素,已知A、B、E 3种原子最外层共有11个电子,且这3种元素的最高价氧化物的水化物两两皆能发生反应生成盐和水,C元素的最外层电子数比次外层电子数少4,D元素原子次外层电子数比最外层电子数多3。
(1)写出下列元素符号:A_______ ,B_______ ,C_______ ,D_______ 。
(2)A与E两元素可形成化合物,用电子式表示其化合物的形成过程:_______ 。
(3)写出A、B两元素的最高价氧化物的水化物相互反应的化学方程式:_______ 。
(4)C、D、E的氢化物稳定性由强到弱依次为:_______ (用化学式表示)。
(1)写出下列元素符号:A
(2)A与E两元素可形成化合物,用电子式表示其化合物的形成过程:
(3)写出A、B两元素的最高价氧化物的水化物相互反应的化学方程式:
(4)C、D、E的氢化物稳定性由强到弱依次为:
您最近一年使用:0次
解答题-无机推断题
|
较易
(0.85)
【推荐3】I.请用下列10种物质的序号填空:①O2②H2③NH4NO3④K2O2⑤Ba(OH)2⑥NH3(⑦CO2⑧NaF
只含有极性键是______ (填序号),既含有离子键又含有非极性键的是________ (填序号)。
II.如图为元素周期表的一部分,列出了10种元素在元素周期表中的位置,试回答下列问题:
(1)②③④三种元素最高价氧化物对应水化物的碱性由强到弱的顺序是(填化学式)_________ 。
(2)④与⑧形成的简单化合物的电子式_________ 。
(3)⑥的气态氢化物催化氧化的化学方程式为_________ 。
(4)元素②和⑤的最高价氧化物对应水化物相互反应的离子方程式为___________ 。
(5)元素⑨的单质易溶于CCl4中,所得溶液颜色为_______ 色。
III.元素周期表的形式多种多样,如图是扇形元素周期表的一部分(1~36号元素),对比中学常见元素周期表思考扇形元素周期表的填充规律,下列说法正确的是__________ (填选项)。

A.⑥、⑧、⑨对应单核离子的半径依次增大
B.⑤的三种核素的化学性质不相同
C.④的最高价氧化物对应的水化物能与其氢化物反应,生成离子化合物
D.⑧、⑨两种元素的气态氢化物及其最高价氧化物的水化物均为强酸
只含有极性键是
II.如图为元素周期表的一部分,列出了10种元素在元素周期表中的位置,试回答下列问题:
| ① | |||||||||||||||||
| ⑥ | ⑦ | ||||||||||||||||
| ② | ④ | ⑤ | ⑧ | ||||||||||||||
| ③ | ⑩ | ||||||||||||||||
| ⑨ |
(1)②③④三种元素最高价氧化物对应水化物的碱性由强到弱的顺序是(填化学式)
(2)④与⑧形成的简单化合物的电子式
(3)⑥的气态氢化物催化氧化的化学方程式为
(4)元素②和⑤的最高价氧化物对应水化物相互反应的离子方程式为
(5)元素⑨的单质易溶于CCl4中,所得溶液颜色为
III.元素周期表的形式多种多样,如图是扇形元素周期表的一部分(1~36号元素),对比中学常见元素周期表思考扇形元素周期表的填充规律,下列说法正确的是

A.⑥、⑧、⑨对应单核离子的半径依次增大
B.⑤的三种核素的化学性质不相同
C.④的最高价氧化物对应的水化物能与其氢化物反应,生成离子化合物
D.⑧、⑨两种元素的气态氢化物及其最高价氧化物的水化物均为强酸
您最近一年使用:0次



