纳米碗 是一种奇特的碗状共轭体系。高温条件下,
是一种奇特的碗状共轭体系。高温条件下, 可以由
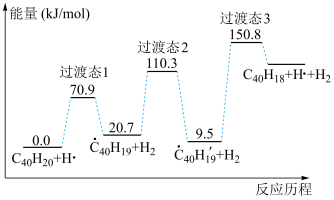
可以由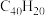 分子经过连续5步氢抽提和闭环脱氢反应生成,其中
分子经过连续5步氢抽提和闭环脱氢反应生成,其中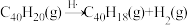 的反应机理和能量变化如图所示。下列说法正确的是
的反应机理和能量变化如图所示。下列说法正确的是
 是一种奇特的碗状共轭体系。高温条件下,
是一种奇特的碗状共轭体系。高温条件下, 可以由
可以由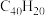 分子经过连续5步氢抽提和闭环脱氢反应生成,其中
分子经过连续5步氢抽提和闭环脱氢反应生成,其中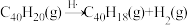 的反应机理和能量变化如图所示。下列说法正确的是
的反应机理和能量变化如图所示。下列说法正确的是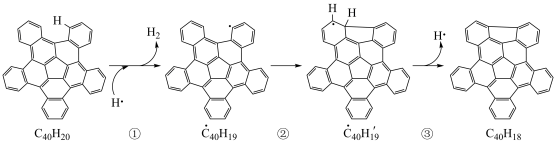
A.  ⇌ ⇌  , , 更稳定 更稳定 |
B.因上述历程涉及的中间体均存在共轭大 键,故中间体碳原子的杂化方式均为 键,故中间体碳原子的杂化方式均为 |
| C.上述历程中步骤③为整个反应的决速步骤 |
| D.升高温度各步骤的正反应速率加快,逆反应速率减慢,总反应平衡正向移动 |
2024·江西·三模 查看更多[1]
更新时间:2024-05-22 16:07:22
|
相似题推荐
单选题
|
适中
(0.65)
解题方法
【推荐1】由X、Y转化为M的反应历程如图所示,下列说法错误的


| A.①→②的总过程放热 | B.催化剂使反应的 降低 降低 |
| C.反应过程中有C-C键形成 | D.M是 |
您最近一年使用:0次
单选题
|
适中
(0.65)
解题方法
【推荐2】理论研究表明,在 和
和 下,
下, 异构化反应过程的能量变化如图所示,下列说法正确的是
异构化反应过程的能量变化如图所示,下列说法正确的是
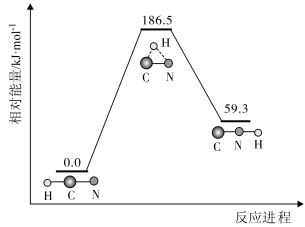
 和
和 下,
下,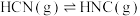 异构化反应过程的能量变化如图所示,下列说法正确的是
异构化反应过程的能量变化如图所示,下列说法正确的是
A.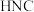 比 比 稳定 稳定 |
| B.使用催化剂,可以改变反应的反应热 |
| C.正反应的活化能小于逆反应的活化能 |
D.该异构化反应的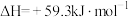 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
解题方法
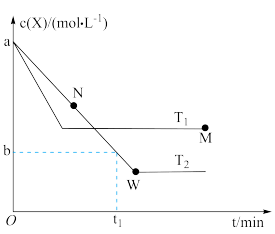
【推荐1】在恒容密闭容器中通入X并发生反应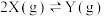 ,
, 温度下X的物质的量浓度
温度下X的物质的量浓度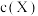 随时间t变化的曲线如图所示,下列叙述错误的是
随时间t变化的曲线如图所示,下列叙述错误的是
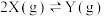 ,
, 温度下X的物质的量浓度
温度下X的物质的量浓度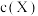 随时间t变化的曲线如图所示,下列叙述错误的是
随时间t变化的曲线如图所示,下列叙述错误的是
| A.M点的逆反应速率一定大于N点的正反应速率 |
B. 温度下,在 温度下,在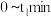 内, 内,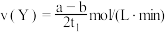 |
| C.该反应进行到M点时放出的热量大于进行到N点时放出的热量 |
| D.M点时再加入一定量的X,平衡后X的转化率增大 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
解题方法
【推荐2】反应 在起始温度、体积相同(
在起始温度、体积相同(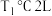 密闭容器)时,发生反应的部分数据见下表:
密闭容器)时,发生反应的部分数据见下表:
下列说法正确的是
 在起始温度、体积相同(
在起始温度、体积相同(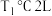 密闭容器)时,发生反应的部分数据见下表:
密闭容器)时,发生反应的部分数据见下表:| 反应条件 | 反应时间 | 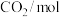 | 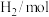 | 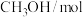 | 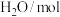 |
| 反应Ⅰ:恒温恒容 | 0min | 2 | 6 | 0 | 0 |
| 10min | 4.5 | ||||
| 30min | 1 | ||||
| 50min | 1 | ||||
| 反应Ⅱ:绝热恒容 | 0min | 2 | 6 | 0 | 0 |
A.对反应Ⅰ,前 的平均反应速率 的平均反应速率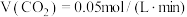 |
B.对反应Ⅰ,在其他条件不变的情况下,若 时只向容器中再充入 时只向容器中再充入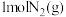 ,则正反应速率增大 ,则正反应速率增大 |
C.反应Ⅰ进行到 时, 时, 所占的体积分数为50% 所占的体积分数为50% |
D.可推测前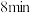 的正反应平均速率: 的正反应平均速率: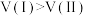 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐1】已知HCN和CNI分子中每个原子最外层都达到2电子或8电子结构,关于反应: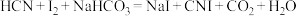 ,下列叙述正确的是
,下列叙述正确的是
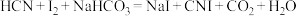 ,下列叙述正确的是
,下列叙述正确的是| A.CNI是直线形极性分子 | B.HCN中 键和 键和 键的个数之比为3:1 键的个数之比为3:1 |
C. 分子含 分子含 型 型 键 键 | D.冰融化、干冰升华都破坏共价键 |
您最近一年使用:0次
单选题
|
适中
(0.65)
解题方法
【推荐2】CalanolideA是一种抗HIV药物,其结构简式如图所示。下列关于CalanolideA的说法错误的是( )


| A.该物质在水中的溶解度较大 |
| B.分子中有三个手性碳原子 |
| C.CalanolideA可能存在分子内氢键 |
| D.分子中sp2杂化的碳原子和sp3杂化的碳原子数目相同 |
您最近一年使用:0次



 溶液和0.1
溶液和0.1 溶液为反应物,探究外界条件对化学反应速率的影响,实验记录如下表。下列说法错误的是
溶液为反应物,探究外界条件对化学反应速率的影响,实验记录如下表。下列说法错误的是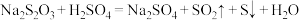


 s
s

 )具有40个价电子,下列说法错误的是
)具有40个价电子,下列说法错误的是
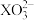 的空间构型为平面三角形
的空间构型为平面三角形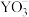 中心原子的杂化方式为
中心原子的杂化方式为 杂化
杂化


