国产大飞机C919的制造使用了较多含硼材料(如硼纤维、氮化硼等),多项技术打破了外国垄断。
(1)立方氮化硼硬度大,熔点为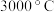 ,其晶体类型为
,其晶体类型为_______ 。
(2)耐高温材料立方 制备流程中用到
制备流程中用到 、
、 和触媒剂
和触媒剂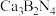 。
。
① 、B、N三种元素电负性从大到小的顺序为
、B、N三种元素电负性从大到小的顺序为_______ 。
② 中
中 原子的
原子的_______ 轨道与 原子的
原子的_______ 轨道形成 键;形成
键;形成 过程中,基态
过程中,基态 原子价电子层上的电子先激发,再杂化,激发后
原子价电子层上的电子先激发,再杂化,激发后 原子的价电子轨道表示式为
原子的价电子轨道表示式为_______ 。
③ 在四氯化碳中的溶解度远大于
在四氯化碳中的溶解度远大于 ,原因是
,原因是_______ 。
(3)近年来硼氢类离子液体作为火箭推进剂燃料得到了广泛使用。该化合物(如图所示)中不存在的作用力有_______ (填字母)。 键 E.
键 E. 键 F.氢键
键 F.氢键
(4)硼化钙晶胞结构如图所示, 原子构成
原子构成 正八面体,各个顶点通过
正八面体,各个顶点通过 键互相连接成三维骨架,八个
键互相连接成三维骨架,八个 多面体围成立方体,中心为
多面体围成立方体,中心为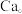 硼化钙的化学式为
硼化钙的化学式为_______ 。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称为原子的分数坐标。已知 原子的分数坐标为
原子的分数坐标为 ,
, 正八面体中
正八面体中 键的键长为r
键的键长为r ,晶胞参数为a
,晶胞参数为a ,则
,则 点原子的分数坐标为
点原子的分数坐标为_______ 。
(1)立方氮化硼硬度大,熔点为
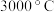 ,其晶体类型为
,其晶体类型为(2)耐高温材料立方
 制备流程中用到
制备流程中用到 、
、 和触媒剂
和触媒剂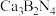 。
。①
 、B、N三种元素电负性从大到小的顺序为
、B、N三种元素电负性从大到小的顺序为②
 中
中 原子的
原子的 原子的
原子的 键;形成
键;形成 过程中,基态
过程中,基态 原子价电子层上的电子先激发,再杂化,激发后
原子价电子层上的电子先激发,再杂化,激发后 原子的价电子轨道表示式为
原子的价电子轨道表示式为③
 在四氯化碳中的溶解度远大于
在四氯化碳中的溶解度远大于 ,原因是
,原因是(3)近年来硼氢类离子液体作为火箭推进剂燃料得到了广泛使用。该化合物(如图所示)中不存在的作用力有
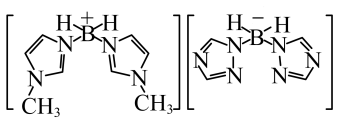
 键 E.
键 E. 键 F.氢键
键 F.氢键(4)硼化钙晶胞结构如图所示,
 原子构成
原子构成 正八面体,各个顶点通过
正八面体,各个顶点通过 键互相连接成三维骨架,八个
键互相连接成三维骨架,八个 多面体围成立方体,中心为
多面体围成立方体,中心为 硼化钙的化学式为
硼化钙的化学式为 原子的分数坐标为
原子的分数坐标为 ,
, 正八面体中
正八面体中 键的键长为r
键的键长为r ,晶胞参数为a
,晶胞参数为a ,则
,则 点原子的分数坐标为
点原子的分数坐标为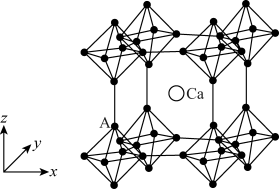
更新时间:2024-05-24 09:52:16
|
相似题推荐
解答题-无机推断题
|
适中
(0.65)
名校
解题方法
【推荐1】现有属于前四周期的A、B、C、D、E、F、G七种元素,原子序数依次增大。A元素的价电子构型为nsnnpn+1;C元素为最活泼的非金属元素;D元素核外有三个电子层,最外层电子数是核外电子总数的 ;E元素正三价离子的3d轨道为半充满状态;F元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子;G元素与A元素位于同一主族,其某种氧化物有剧毒。
;E元素正三价离子的3d轨道为半充满状态;F元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子;G元素与A元素位于同一主族,其某种氧化物有剧毒。
(1)A、B、C三种元素的第一电离能由小到大的顺序为____________ (用元素符号表示);A、B、C三种元素的简单氢化物的稳定性顺序为:_______ (用化学式表示)。
(2)D元素原子的价电子排布式是________ ,估计D元素的第2次电离能飞跃数据将发生在失去第______ 个电子时。
(3)C元素的电子排布图为______ 。E的外围电子排布为_______ ,E原子的结构示意图为_______ 。
(4)F元素位于元素周期表的_______ 区,其基态原子的电子排布式为________ 。
(5)G元素可能的性质________ 。
A 其单质可作为半导体材料 B 其电负性大于磷
C 其原子半径大于锗 D 其第一电离能小于硒
(6)电离能比较:I1(Mg)________ I1(Al)(填“>”或“<”),其原因______ 。
 ;E元素正三价离子的3d轨道为半充满状态;F元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子;G元素与A元素位于同一主族,其某种氧化物有剧毒。
;E元素正三价离子的3d轨道为半充满状态;F元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子;G元素与A元素位于同一主族,其某种氧化物有剧毒。(1)A、B、C三种元素的第一电离能由小到大的顺序为
(2)D元素原子的价电子排布式是
(3)C元素的电子排布图为
(4)F元素位于元素周期表的
(5)G元素可能的性质
A 其单质可作为半导体材料 B 其电负性大于磷
C 其原子半径大于锗 D 其第一电离能小于硒
(6)电离能比较:I1(Mg)
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
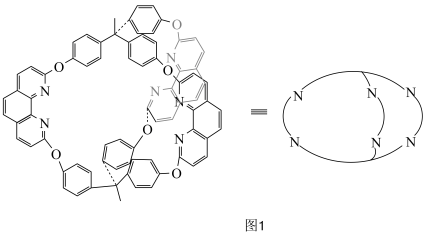
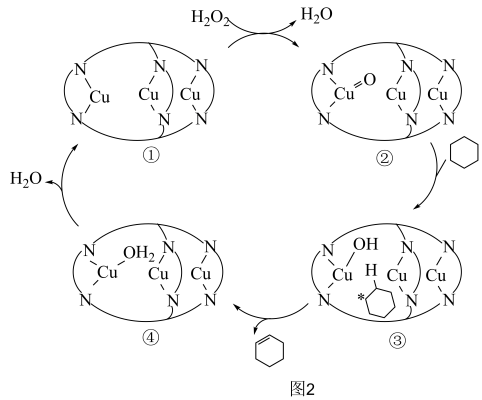
【推荐2】研发高效、绿色催化剂是化学科学发展的重要领域。某分子笼状有机化合物的结构如图1所示,其分子笼铜配合物结构及其催化环己烷氧化去饱和化反应的可能机理如图2所示。回答下列问题: 原子价层电子的轨道表示式为
原子价层电子的轨道表示式为_______ ,其位于元素周期表中_______ 区。
(2)平面形有机物 中N原子的杂化轨道类型为
中N原子的杂化轨道类型为_______ ,C、N原子的 轨道重叠形成
轨道重叠形成_______ 电子大π键。
(3)图1有机物中所涉及元素的电负性由大到小的顺序为_______ (用元素符号表示)。
(4)图2化合物④中 的配位数为
的配位数为_______ ,该配合物中键角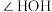
_______ (填“>”“<”或“=”) 中
中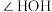 ,其原因为
,其原因为_______ 。
(5)图2中 参与氧化反应的总反应方程式为
参与氧化反应的总反应方程式为_______ 。
(6)已知有机物中N原子的电子云密度越大,其碱性越强。下列四种有机物的碱性由强到弱的顺序为_______ (填字母)。
 原子价层电子的轨道表示式为
原子价层电子的轨道表示式为(2)平面形有机物
 中N原子的杂化轨道类型为
中N原子的杂化轨道类型为 轨道重叠形成
轨道重叠形成(3)图1有机物中所涉及元素的电负性由大到小的顺序为
(4)图2化合物④中
 的配位数为
的配位数为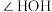
 中
中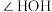 ,其原因为
,其原因为(5)图2中
 参与氧化反应的总反应方程式为
参与氧化反应的总反应方程式为(6)已知有机物中N原子的电子云密度越大,其碱性越强。下列四种有机物的碱性由强到弱的顺序为
a.  b.
b.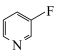 c.
c. 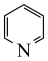 d.
d.
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
【推荐3】(1):R、T、W、X、Y、Z都是短周期元素,且W、X、Y、Z的核电荷数依次增大。下表列出它们的性质和结构:
①Y原子的电子占据能量最高的原子轨道是___________ ,T、X、Z的电负性由大到小的顺序为___________ (用化学符号填空)。
②WTR分子中的三个原子除W原子外均为8电子构型,根据电子云重叠方式的不同,分子里共价键的类型有___________ 。
③常温下,RW3是一种刺激性气味、易液化的气体。RW3极易溶于水的原因是______ 。将过量的RW3气体通入盛有硫酸铜溶液的试管里,现象为______
(2)Mn、Fe均为第四周期过渡元素,两元素的部分电离能(I)数据如表所示:
①比较两元素的I2、I3可知:气态Mn2+再失去一个电子比气态Fe2+再失去一个电子难。对此,你的解释是___________
②Fe原子或离子外围有较多能量相近的空轨道而能与一些分子或离子形成配合物,则与Fe原子或离子形成配合物的分子或离子应具备的条件是___________ 。
| 元素编号 | 元素性质或原子结构 |
| R | 原子价电子排布式为nsnnpn+1 |
| T | 基态原子核外3个能级上有电子,且各能级上的电子数相等 |
| W | 原子电子层数与核外电子数相等 |
| X | 核外s能级上的电子总数与p能级上的电子总数相等 |
| Y | 元素的原子半径在该周期中最大(除稀有气体外) |
| Z | 原子核外p能级上的电子总数比s能级上的电子总数多2 |
①Y原子的电子占据能量最高的原子轨道是
②WTR分子中的三个原子除W原子外均为8电子构型,根据电子云重叠方式的不同,分子里共价键的类型有
③常温下,RW3是一种刺激性气味、易液化的气体。RW3极易溶于水的原因是
(2)Mn、Fe均为第四周期过渡元素,两元素的部分电离能(I)数据如表所示:
| 元素 | Mn | Fe | |
| 电离能/(kJ·mol-1) | I1 | 717 | 759 |
| I2 | 1 509 | 1 561 | |
| I3 | 3 248 | 2 957 | |
①比较两元素的I2、I3可知:气态Mn2+再失去一个电子比气态Fe2+再失去一个电子难。对此,你的解释是
②Fe原子或离子外围有较多能量相近的空轨道而能与一些分子或离子形成配合物,则与Fe原子或离子形成配合物的分子或离子应具备的条件是
您最近一年使用:0次
【推荐1】回答下列问题。
(1)抗坏血酸结构如图所示,推测抗坏血酸在水中的溶解性:___________ (填“难溶”或“易溶”于水);用“*”标出坏血酸分子中的手性碳原子___________ 。

(2)元素X的某价态离子Xn+中所有电子正好充满K、L、M三个电子层,它与N3-形成的晶体的晶胞结构如图所示。
①该晶体的化学式为___________ (用元素符号表示)。
②距一个阴离子周围最近的所有阳离子为顶点构成的几何体为___________ 。
③晶胞的边长为apm,NA表示阿伏加德罗常数的值,则晶体的密度为___________ g·cm−3(用含a和NA的代数式表示)
(1)抗坏血酸结构如图所示,推测抗坏血酸在水中的溶解性:


(2)元素X的某价态离子Xn+中所有电子正好充满K、L、M三个电子层,它与N3-形成的晶体的晶胞结构如图所示。
①该晶体的化学式为
②距一个阴离子周围最近的所有阳离子为顶点构成的几何体为
③晶胞的边长为apm,NA表示阿伏加德罗常数的值,则晶体的密度为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐2】磷元素生产和生活中有广泛的应用。
(1)P原子价电子排布图为____ 。
(2)四(三苯基磷)钯分子结构如图1。

P原子以正四面体的形态围绕在钯原子中心上,判断该物质在水中溶解度并加以解释:_________ 。该物质可用于图2所示物质A的合成,物质A中碳原子杂化轨道类型为____ ;一个A分子中手性碳原子数目为____ 。
(3)在图3中表示出四(三苯基磷)钯分子中配位键____ 。

(4)PCl5是一种白色晶体,在恒容密闭容器中加热可在148℃液化,形成一种能导电的熔体,测得其中含有一种正四面体形阳离子和一种正六面体形阴离子,熔体中P-Cl的键长只有198nm和206nm两种,这两种离子的化学式为____ ;正四面体形阳离子中键角大于PCl3的键角原因为_____ 。
(5)磷有三种含氧酸H3PO2、H3PO3、H3PO4,其中磷元素均以sp3杂化与相邻原子形成四个σ键,则H3PO3的结构式是________ ,写出H3PO2与足量氢氧化钠溶液反应的化学方程式:____________________ 。磷的三种含氧酸H3PO2、H3PO3、H3PO4的酸性强弱顺序为H3PO2<H3PO3<H3PO4,其原因是_____________________ 。
(6)磷化硼是一种受到高度关注的耐磨涂料,它可用作金属的表面保护层。磷化硼可由三溴化硼和三溴化磷在氢气中高温反应合成。
①写出合成磷化硼的化学反应方程式:____________________
②三溴化硼分子和三溴化磷分子的立体构型分别是________ 、________ 。
(1)P原子价电子排布图为
(2)四(三苯基磷)钯分子结构如图1。

P原子以正四面体的形态围绕在钯原子中心上,判断该物质在水中溶解度并加以解释:
(3)在图3中表示出四(三苯基磷)钯分子中配位键

(4)PCl5是一种白色晶体,在恒容密闭容器中加热可在148℃液化,形成一种能导电的熔体,测得其中含有一种正四面体形阳离子和一种正六面体形阴离子,熔体中P-Cl的键长只有198nm和206nm两种,这两种离子的化学式为
(5)磷有三种含氧酸H3PO2、H3PO3、H3PO4,其中磷元素均以sp3杂化与相邻原子形成四个σ键,则H3PO3的结构式是
(6)磷化硼是一种受到高度关注的耐磨涂料,它可用作金属的表面保护层。磷化硼可由三溴化硼和三溴化磷在氢气中高温反应合成。
①写出合成磷化硼的化学反应方程式:
②三溴化硼分子和三溴化磷分子的立体构型分别是
您最近一年使用:0次
【推荐3】氯化铬酰(CrO2Cl2)在有机合成中可作氧化剂或氯化剂,能与许多有机物反应。请回答下列问题:
(1)写出铬原子的基态电子排布式__ ,与铬同周期的所有元素的基态原子中最外层电子数与铬原子相同的元素有__ (填元素符号)。
(2)CrO2Cl2常温下为深红色液体,能与CCl4、CS2等互溶,据此可判断CrO2Cl2是_ (填“极性”或“非极性”分子)。
(3)在①乙烯、② 、③BF3、④H2O、⑤CCl4、⑥SO3六种有机溶剂中,中心原子采取sp2杂化的分子有
、③BF3、④H2O、⑤CCl4、⑥SO3六种有机溶剂中,中心原子采取sp2杂化的分子有__ (填序号),写一种 互为等电子体的阴离子
互为等电子体的阴离子__ 。
(1)写出铬原子的基态电子排布式
(2)CrO2Cl2常温下为深红色液体,能与CCl4、CS2等互溶,据此可判断CrO2Cl2是
(3)在①乙烯、②
 、③BF3、④H2O、⑤CCl4、⑥SO3六种有机溶剂中,中心原子采取sp2杂化的分子有
、③BF3、④H2O、⑤CCl4、⑥SO3六种有机溶剂中,中心原子采取sp2杂化的分子有 互为等电子体的阴离子
互为等电子体的阴离子
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
【推荐1】Ⅰ.回答下列问题:
(1)写出溴原子的核外电子排布式_________ ,写出Fe的原子结构示意图_________
(2)元素金(Au)处于周期表中的第六周期,与Cu同族,一种铜金合金晶体的晶胞中Cu原子处于面心,Au原子处于顶角位置,则该合金中Cu原子与Au原子数目之比为_________ ;该晶体中,原子之间的相互作用是_________ 。
(3)某钙钛型复合氧化物如图所示,以A原子为晶胞的顶角,A位可以是Ca、Sr、Ba或Pb,当B位是V、Cr、Mn、Fe等时,这种化合物具有CMR效应。

①用A、B、O表示这类特殊晶体的化学式_________ 。
②下列有关说法正确的是_________ 。
A.镧、锰、氧分别位于周期表f、d、p区
B.氧元素的第一电离能比氮元素的第一电离能大
C.锰的电负性为1.59,铬的电负性为1.66,说明锰的金属性比铬强
D.铬的价电子排布与钾相同
Ⅱ.如图所示为金属原子的四种基本堆积(分别为:简单立方堆积、六方最密堆积、面心立方最密堆积、体心立方堆积)模型,请回答以下问题:
(4)某金属R的晶胞为D型,已知R原子半径为rcm,相对原子质量为M,阿伏加德罗常数为NA,则R金属的密度_________ g/cm3。(用含r、M、NA字母的式子表示)
(1)写出溴原子的核外电子排布式
(2)元素金(Au)处于周期表中的第六周期,与Cu同族,一种铜金合金晶体的晶胞中Cu原子处于面心,Au原子处于顶角位置,则该合金中Cu原子与Au原子数目之比为
(3)某钙钛型复合氧化物如图所示,以A原子为晶胞的顶角,A位可以是Ca、Sr、Ba或Pb,当B位是V、Cr、Mn、Fe等时,这种化合物具有CMR效应。

①用A、B、O表示这类特殊晶体的化学式
②下列有关说法正确的是
A.镧、锰、氧分别位于周期表f、d、p区
B.氧元素的第一电离能比氮元素的第一电离能大
C.锰的电负性为1.59,铬的电负性为1.66,说明锰的金属性比铬强
D.铬的价电子排布与钾相同
Ⅱ.如图所示为金属原子的四种基本堆积(分别为:简单立方堆积、六方最密堆积、面心立方最密堆积、体心立方堆积)模型,请回答以下问题:

(4)某金属R的晶胞为D型,已知R原子半径为rcm,相对原子质量为M,阿伏加德罗常数为NA,则R金属的密度
您最近一年使用:0次
【推荐2】氮的化合物在工业生产中有重要用途,请回答下列问题:
(1)[Ni(N2H4)2](N3)2是一种富氮含能材料。写出一种与N 互为等电子体的分子:
互为等电子体的分子:_______ (填化学式);实验数据表明键角:NH3>PH3>AsH3,分析原因是_______ 。
(2)氮与碳还能形成一种离子液体的正离子 ,为使该正离子以单个形式存在以获得良好的溶解性能,与N原子相连的-C2H5,不能被H原子替换,原因是
,为使该正离子以单个形式存在以获得良好的溶解性能,与N原子相连的-C2H5,不能被H原子替换,原因是_______ 。
(3)配合物顺铂[Pt(NH3)2Cl2]是临床使用的第一代铂类抗癌药物。顺铂的抗癌机理:在铜转运蛋白的作用下,顺铂进入人体细胞发生水解,生成的Pt(NH3)2(OH)Cl破坏DNA的结构,阻止癌细胞增殖。如:
①基态Cu原子价层电子的轨道表示式为_______ ,鸟嘌呤中氮原子的杂化方式为______ 。构成鸟嘌呤的元素电负性由大到小的顺序_______ 。
②在Pt(NH3)2Cl2中,配体与铂(Ⅱ)的结合能力:Cl-_______ NH3(填“>”或“<”)。
③顺铂和反铂互为同分异构体,两者的结构和性质如表。
请从分子结构角度解释顺铂在水中的溶解度大于反铂的原因是________ 。
④顺铂的发现与铂电极的使用有关。铂晶胞为正方体,边长为a nm,结构如图。铂晶体的摩尔体积Vm=_______ m3/mol(阿伏加德罗常数为NA)。(已知:单位物质的量的物质所具有的体积叫做摩尔体积)

(1)[Ni(N2H4)2](N3)2是一种富氮含能材料。写出一种与N
 互为等电子体的分子:
互为等电子体的分子:(2)氮与碳还能形成一种离子液体的正离子
 ,为使该正离子以单个形式存在以获得良好的溶解性能,与N原子相连的-C2H5,不能被H原子替换,原因是
,为使该正离子以单个形式存在以获得良好的溶解性能,与N原子相连的-C2H5,不能被H原子替换,原因是(3)配合物顺铂[Pt(NH3)2Cl2]是临床使用的第一代铂类抗癌药物。顺铂的抗癌机理:在铜转运蛋白的作用下,顺铂进入人体细胞发生水解,生成的Pt(NH3)2(OH)Cl破坏DNA的结构,阻止癌细胞增殖。如:

①基态Cu原子价层电子的轨道表示式为
②在Pt(NH3)2Cl2中,配体与铂(Ⅱ)的结合能力:Cl-
③顺铂和反铂互为同分异构体,两者的结构和性质如表。
| 顺铂 | 反铂 | |
| 结构 |  | 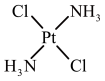 |
| 25℃时溶解度/g | 0.2577 | 0.0366 |
④顺铂的发现与铂电极的使用有关。铂晶胞为正方体,边长为a nm,结构如图。铂晶体的摩尔体积Vm=

您最近一年使用:0次
【推荐3】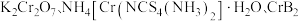 均是铬的重要化合物,回答下列问题:
均是铬的重要化合物,回答下列问题: 原子有
原子有___________ 种能量不同的电子,价电子排布式为___________ 。
(2)已知电子亲和能(E)是基态的气态原子得到电子变为气态阴离子所放出的能量, 。氧的第一电子亲和能
。氧的第一电子亲和能 为
为___________  ;
; ,其原因是
,其原因是___________ 。
(3)雷氏盐的化学式为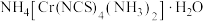 。
。
①H、C、N、O四种元素的电负性由大到小的顺序为___________ 。
②雷氏盐中所含化学键类型___________ 。
A.离子键 B.共价键 C.配位键 D.金属键 E.氢键
③配体之一 分子的
分子的 模型名称为
模型名称为___________ ,与配体 互为等电子体的分子和离子有
互为等电子体的分子和离子有___________ 、___________ (各写1种)。
(4)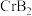 的晶体密度为
的晶体密度为 ,晶体结构(如图)为六棱柱,底边边长为
,晶体结构(如图)为六棱柱,底边边长为 ,高为
,高为 ,设阿伏加德罗常数的值为
,设阿伏加德罗常数的值为 ,则
,则
___________ (列出计算式)。
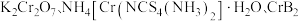 均是铬的重要化合物,回答下列问题:
均是铬的重要化合物,回答下列问题: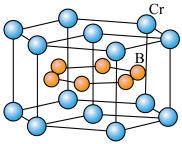
 原子有
原子有(2)已知电子亲和能(E)是基态的气态原子得到电子变为气态阴离子所放出的能量,
 。氧的第一电子亲和能
。氧的第一电子亲和能 为
为 ;
; ,其原因是
,其原因是(3)雷氏盐的化学式为
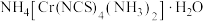 。
。①H、C、N、O四种元素的电负性由大到小的顺序为
②雷氏盐中所含化学键类型
A.离子键 B.共价键 C.配位键 D.金属键 E.氢键
③配体之一
 分子的
分子的 模型名称为
模型名称为 互为等电子体的分子和离子有
互为等电子体的分子和离子有(4)
 的晶体密度为
的晶体密度为 ,晶体结构(如图)为六棱柱,底边边长为
,晶体结构(如图)为六棱柱,底边边长为 ,高为
,高为 ,设阿伏加德罗常数的值为
,设阿伏加德罗常数的值为 ,则
,则
您最近一年使用:0次



