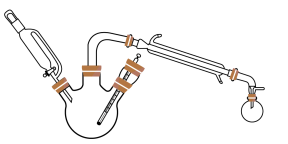
某研究性小组探究乙酸乙酯的反应机理,实验如下:
CH3COOH + C2H5OH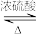 CH3COOC2H5 + H2O
CH3COOC2H5 + H2O
投料 1 : 1 CH3COOH转化率 65%
1 : 10 CH3COOH转化率 97%
(在120 ℃下测定)
已知:相关物理性质(常温常压)
合成反应:
在三颈瓶中加入乙醇5 mL,硫酸5 mL,2小片碎瓷片。漏斗加入乙酸14.3 mL ,乙醇20 mL。冷凝管中通入冷却水后,开始缓慢加热,控制滴加速度等于蒸馏速度,反应温度不超过120 ℃。
分离提纯:
将反应粗产物倒入分液漏斗中,依次用少量饱和的Na2CO3溶液、饱和NaCl溶液、饱和CaCl2溶液洗涤,分离后加入无水碳酸钾,静置一段时间后弃去碳酸钾。最终通过蒸馏得到纯净的乙酸乙酯。
回答下列问题:
(1)酯化反应的机理
用乙醇羟基氧示踪
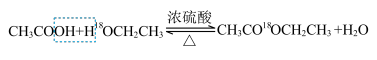
用醋酸羟基氧示踪
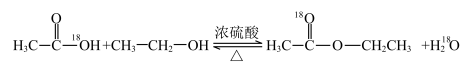
含氧18水占到总水量的一半,酯也一样。这个实验推翻了酯化反应为简单的取代反应。请你设想酯化反应的机理______________________ 。
(2)酯化反应是一个可逆的反应,120 ℃时,平衡常数K=__________________ 。
(3)如果加热一段时间后发现忘记加瓷片,应该采取的正确操作是________(填正确答案标号)。
(4)浓硫酸与乙醇如何混合?__________________ 。
(5)控制滴加乙酸和乙醇混和液的速度等于蒸馏速度目的是?_______________ 。
(6)蒸出的粗乙酸乙酯中主要有哪些杂质?_____________________ 。饱和的Na2CO3溶液洗涤除去乙酸。如何判断是否除净?________________ 。用饱和NaCl溶液洗涤除去残留的Na2CO3溶液,为什么不用水?_________________ 。

CH3COOH + C2H5OH
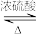 CH3COOC2H5 + H2O
CH3COOC2H5 + H2O投料 1 : 1 CH3COOH转化率 65%
1 : 10 CH3COOH转化率 97%
(在120 ℃下测定)
已知:相关物理性质(常温常压)
| 密度g/mL | 熔点/℃ | 沸点/℃ | 水溶性 | |
| 乙醇 | 0.79 | -114 | 78 | 溶 |
| 乙酸 | 1.049 | 16.2 | 117 | 溶 |
| 乙酸乙酯 | 0.902 | −84 | 76.5 | 不溶 |
在三颈瓶中加入乙醇5 mL,硫酸5 mL,2小片碎瓷片。漏斗加入乙酸14.3 mL ,乙醇20 mL。冷凝管中通入冷却水后,开始缓慢加热,控制滴加速度等于蒸馏速度,反应温度不超过120 ℃。
分离提纯:
将反应粗产物倒入分液漏斗中,依次用少量饱和的Na2CO3溶液、饱和NaCl溶液、饱和CaCl2溶液洗涤,分离后加入无水碳酸钾,静置一段时间后弃去碳酸钾。最终通过蒸馏得到纯净的乙酸乙酯。
回答下列问题:
(1)酯化反应的机理
用乙醇羟基氧示踪

用醋酸羟基氧示踪

含氧18水占到总水量的一半,酯也一样。这个实验推翻了酯化反应为简单的取代反应。请你设想酯化反应的机理
(2)酯化反应是一个可逆的反应,120 ℃时,平衡常数K=
(3)如果加热一段时间后发现忘记加瓷片,应该采取的正确操作是________(填正确答案标号)。
| A.立即补加 | B.冷却后补加 | C.不需补加 | D.重新配料 |
(5)控制滴加乙酸和乙醇混和液的速度等于蒸馏速度目的是?
(6)蒸出的粗乙酸乙酯中主要有哪些杂质?
更新时间:2016-12-09 07:41:54
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
名校
【推荐1】工业合成氨是人类科学技术的一项重大突破。其反应为: 。
。
(1)合成氨生产流程示意图如下。

①有利于提高原料利用率的措施是_______ (至少写出两条,下同);
②有利于提高单位时间内氨的产率的措施有_______ 。
(2)下图中的实验数据是在其它条件不变时,不同温度(200℃、400℃、600℃)、压强下,平衡混合物中 的物质的量分数的变化情况。
的物质的量分数的变化情况。

①曲线a对应的温度是_______ 。
②M、N、Q点平衡常数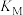 、
、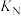 、
、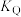 的大小关系是
的大小关系是_______ 。
 。
。(1)合成氨生产流程示意图如下。

①有利于提高原料利用率的措施是
②有利于提高单位时间内氨的产率的措施有
(2)下图中的实验数据是在其它条件不变时,不同温度(200℃、400℃、600℃)、压强下,平衡混合物中
 的物质的量分数的变化情况。
的物质的量分数的变化情况。
①曲线a对应的温度是
②M、N、Q点平衡常数
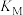 、
、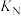 、
、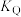 的大小关系是
的大小关系是
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐2】煤制天然气的过程中涉及到煤气化反应和水气变换反应.
煤气化反应Ⅰ: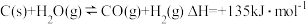
水气变换反应Ⅱ:
回答下列问题:
(1)
__________ .
(2)图一表示不同温度条件下,反应Ⅰ发生后的汽气比(水蒸气与CO物质的量之比)与CO平衡转化率的变化关系.
①判断 和
和 由大到小的关系为
由大到小的关系为___________ ;
②若经反应Ⅰ发生后的汽气比为0.8,所得混合气体经反应Ⅱ后,得到CO与H2的物质的量之比为 ,则反应Ⅱ应选择的温度是
,则反应Ⅱ应选择的温度是__________ (填“ ”、“
”、“ ”或“
”或“ ”).
”).

(3)为了进一步探究反应条件对反应Ⅱ的影响,某活动小组设计了三个实验,实验曲线如图二所示:

①请依据图二的实验曲线补充完整表格中的实验条件:X=________ ℃,Y=________  .
.
②实验丙从开始至 末,平均反应速率
末,平均反应速率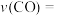
___________ .
③达平衡时CO的转化率:实验乙______ 实验丙(填“大于”、“小于”或“等于”).
④ 时,反应Ⅱ的平衡常数
时,反应Ⅱ的平衡常数 .若往某刚性容器中投入
.若往某刚性容器中投入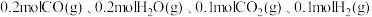 ,列简式计算井说明该反应进行的方向
,列简式计算井说明该反应进行的方向______ .
煤气化反应Ⅰ:
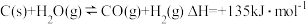
水气变换反应Ⅱ:

回答下列问题:
(1)

(2)图一表示不同温度条件下,反应Ⅰ发生后的汽气比(水蒸气与CO物质的量之比)与CO平衡转化率的变化关系.
①判断
 和
和 由大到小的关系为
由大到小的关系为②若经反应Ⅰ发生后的汽气比为0.8,所得混合气体经反应Ⅱ后,得到CO与H2的物质的量之比为
 ,则反应Ⅱ应选择的温度是
,则反应Ⅱ应选择的温度是 ”、“
”、“ ”或“
”或“ ”).
”).
(3)为了进一步探究反应条件对反应Ⅱ的影响,某活动小组设计了三个实验,实验曲线如图二所示:
| 编号 | 温度 | 压强 | c始 | c始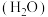 |
| 甲 | 530℃ |  |  |  |
| 乙 | X | Y |  |  |
| 丙 | 630℃ |  |  |  |

①请依据图二的实验曲线补充完整表格中的实验条件:X=
 .
.②实验丙从开始至
 末,平均反应速率
末,平均反应速率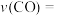
③达平衡时CO的转化率:实验乙
④
 时,反应Ⅱ的平衡常数
时,反应Ⅱ的平衡常数 .若往某刚性容器中投入
.若往某刚性容器中投入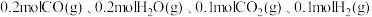 ,列简式计算井说明该反应进行的方向
,列简式计算井说明该反应进行的方向
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐3】工业废气中的NO2、CO2对环境具有极大影响,利用化学反应原理对其处理,对构建“绿水青山”生态文明有重要意义。请回答下列问题:
(1)下列说法正确的是_________
A.CO2和NO2与水反应所得溶液均为弱酸
B.NO2在一定条件下能与NH3反应生成环境友好的物质
C.通过测定溶液的pH,一定能判断H2CO3和HNO2的酸性强弱
D.Na2CO3溶液中加入硫酸可生成CO2
(2)H2在催化剂存在下能与NO2反应生成水蒸气和氮气而消去工业尾气中NO2的污染,
已知:①N(g)+2O2(g)=2NO2(g)ΔH=+133kJ/mol;②H2O(g)=H2O(1)ΔH=-44kJ/mol;③H2的燃烧热为285.8kJ/mol,该反应的热化学方程式为___________ .
(3)CO2可在一定条件下转化为CH3OH。已知向2L密闭容器中加入2molCO2和6molH2,在适当的催化剂和T1温度下,发生反应:CO2(g)+3H2(g) CH3OH(1)+H2O(1) ΔH<O,10min时达到平衡状态,10min后改变温度为T2,生成物全部为气体,20min时达到平衡状态,反应过程中部分数据见表:
CH3OH(1)+H2O(1) ΔH<O,10min时达到平衡状态,10min后改变温度为T2,生成物全部为气体,20min时达到平衡状态,反应过程中部分数据见表:
①前10min内的平均反应速率v(CO2)=_______ ,20min时H2的转化率为_______ 。
②在其他条件不变的情况下,若30min时只改变温度为T3,达平衡时H2的物质的量为3.2mol,则T2______ T3(填“>”“<”或“=”),在温度T2时,反应的化学平衡常数为______ 。
③在T1温度下,将容器容积缩小一倍,反应达平衡时CH3OH物质的量为____ mol.和改变下列条件,能使H2的反应速率和转化率都一定增大的是____ (填标号)。
A.在容积不变下升高温度
B.其它条件下不变,增加压强
C.在容积和温度不变下充入N2
D.在容积和温度不变下及时分离出CH3OH
(1)下列说法正确的是
A.CO2和NO2与水反应所得溶液均为弱酸
B.NO2在一定条件下能与NH3反应生成环境友好的物质
C.通过测定溶液的pH,一定能判断H2CO3和HNO2的酸性强弱
D.Na2CO3溶液中加入硫酸可生成CO2
(2)H2在催化剂存在下能与NO2反应生成水蒸气和氮气而消去工业尾气中NO2的污染,
已知:①N(g)+2O2(g)=2NO2(g)ΔH=+133kJ/mol;②H2O(g)=H2O(1)ΔH=-44kJ/mol;③H2的燃烧热为285.8kJ/mol,该反应的热化学方程式为
(3)CO2可在一定条件下转化为CH3OH。已知向2L密闭容器中加入2molCO2和6molH2,在适当的催化剂和T1温度下,发生反应:CO2(g)+3H2(g)
 CH3OH(1)+H2O(1) ΔH<O,10min时达到平衡状态,10min后改变温度为T2,生成物全部为气体,20min时达到平衡状态,反应过程中部分数据见表:
CH3OH(1)+H2O(1) ΔH<O,10min时达到平衡状态,10min后改变温度为T2,生成物全部为气体,20min时达到平衡状态,反应过程中部分数据见表:| 反应时间 | CO2(mol) | H2(mol) | CH3OH(mol) | H2O(mol) |
| 0min | 2 | 6 | 0 | 0 |
| 10min | 4.5 | |||
| 20min | 1 |
①前10min内的平均反应速率v(CO2)=
②在其他条件不变的情况下,若30min时只改变温度为T3,达平衡时H2的物质的量为3.2mol,则T2
③在T1温度下,将容器容积缩小一倍,反应达平衡时CH3OH物质的量为
A.在容积不变下升高温度
B.其它条件下不变,增加压强
C.在容积和温度不变下充入N2
D.在容积和温度不变下及时分离出CH3OH
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐1】乙酸和乙醇反应制取乙酸乙酯的装置如图所示:在试管里加入3mL乙醇,然后一边摇动,一边慢慢地加入2mL浓硫酸和2mL冰醋酸,用酒精灯小心均匀地加热10min,将产生的蒸气经长导管通入到小试管中溶液的液面上。回答下列问题:
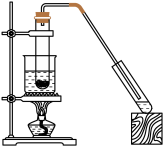
(1)乙酸的官能团是____ (写名称)。制取乙酸乙酯的化学方程式为:___ 。
(2)①浓H2SO4的作用是____ 。
②小试管中的溶液是____ ,其作用是____ (写出一种即可);
③长导管不插入液面以下的目的是____ ;
(4)实验中采取的加热方式称,这种加热方式的好处主要有____ 、___ ;
(5)反应生成的乙酸乙酯,其密度比水___ (填“大”或“小”),有___ 气味。应从该分液漏斗的___ (填编号,多填、少填均不得分)。
a.下部流出 b.上口倒出 c.都可以
(6)若实验室中温度过高,温度达170℃,副产物中主要有机产物是___ (填名称)。

(1)乙酸的官能团是
(2)①浓H2SO4的作用是
②小试管中的溶液是
③长导管不插入液面以下的目的是
(4)实验中采取的加热方式称,这种加热方式的好处主要有
(5)反应生成的乙酸乙酯,其密度比水
a.下部流出 b.上口倒出 c.都可以
(6)若实验室中温度过高,温度达170℃,副产物中主要有机产物是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐2】某学习小组在实验室制取乙酸乙酯的主要步骤如下:
①配制2mL浓硫酸、3mL乙醇(含18O)和2mL乙酸的混合溶液。
②按如图连接好装置并加入混合液,用小火均匀加热3~5min。
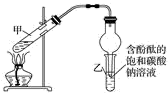
③待试管乙收集到一定量产物后停止加热,撤出试管乙用力振荡,然后静置待分层。
④分离出乙酸乙酯,洗涤、干燥。
回答问题:
(1)装置中球形干燥管,除起冷凝作用外,另一重要作用是___________ 。
(2)步骤②安装好实验装置,加入药品前还应检查___________ 。
(3)反应中浓硫酸的作用是___________ 。
(4)上述实验中饱和碳酸钠溶液的作用是___________(填字母)。
(5)从试管乙中分离出乙酸乙酯的实验操作名称是___________ 。
①配制2mL浓硫酸、3mL乙醇(含18O)和2mL乙酸的混合溶液。
②按如图连接好装置并加入混合液,用小火均匀加热3~5min。

③待试管乙收集到一定量产物后停止加热,撤出试管乙用力振荡,然后静置待分层。
④分离出乙酸乙酯,洗涤、干燥。
回答问题:
(1)装置中球形干燥管,除起冷凝作用外,另一重要作用是
(2)步骤②安装好实验装置,加入药品前还应检查
(3)反应中浓硫酸的作用是
(4)上述实验中饱和碳酸钠溶液的作用是___________(填字母)。
| A.中和乙酸并吸收乙醇 | B.中和乙酸和乙醇 |
| C.减少乙酸乙酯的溶解 | D.加速酯的生成,提高其产率 |
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐3】甲酸乙酯为允许使用的食用香料,又称蚁酸乙酯,有辛辣的刺激味和菠萝样的果香香气,还有强烈朗姆酒似香气,并略带苦味。
已知:①无水氯化钙可与乙醇形成难溶于水的CaCl2·6C2H5OH
②有关有机物的沸点如下
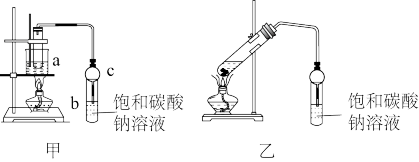
(1)制备粗品
将4mL乙醇、3mL甲酸和2mL浓硫酸加入试管a中,摇匀后放入碎瓷片,缓慢加热至反应完全,在试管b内得到甲酸乙酯的粗品。
①实验时,加入数滴浓硫酸即能起催化作用,但实际用量多于此量,原因是__________ ;浓硫酸用量又不能过多,原因是_________ 。
②球形干燥管C的作用是__________ 。
③若用乙装置制备甲酸乙酯,其缺点有__________ 。
(2)制备精品
①反应结束后,从试管b中分离出甲酸乙酯粗品所用的主要仪器__________ 。
②从b中分离出的甲酸乙酯中常含有少量的乙醇、乙醚和水,应先加入无水氯化钙,除去______ ,然后再通过_________ 操作得到甲酸乙酯。
③某同学用装有饱和氢氧化钠的试管收集甲酸乙酯,几乎没有收集到产物。原因是______________ (用化学方程式解释)。
已知:①无水氯化钙可与乙醇形成难溶于水的CaCl2·6C2H5OH
②有关有机物的沸点如下
| 试剂 | 乙醚 | 乙醇 | 甲酸 | 甲酸乙酯 |
| 沸点(℃) | 34.7 | 78.5 | 100.5 | 54.4 |

(1)制备粗品
将4mL乙醇、3mL甲酸和2mL浓硫酸加入试管a中,摇匀后放入碎瓷片,缓慢加热至反应完全,在试管b内得到甲酸乙酯的粗品。
①实验时,加入数滴浓硫酸即能起催化作用,但实际用量多于此量,原因是
②球形干燥管C的作用是
③若用乙装置制备甲酸乙酯,其缺点有
(2)制备精品
①反应结束后,从试管b中分离出甲酸乙酯粗品所用的主要仪器
②从b中分离出的甲酸乙酯中常含有少量的乙醇、乙醚和水,应先加入无水氯化钙,除去
③某同学用装有饱和氢氧化钠的试管收集甲酸乙酯,几乎没有收集到产物。原因是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐1】乙酸乙酯广泛用于药物、染料、香料等工业,中学化学实验常用a装置来制备。

完成下列填空:
(1)a装置中玻璃仪器除导管和试管外还有___ 仪器。
(2)实验时,通常加入过量的乙醇,原因是:___ 。加入数滴浓硫酸即能起催化作用,但实际用量多于此量,原因是:___ 。浓硫酸用量又不能过多,原因是___ 。
(3)饱和Na2CO3溶液的作用是___ 。
(4)反应结束后,将试管中收集到的产品倒入分液漏斗中,___ 、__ ,然后分液。这样得到的乙酸乙酯是粗产品,要进一步提纯精制,通常先用饱和食盐水洗涤除去少量Na2CO3溶液,再用饱和CaCl2溶液除去少量__ 。
(5)若用b装置制备乙酸乙酯,其缺点有___ 、___ 。

完成下列填空:
(1)a装置中玻璃仪器除导管和试管外还有
(2)实验时,通常加入过量的乙醇,原因是:
(3)饱和Na2CO3溶液的作用是
(4)反应结束后,将试管中收集到的产品倒入分液漏斗中,
(5)若用b装置制备乙酸乙酯,其缺点有
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐2】苯甲酸乙酯是重要的精细化工试剂,常用于配制水果型食用香精。实验室制备流程如下:

试剂相关性质如下表:
回答下列问题:
⑴为提高原料苯甲酸的纯度,可采用的纯化方法为________ 。
⑵步骤①的装置如图所示(加热和夹持装置已略去),将一小团棉花放入仪器B中靠近活塞孔处,将吸水剂(无水硫酸铜的乙醇饱和溶液)放入仪器B中,在仪器C中加入12.2g纯化后的苯甲酸晶体,30mL无水乙醇(约0.5mol)和3mL浓硫酸,加入沸石,加热至微沸,回流反应1.5至2h。仪器A的作用是________________ ;仪器C中反应液应采用________ 方式加热。
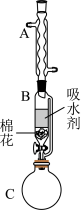
⑶随着反应进行,反应体系中水分不断被有效分离,仪器B中吸水剂的现象为________ 。
⑷反应结束后,对C中混合液进行分离提纯,操作Ⅰ是____ ;操作Ⅱ所用的玻璃仪器除了烧杯外还有_____ 。
⑸向混合液3中加入的试剂X为________ (填写化学式)。
⑹最终得到产物纯品12.0g,实验产率为________ %(保留三位有效数字)。

试剂相关性质如下表:
| 苯甲酸 | 乙醇 | 苯甲酸乙酯 | |
| 常温颜色状态 | 白色针状晶体 | 无色液体 | 无色透明液体 |
| 沸点/℃ | 249.0 | 78.0 | 212.6 |
| 相对分子量 | 122 | 46 | 150 |
| 溶解性 | 微溶于水,易溶于乙醇、乙醚等有机溶剂 | 与水任意比互溶 | 难溶于冷水,微溶于热水,易溶于乙醇和乙醚 |
⑴为提高原料苯甲酸的纯度,可采用的纯化方法为
⑵步骤①的装置如图所示(加热和夹持装置已略去),将一小团棉花放入仪器B中靠近活塞孔处,将吸水剂(无水硫酸铜的乙醇饱和溶液)放入仪器B中,在仪器C中加入12.2g纯化后的苯甲酸晶体,30mL无水乙醇(约0.5mol)和3mL浓硫酸,加入沸石,加热至微沸,回流反应1.5至2h。仪器A的作用是

⑶随着反应进行,反应体系中水分不断被有效分离,仪器B中吸水剂的现象为
⑷反应结束后,对C中混合液进行分离提纯,操作Ⅰ是
⑸向混合液3中加入的试剂X为
⑹最终得到产物纯品12.0g,实验产率为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐3】某课外小组设计的实验室制取乙酸乙酯的装置如下图所示,A中放有浓硫酸,B中放有乙醇、无水醋酸,D中放有足量饱和碳酸钠溶液。

已知:①无水氯化钙可与乙醇形成难溶于水的 ;
;
②相关有机物的沸点如下:
请回答:
(1)加入数滴浓硫酸即起催化作用,但实际用量却多于此量,原因是浓硫酸起_______ 作用促进酯化反应正向进行;但用量又不能过多,原因是_______ 。
(2)若反应前向D中加入几滴酚酞,溶液呈红色,反应结束后D中颜色变浅,其原因是(用化学方程式回答)_______ 。
(3)从D中用_______ 的方法分离出的乙酸乙酯中常含有一定量的乙醇、乙醚和水,应先加入无水氯化钙,除去_______ ,再加入干燥剂_______ (此空从下列选项中选择),然后进行蒸馏,收集77℃左右的馏分,以得到较纯净的乙酸乙酯。
A.五氧化二磷B.碱石灰C.无水硫酸钠D.生石灰

已知:①无水氯化钙可与乙醇形成难溶于水的
 ;
;②相关有机物的沸点如下:
| 试剂 | 乙醚 | 乙醇 | 乙酸 | 乙酸乙酯 |
| 沸点/℃ | 34.7 | 78.5 | 118 | 77.1 |
(1)加入数滴浓硫酸即起催化作用,但实际用量却多于此量,原因是浓硫酸起
(2)若反应前向D中加入几滴酚酞,溶液呈红色,反应结束后D中颜色变浅,其原因是(用化学方程式回答)
(3)从D中用
A.五氧化二磷B.碱石灰C.无水硫酸钠D.生石灰
您最近一年使用:0次



