氧化剂H2O2在反应时不产生污染物被称为绿色氧化剂,因而受到人们越来越多的关注。
I.某实验小组以H2O2分解为例,探究浓度、催化剂、溶液酸碱性对反应速率的影响。在常温下按照如下表所示的方案完成实验。
(1)实验①和②的目的是_________________________________ 。同学们进行实验时没有观察到明显现象而无法得出结论。资料显示,通常条件下H2O2稳定,不易分解。为了达到实验目的,你对原实验方案的改进方法是_________________________ (填一种方法即可)。
(2)实验③④⑤中,测得生成氧气的体积随时间变化的关系如图所示。
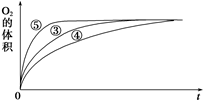
分析该图能够得出的实验结论是________________________________ 。
II.资料显示,某些金属离子或金属氧化物对H2O2的分解起催化作用。为比较Fe3+和Cu2+对H2O2分解的催化效果,该实验小组的同学设计了如下图所示的实验装置进行实验。
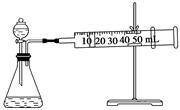
(1)某同学通过测定O2的体积来比较H2O2的分解速率快慢,实验时可以通过测量_______ 或______ 来比较。
(2)0.1 g MnO2粉末加入50 mL H2O2溶液中,在标准状况下放出气体的体积和时间的关系如图所示。请解释化学反应速率变化的原因:_____________ 。请计算H2O2的初始物质的量浓度为________________ (保留两位有效数字)。
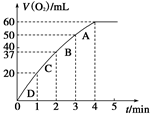
为探究MnO2在此实验中对H2O2的分解起催化作用,需补做下列实验(无 需写出具体操作):a._________________ ;b.___________________ 。
I.某实验小组以H2O2分解为例,探究浓度、催化剂、溶液酸碱性对反应速率的影响。在常温下按照如下表所示的方案完成实验。
| 实验编号 | 反应物 | 催化剂 |
| ① | 10 mL 2% H2O2溶液 | 无 |
| ② | 10 mL 5% H2O2溶液 | 无 |
| ③ | 10 mL 5% H2O2溶液 | 1 mL 0.1 mol·L-1FeCl3溶液 |
| ④ | 10 mL 5% H2O2溶液+少量HCl溶液 | 1 mL 0.1 mol·L-1FeCl3溶液 |
| ⑤ | 10 mL 5% H2O2溶液+少量NaOH溶液 | 1 mL 0.1 mol·L-1FeCl3溶液 |
(2)实验③④⑤中,测得生成氧气的体积随时间变化的关系如图所示。

分析该图能够得出的实验结论是
II.资料显示,某些金属离子或金属氧化物对H2O2的分解起催化作用。为比较Fe3+和Cu2+对H2O2分解的催化效果,该实验小组的同学设计了如下图所示的实验装置进行实验。

(1)某同学通过测定O2的体积来比较H2O2的分解速率快慢,实验时可以通过测量
(2)0.1 g MnO2粉末加入50 mL H2O2溶液中,在标准状况下放出气体的体积和时间的关系如图所示。请解释化学反应速率变化的原因:

为探究MnO2在此实验中对H2O2的分解起催化作用,需补做下列实验(无 需写出具体操作):a.
更新时间:2019-01-30 18:14:09
|
【知识点】 外因对化学反应速率影响的综合分析解读
相似题推荐
解答题-工业流程题
|
较难
(0.4)
解题方法
【推荐1】工业上以软锰矿(主要成分为MnO2,还含有少量Fe2O3等)和辉铜矿(主要成分为Cu2S,还含有少量Si、Ni等氧化物)为原料,制备碳酸锰和胆矾的工艺流程如图所示。
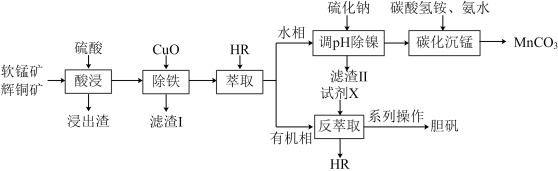
已知:HR萃取Cu2+的原理为Cu2+(aq)+2HR(org) CuR2(org)+2H+(aq)(org为有机相)。
CuR2(org)+2H+(aq)(org为有机相)。
回答下列问题:
(1)为了加快“酸浸”速率,可采取的措施是________ (答出任意两条即可);已知浸出渣中含有单质S,写出“酸浸”时MnO2与Cu2S反应的离子方程式:________ 。
(2)得到“滤渣I”的操作:________ 。
(3)写出“碳化沉锰”过程中发生反应的离子方程式:________ 。
(4)试剂X为________ (填化学式);“系列操作”包括________ 、过滤、洗涤和干燥。

已知:HR萃取Cu2+的原理为Cu2+(aq)+2HR(org)
 CuR2(org)+2H+(aq)(org为有机相)。
CuR2(org)+2H+(aq)(org为有机相)。回答下列问题:
(1)为了加快“酸浸”速率,可采取的措施是
(2)得到“滤渣I”的操作:
(3)写出“碳化沉锰”过程中发生反应的离子方程式:
(4)试剂X为
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
【推荐2】硫酸锌(ZnSO4)是制备各种含锌材料的原料,在防腐、电镀、医学上有诸多应用。硫酸锌可由菱锌矿制备菱锌矿的主要成分为ZnCO3,杂质为SiO2以及Ca、Mg、Fe、Cu等的化合物。其制备流程如图:

该工艺条件下,溶液中金属离子开始沉淀和完全沉淀的pH如表所示:
回答下列问题:
(1)菱锌矿焙烧生成氧化锌的化学方程式为____ 。
(2)为了提高锌的浸取效果,可采取的措施有____ (填写一种措施即可)。
(3)加入物质X调溶液pH=5,最适宜使用的X是____ (填字母代号)。
A.NH3•H2O B.Ca(OH)2 C.NaOH
滤渣①的主要成分是____ 、____ 、____ (填化学式)。
(4)向80~90℃的滤液①中分批加入适量KMnO4溶液充分反应后过滤,滤渣②中有MnO2,该步反应的离子方程式为____ 。
(5)滤液②中加入锌粉的目的是____ 。
(6)滤渣④与浓H2SO4反应可以释放HF并循环利用,同时得到的副产物是____ 、____ (填化学式)。

该工艺条件下,溶液中金属离子开始沉淀和完全沉淀的pH如表所示:
| 金属离子 | Fe3+ | Fe2+ | Mg2+ | Cu2+ | Zn2+ |
| 开始沉淀pH | 1.9 | 7.0 | 8.1 | 5.1 | 6.0 |
| 完全沉淀pH | 3.2 | 9.0 | 9.4 | 6.4 | 8.0 |
(1)菱锌矿焙烧生成氧化锌的化学方程式为
(2)为了提高锌的浸取效果,可采取的措施有
(3)加入物质X调溶液pH=5,最适宜使用的X是
A.NH3•H2O B.Ca(OH)2 C.NaOH
滤渣①的主要成分是
(4)向80~90℃的滤液①中分批加入适量KMnO4溶液充分反应后过滤,滤渣②中有MnO2,该步反应的离子方程式为
(5)滤液②中加入锌粉的目的是
(6)滤渣④与浓H2SO4反应可以释放HF并循环利用,同时得到的副产物是
您最近一年使用:0次
解答题-无机推断题
|
较难
(0.4)
解题方法
【推荐3】雾霾天气严重影响人们的生活质量,其中氮氧化物是造成雾霾天气的主要原因之一。
消除氮氧化物有多种方法。
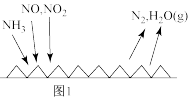
Ⅰ. 催化还原氮氧化物
催化还原氮氧化物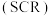 技术是目前最广泛的烟气氮氧化物脱除技术。反应原理如图所示。
技术是目前最广泛的烟气氮氧化物脱除技术。反应原理如图所示。
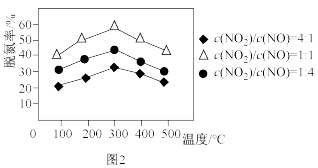
(1)用 作催化剂,在氨气足量的情况下,不同
作催化剂,在氨气足量的情况下,不同 对应的脱氮率如图2所示,效果最佳的
对应的脱氮率如图2所示,效果最佳的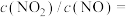
_______ 。
(2)SCR技术可使氮氧化物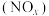 与
与 直接反应,实现无害转化。当
直接反应,实现无害转化。当 和
和 的物质的量之比为
的物质的量之比为 时,写出发生反应的化学方程式
时,写出发生反应的化学方程式_______ 。
Ⅱ.碱液吸收法是人们研究最早最多的一类氮氧化物处理法,工业上应用较多的吸收液是 和
和 ,尤其是
,尤其是 应用更广。已知:
应用更广。已知: ;
;
(3) 溶液吸收氮氧化物反应过程与
溶液吸收氮氧化物反应过程与 溶液吸收氮氧化物反应类似,写出
溶液吸收氮氧化物反应类似,写出 溶液与
溶液与 反应的离子方程式
反应的离子方程式_______ 。
(4)碱液吸收法对烟气中氮氧化物吸收效率不高,为了提高碱液对氮氧化物的吸收效率,下列措施错误的是_______ 。
A.增大 溶液或
溶液或 溶液浓度
溶液浓度
B.增大氮氧化物气体通入碱液的流速
C.将氮氧化物通入氧化剂氧化后再用碱液吸收
D.提高氮氧化物中 的百分含量
的百分含量
E.增大氮氧化物气体与碱液接触面积
Ⅲ.为探究某地区雾霾中的可溶性颗粒的成分,某化学研究性学习小组进行了实验探究。
[查阅资料]雾霾颗粒样品中可能含有 、
、 、
、 、
、 、
、 、
、 、
、 及一种常见阳离子
及一种常见阳离子 ,现进行如下实验:
,现进行如下实验:
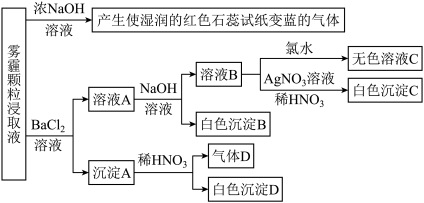
请回答下列问题:
(5)根据上述实验,雾霥浸取液中一定含有的离子为_______ ;肯定不含的离子为_______ 。
(6)若气体D遇空气会变成红棕色,则沉淀A中一定含有_______ (填化学式)。
消除氮氧化物有多种方法。
Ⅰ.
 催化还原氮氧化物
催化还原氮氧化物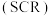 技术是目前最广泛的烟气氮氧化物脱除技术。反应原理如图所示。
技术是目前最广泛的烟气氮氧化物脱除技术。反应原理如图所示。
(1)用
 作催化剂,在氨气足量的情况下,不同
作催化剂,在氨气足量的情况下,不同 对应的脱氮率如图2所示,效果最佳的
对应的脱氮率如图2所示,效果最佳的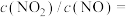

(2)SCR技术可使氮氧化物
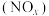 与
与 直接反应,实现无害转化。当
直接反应,实现无害转化。当 和
和 的物质的量之比为
的物质的量之比为 时,写出发生反应的化学方程式
时,写出发生反应的化学方程式Ⅱ.碱液吸收法是人们研究最早最多的一类氮氧化物处理法,工业上应用较多的吸收液是
 和
和 ,尤其是
,尤其是 应用更广。已知:
应用更广。已知: ;
;
(3)
 溶液吸收氮氧化物反应过程与
溶液吸收氮氧化物反应过程与 溶液吸收氮氧化物反应类似,写出
溶液吸收氮氧化物反应类似,写出 溶液与
溶液与 反应的离子方程式
反应的离子方程式(4)碱液吸收法对烟气中氮氧化物吸收效率不高,为了提高碱液对氮氧化物的吸收效率,下列措施错误的是
A.增大
 溶液或
溶液或 溶液浓度
溶液浓度B.增大氮氧化物气体通入碱液的流速
C.将氮氧化物通入氧化剂氧化后再用碱液吸收
D.提高氮氧化物中
 的百分含量
的百分含量E.增大氮氧化物气体与碱液接触面积
Ⅲ.为探究某地区雾霾中的可溶性颗粒的成分,某化学研究性学习小组进行了实验探究。
[查阅资料]雾霾颗粒样品中可能含有
 、
、 、
、 、
、 、
、 、
、 、
、 及一种常见阳离子
及一种常见阳离子 ,现进行如下实验:
,现进行如下实验:
请回答下列问题:
(5)根据上述实验,雾霥浸取液中一定含有的离子为
(6)若气体D遇空气会变成红棕色,则沉淀A中一定含有
您最近一年使用:0次



