图表法是常用的科学研究方法,下表列出了同周期的四种短周期元素的部分性质(“电负性”即元素对应原子吸引电子能力的标度):
请回答下列问题:
(1)写出E元素的离子结构示意图______________________ ;
(2)X的值应为___________ (填字母);
A.3.6 B.3.1 C.2.1 D.1.4
(3)分析表中数据,简述同周期元素(除惰性气体)电负性大小与原子半径的关系_______________ ;
(4)A、B、C三种元素形成的氢化物中,其稳定性由强到弱的顺序是:__________ (用化学式表示)
(5)A、D最高价氧化物对应水化物相互反应的化学方程式:_____________
(6)D、E最高价氧化物对应水化物相互反应的离子方程式:_____________
| 元素编号 | A | B | C | D | E |
| 电负性 | 3.0 | 2.5 | X | 1.5 | 0.9 |
| 原子半径(单位nm) | 0.099 | 0.102 | 0.110 | 0.143 | 0.186 |
| 主要化合价 | -1,+7 | -2,+6 | -3,+5 | +3 | +1 |
(1)写出E元素的离子结构示意图
(2)X的值应为
A.3.6 B.3.1 C.2.1 D.1.4
(3)分析表中数据,简述同周期元素(除惰性气体)电负性大小与原子半径的关系
(4)A、B、C三种元素形成的氢化物中,其稳定性由强到弱的顺序是:
(5)A、D最高价氧化物对应水化物相互反应的化学方程式:
(6)D、E最高价氧化物对应水化物相互反应的离子方程式:
14-15高一下·河南·期中 查看更多[5]
2014-2015河南省实验中学高一下学期期中考试化学试卷2016-2017学年山西省太原市外国语学校高一下学期第一次月考化学试卷(已下线)第04章 物质结构 元素周期律(B卷能力提高篇)——2020-2021学年高一化学必修第一册同步单元AB卷(新教材人教版)天津市耀华中学2022-2023学年高一上学期期末考试化学试题天津市耀华中学2022-2023学年高一上学期期末考试化学试题
更新时间:2016-12-09 08:06:37
|
相似题推荐
解答题-结构与性质
|
适中
(0.65)
【推荐1】据世界权威刊物《自然》最近报道,我国科学家选择碲化锆(ZrTe2)和砷化镉(Cd3As2)为材料验证了三维量子霍尔效应,并发现了金属-绝缘体的转换。回答下列问题:
(1)锌和镉位于同副族,而锌与铜相邻。现有4种铜、锌元素的相应状态,①锌:[Ar]3d104s2、②锌:[Ar]3d104s1、③铜:[Ar]3d104s1、④铜:[Ar]3d10。失去1个电子需要的能量由大到小排序是_______ (填选项标号)。
A.④②①③ B.④②③① C.①②④③ D.①④③②
(2)硫和碲位于同主族,H2S的分解温度高于H2Te,其主要原因是_______ 。在硫的化合物中,H2S、CS2都是三原子分子,但它们的键角(立体构型)差别很大,用价层电子对互斥理论解释:_______ ;用杂化轨道理论解释:_______ 。
(3)Cd2+与NH3等配体形成配离子。[Cd(NH3)4]2中2个NH3被2个Cl替代只得到1种结构,它的立体构型是_______ 。1 mol NH3含_______ mol σ键。
(4)砷与卤素形成多种卤化物。AsCl3、AsF3、AsBr3的熔点由高到低的排序为_______ 。
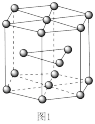
(5)锆晶胞如图1所示,1个晶胞含_______ 个Zr原子;这种堆积方式称为_______ 。
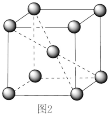
(6)镉晶胞如图2所示。已知:NA是阿伏加德罗常数的值,晶体密度为dg·cm-3。在该晶胞中两个镉原子最近核间距为_______ nm(用含NA、d的代数式表示),镉晶胞中原子空间利用率为_______ (用含π的代数式表示)。
(1)锌和镉位于同副族,而锌与铜相邻。现有4种铜、锌元素的相应状态,①锌:[Ar]3d104s2、②锌:[Ar]3d104s1、③铜:[Ar]3d104s1、④铜:[Ar]3d10。失去1个电子需要的能量由大到小排序是
A.④②①③ B.④②③① C.①②④③ D.①④③②
(2)硫和碲位于同主族,H2S的分解温度高于H2Te,其主要原因是
(3)Cd2+与NH3等配体形成配离子。[Cd(NH3)4]2中2个NH3被2个Cl替代只得到1种结构,它的立体构型是
(4)砷与卤素形成多种卤化物。AsCl3、AsF3、AsBr3的熔点由高到低的排序为
(5)锆晶胞如图1所示,1个晶胞含

(6)镉晶胞如图2所示。已知:NA是阿伏加德罗常数的值,晶体密度为dg·cm-3。在该晶胞中两个镉原子最近核间距为

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐2】含铁化合物的应用研究是科学研究的前沿之一,回答下列问题:
Ⅰ、铁铝铅榴石常用作宝石和研磨材料,其化学式为Fe3Al2Pb3(SiO4)5,可写作氧化物形式:FexOy·Al2O3·3PbO·5SiO2。
(1)FexOy中铁元素有+2、+3两种价态,N(Fe3+):N(Fe2+)=______ 。
(2)硅属于______ 区元素;基态铁原子的电子排布式为_____________ 。
(3)氧的第一电离能_____ 氮(填“大于”或“小于”);工业上用γ−Al2O3冶炼铝,其熔点很高,熔融时需用助熔剂,γ−Al2O3属于______ 晶体。
(4)SiO2是原硅酸和硅酸的酸酐。
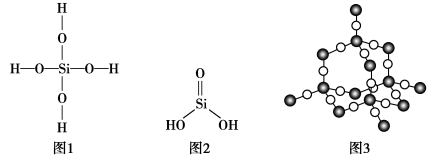
①原硅酸的结构式如图1,硅原子的价电子对的空间构型为___________ 。
②原硅酸失去一分子水后形成硅酸,结构式如图2,硅原子的杂化方式为_________ 。
③SiO2晶体结构如图3,硅原子的配位数为_________ 。
Ⅱ、已知:NA为阿伏加德罗常数的值;图Ⅰ、图Ⅱ表示的晶胞均为立方晶胞。
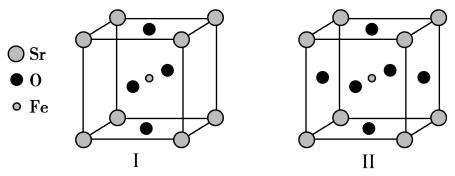
(5)下面晶胞化学式为SrFeO3的是______ (填“Ⅰ”或“Ⅱ”)。
(6)图Ⅰ所示晶胞密度为dg·cm-3,则该晶胞的边长为_____ nm(用含NA的式子表示)。
Ⅰ、铁铝铅榴石常用作宝石和研磨材料,其化学式为Fe3Al2Pb3(SiO4)5,可写作氧化物形式:FexOy·Al2O3·3PbO·5SiO2。
(1)FexOy中铁元素有+2、+3两种价态,N(Fe3+):N(Fe2+)=
(2)硅属于
(3)氧的第一电离能
(4)SiO2是原硅酸和硅酸的酸酐。

①原硅酸的结构式如图1,硅原子的价电子对的空间构型为
②原硅酸失去一分子水后形成硅酸,结构式如图2,硅原子的杂化方式为
③SiO2晶体结构如图3,硅原子的配位数为
Ⅱ、已知:NA为阿伏加德罗常数的值;图Ⅰ、图Ⅱ表示的晶胞均为立方晶胞。

(5)下面晶胞化学式为SrFeO3的是
(6)图Ⅰ所示晶胞密度为dg·cm-3,则该晶胞的边长为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐3】[化学一选修3:物质结构与性质]第四周期的过渡元素在工业、农业、科学技术以及人类生活等方面有重要作用。其中Ni-Cr-Fe合金是常用的电热元件材料。请回答:
(1)基态Ni原子核外电子排布式为_______ ;第二周期中基态原子未成对电子数与Ni相同且电负性大的元素为________ 。金属镍粉在CO气流中轻微加热,生成无色挥发性液态Ni(CO) ,该分子呈正四面体构型。试推测Ni(CO)
,该分子呈正四面体构型。试推测Ni(CO) 的晶体类型为
的晶体类型为________ ,Ni(CO) 易溶于下列
易溶于下列_______ (填选项字母)中。
(2)FeO、NiO晶体中r(Ni2+)和r(Fe2+)分别为69 pm和78 pm,则熔点NiO_________ FeO(填“>”或“<”),原因为_____________ ;黄血盐是一种配合物,其化学式为K4[Fe(CN)6] ·3H2O,该配合物中配体的化学式为_________ ,黄血盐溶液与稀硫酸加热时发生非氧化还原反应,生成硫酸盐和一种与该配体互为等电子体的气态化合物,该反应的化学方程式为_______________ 。
(3)酸性高锰酸钾溶液能氧化硝基苯酚,邻硝基苯酚和对硝基苯酚在20 水中的溶解度之比为0.39,其原因为
水中的溶解度之比为0.39,其原因为_________ 。
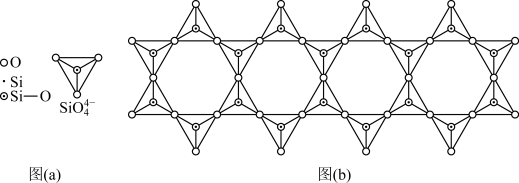
(4)在铬的硅酸盐中,SiO44-四面体[如下图(a)]通过共用顶角氧离子可形成岛状、链状、层状、骨架网状四大结构型式。图(b)为一种链状结构的多硅酸根,其中Si原子的杂化形式为________ ,其化学式为_________ 。
(1)基态Ni原子核外电子排布式为
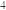 ,该分子呈正四面体构型。试推测Ni(CO)
,该分子呈正四面体构型。试推测Ni(CO)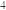 的晶体类型为
的晶体类型为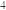 易溶于下列
易溶于下列| A.水 | B.四氯化碳 | C.苯 | D.硫酸镍溶液 |
(3)酸性高锰酸钾溶液能氧化硝基苯酚,邻硝基苯酚和对硝基苯酚在20
 水中的溶解度之比为0.39,其原因为
水中的溶解度之比为0.39,其原因为(4)在铬的硅酸盐中,SiO44-四面体[如下图(a)]通过共用顶角氧离子可形成岛状、链状、层状、骨架网状四大结构型式。图(b)为一种链状结构的多硅酸根,其中Si原子的杂化形式为

您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
解题方法
【推荐1】W,X,Y,Z四种短周期元素,原子序数依次增大,在周期表中W与X相邻,Y与Z相邻。已知W元素的氢化物与Z元素的氢化物反应只生成一种盐a;X,Y位于同一族,它们能组成YX2,YX3两种常见化合物。请回答下列问题:
(1)X元素位于周期表的位置为_______________ 。
(2)X,Y,Z三种元素形成的单质中,氧化性最弱的是________ (填化学式)。
(3)a溶液的pH____ 7(填“>”、“<”或“=”),用离子方程式解释为:___________ 。
(4)Y与Z可形成共价化合物Y2Z2,分子中Y与Z均满足8电子稳定结构,则Y2Z2的电子式为______ 。Y2Z2遇水很易反应,产生的气体能使品红溶液褪色,则其与水反应的化学方程式为_________ 。
(5)工业上用氧化WH3法制取WO,该反应的热化学方程式为:4WH3(g)+5O2(g)=4WO(g)+6H2O(g)∆H=-905.8kJ/mol;已知W2(g)+O2(g)=2WO(g)∆H=+180kJ/mol,则WH3与氧气反应产生两种无污染物质的热化学方程式为__________________ 。
(1)X元素位于周期表的位置为
(2)X,Y,Z三种元素形成的单质中,氧化性最弱的是
(3)a溶液的pH
(4)Y与Z可形成共价化合物Y2Z2,分子中Y与Z均满足8电子稳定结构,则Y2Z2的电子式为
(5)工业上用氧化WH3法制取WO,该反应的热化学方程式为:4WH3(g)+5O2(g)=4WO(g)+6H2O(g)∆H=-905.8kJ/mol;已知W2(g)+O2(g)=2WO(g)∆H=+180kJ/mol,则WH3与氧气反应产生两种无污染物质的热化学方程式为
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
【推荐2】下表为元素周期表中主族元素的相关信息,其中W、T、X、Y、Z、M为短周期元素。

请依据上述信息回答下列问题:
(1)R在元素周期表的位置是第___________ 周期第___________ 族。
(2)Z离子(Z-)的原子结构示意图:___________ 。
(3)X与Y形成的化合物的性质决定了它在物质的分类中应属于___________ ;
(4)X、M分别与W形成的化合物中较稳定的是___________ (写化学式)。
(5)T和W形成的化合物TW可在野外用作供氢剂。请写出TW跟水反应化学方程式:___________ 。
(6)将A的水溶液逐滴加入到Y与Z形成的化合物的水溶液中,直至过量(边滴加边振荡),此过程中的现象是___________ 。
(7)写出Z2与水反应的化学方程式:___________ 。向Z2的水溶液中滴加几滴紫色石蕊溶液,现象为___________ 。
(8)Z的单质(Z2)和Z的氧化物(ZO2)都可以做饮用水消毒剂,相同质量的两种消毒剂消毒效果较好的是___________ (用化学式表示)。
| 元素 | 相关信息 |
| W | W在自然界中有三种核素,其中一核素没有中子 |
| T | T为第三周期元素,其最高价氧化物的水化物A是一种强碱 |
| X | X的原子最外层电子数是其内层电子数的三倍 |
| Y | Y是自然界中含量最高的金属 |
| Z | T、X、Z组成的36电子的化合物B是家用消毒剂的主要成分 |
| M | 元素原子最外层比次外层少2个电子 |
| R | R在元素周期表中的位置如图所示 |

请依据上述信息回答下列问题:
(1)R在元素周期表的位置是第
(2)Z离子(Z-)的原子结构示意图:
(3)X与Y形成的化合物的性质决定了它在物质的分类中应属于
(4)X、M分别与W形成的化合物中较稳定的是
(5)T和W形成的化合物TW可在野外用作供氢剂。请写出TW跟水反应化学方程式:
(6)将A的水溶液逐滴加入到Y与Z形成的化合物的水溶液中,直至过量(边滴加边振荡),此过程中的现象是
(7)写出Z2与水反应的化学方程式:
(8)Z的单质(Z2)和Z的氧化物(ZO2)都可以做饮用水消毒剂,相同质量的两种消毒剂消毒效果较好的是
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
【推荐3】今有原子序数依次增大的A、B、C、D、E、F六种元素。已知A、C、F三原子的最外层共有11个电子,且这三种元素的最高价氧化物的水化物之间,两两皆能反应且均能生成盐和水。D和E各有如下表的电子层结构。
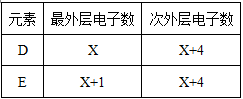
按要求填空:
(1)A的元素符号_______ ,质子数比中子数少2的B元素的一种核素的符号___ ,F的原子结构示意图___________ 。
(2)D和E两者的氢化物稳定性较强的是__________ (填化学式)。
(3)C单质与A元素的最高价氧化物对应的水化物反应的离子方程式为____ 。
(4)工业上制取单质D的化学方程式为__________ 。

按要求填空:
(1)A的元素符号
(2)D和E两者的氢化物稳定性较强的是
(3)C单质与A元素的最高价氧化物对应的水化物反应的离子方程式为
(4)工业上制取单质D的化学方程式为
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
解题方法
【推荐1】下表为长式周期表的一部分,其中的编号代表对应的元素。请回答下列问题:

(1)上表①~⑩十种元素中金属性最强的是___________ ,非金属性最强的是___________ ;(填元素符号)
(2)用电子式写出表中元素④原子与元素⑦原子形成化合物的过程___________ ;
(3)写出元素⑥与元素⑩的形成化合物的电子式___________ ;
(4)写出③元素的最高价氧化物对应的水化物的稀溶液与过量的元素⑨单质反应的离子方程式___________ ;
(5)某些不同族元素的性质也有一定的相似性,如上表中元素⑤与元素②的氢氧化物有相似的性质。请写出元素②的氢氧化物与元素⑧的最高价氧化物对应的水化物的溶液反应的化学方程式:___________ 。

(1)上表①~⑩十种元素中金属性最强的是
(2)用电子式写出表中元素④原子与元素⑦原子形成化合物的过程
(3)写出元素⑥与元素⑩的形成化合物的电子式
(4)写出③元素的最高价氧化物对应的水化物的稀溶液与过量的元素⑨单质反应的离子方程式
(5)某些不同族元素的性质也有一定的相似性,如上表中元素⑤与元素②的氢氧化物有相似的性质。请写出元素②的氢氧化物与元素⑧的最高价氧化物对应的水化物的溶液反应的化学方程式:
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
解题方法
【推荐2】下表为元素周期表的一部分:
Ⅰ.用化学用语回答下列问题:
(1)写出元素④在周期表中的位置:________ ;
(2)②③⑤的原子半径由大到小的顺序为_______________ ;
(3)④⑤⑥的气态氢化物的稳定性由强到弱的顺序是____________ ;
(4)①②③⑥中的某些元素可形成既含离子键又含极性共价键的化合物,写出其中两种化合物的电子式:____________ 。
Ⅱ.由上述部分元素组成的物质间,在一定条件下,可以发生下图中的变化,其中A是一
种淡黄色固体。则:

(5)写出固体A与液体X反应的离子方程式:________________ ;
(6)气体Y是一种大气污染物,直接排放会形成酸雨。可用溶液B吸收,当B与Y物质的量之比为1∶1且恰好完全反应时,所得溶液D的溶质为_____ (填化学式);已知溶液D显酸性,则D溶液中各种离子浓度由大到小的顺序为____________________________ ;
(7)在100 mL 18 mol/L的F浓溶液中加入过量铜片,加热使之充分反应,产生气体的体积(标况下)可能为: 。
| 周期 族 | ||||||||
| 1 | ① | |||||||
| 2 | ② | |||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ||||
(1)写出元素④在周期表中的位置:
(2)②③⑤的原子半径由大到小的顺序为
(3)④⑤⑥的气态氢化物的稳定性由强到弱的顺序是
(4)①②③⑥中的某些元素可形成既含离子键又含极性共价键的化合物,写出其中两种化合物的电子式:
Ⅱ.由上述部分元素组成的物质间,在一定条件下,可以发生下图中的变化,其中A是一
种淡黄色固体。则:

(5)写出固体A与液体X反应的离子方程式:
(6)气体Y是一种大气污染物,直接排放会形成酸雨。可用溶液B吸收,当B与Y物质的量之比为1∶1且恰好完全反应时,所得溶液D的溶质为
(7)在100 mL 18 mol/L的F浓溶液中加入过量铜片,加热使之充分反应,产生气体的体积(标况下)可能为: 。
| A.40.32 L | B.30.24 L | C.20.16 L | D.13.44 L |
您最近一年使用:0次
【推荐3】下表列出了前20号元素中某些元素性质的一些数据:
试回答下列问题:
(1)以上10种元素中,第一电离能最小的是___________ (填编号)。
(2)上述⑤、⑥、⑦三种元素中的某两种元素形成的化合物中,每一个原子都满足8e-稳定结构的物质可能是___________ (写分子式)。元素⑨和⑩形成的化合物的化学式为___________ ;元素①的原子价电子排布式是___________ 。
(3)①、⑥、⑦、⑩四种元素的气态氢化物的稳定性,由强到弱的顺序是___________ (填化学式)。
(4)③和⑨两元素比较,非金属性较弱的是___________ (填名称),可以验证你的结论的是下列中的___________ (填序号)。
A.气态氢化物的挥发性
B.单质分子中的键能
C.两元素的电负性
D.含氧酸的酸性
E.氢化物中X—H键的键长(X代表③和⑨两元素)
F.两单质在自然界中的存在形式
| 性质元素 | 原子半径(10-19 m) | 最高价态 | 最低价态 |
| ① | 1.02 | +6 | -2 |
| ② | 2.27 | +1 | — |
| ③ | 0.74 | — | -2 |
| ④ | 1.43 | +3 | — |
| ⑤ | 0.77 | +4 | -4 |
| ⑥ | 1.10 | +5 | -3 |
| ⑦ | 0.99 | +7 | -1 |
| ⑧ | 1.86 | +1 | — |
| ⑨ | 0.75 | +5 | -3 |
| ⑩ | 1.17 | +4 | -4 |
(1)以上10种元素中,第一电离能最小的是
(2)上述⑤、⑥、⑦三种元素中的某两种元素形成的化合物中,每一个原子都满足8e-稳定结构的物质可能是
(3)①、⑥、⑦、⑩四种元素的气态氢化物的稳定性,由强到弱的顺序是
(4)③和⑨两元素比较,非金属性较弱的是
A.气态氢化物的挥发性
B.单质分子中的键能
C.两元素的电负性
D.含氧酸的酸性
E.氢化物中X—H键的键长(X代表③和⑨两元素)
F.两单质在自然界中的存在形式
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
【推荐1】A、B、C、D为原子序数依次增大的四种元素,A2-和B+具有相同的电子构型:C、D为同周期元素,C核外电子总数是最外层电子数的3倍;D元素最外层有一个未成对电子。回答下列问题:
(1)四种元素中电负性最大的是___________ (填元素符号)
(2)C和D反应可生成组成比为1∶3的化合物E,E的立体构型为___________ ,中心原子的杂化轨道类型为___________ 。
(3)单质D与湿润的Na2CO3反应可制备D2A,其化学方程式为___________ 。
(4)A和B能够形成化合物F,其晶胞结构如图所示,晶胞参数a=0.566nm,F的化学式为___________ ;晶胞中A原子的配位数为___________ ;列式计算晶体F的密度(g·cm-3)___________ 。

(1)四种元素中电负性最大的是
(2)C和D反应可生成组成比为1∶3的化合物E,E的立体构型为
(3)单质D与湿润的Na2CO3反应可制备D2A,其化学方程式为
(4)A和B能够形成化合物F,其晶胞结构如图所示,晶胞参数a=0.566nm,F的化学式为

您最近一年使用:0次
【推荐2】A、B、C、D、E是元素周期表中前四周期的元素,其原子序数依次增大,A为元素周期表中原子半径最小的元素,B的基态原子中占有电子的3个能级上的电子数均相等,D与B同族,C与B同周期,且C的所有p轨道上的电子数与所有s轨道上的电子数相等,E的次外层电子数是其最外层电子的7倍。
回答下列问题:
(1)B、C、D三种元素的电负性由小到大的顺序为___________ ;(用元素符号表示),D元素基态原子价层电子排布式为______________________ ;
(2)A、C形成的三原子分子中,C原子的杂化方式为___________ ;
(3)C、D形成的化合物的晶体类型为___________ ;
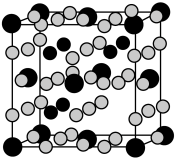
(4)金属Mg与A、E形成的化合物是目前人类已发现的体积储氢密度最高的储氢材料之一,其晶胞结构如图所示,其中黑球代表E,灰球代表Mg,白球代表A,其中白球除在棱上、面上以外,在晶胞内部还有6个。试写出该化合物的化学式:______________________ 。
(5)B、C、E能形成如图所示三角双锥构型的配合物分子,三种元素的原子分别用大白球、小白球和黑球代表。
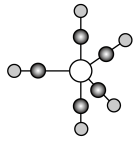
该配合物形成配位键时提供空轨道的原子是___________ (填元素符号),该配合物中大白球代表的元素的化合价为___________ 。
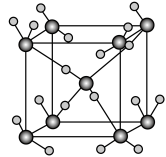
①在水溶液中,水以多种微粒的形式与其他化合物形成水合物。试画出如下微粒的结构图式。H5O2+:______________________
②如图为冰的一种骨架形式,依此为单位向空间延伸该冰中的每个水分子有___________ 个氢键;如果不考虑晶体和键的类型,哪一物质的空间连接方式与这种冰的连接类似______________________
回答下列问题:
(1)B、C、D三种元素的电负性由小到大的顺序为
(2)A、C形成的三原子分子中,C原子的杂化方式为
(3)C、D形成的化合物的晶体类型为
(4)金属Mg与A、E形成的化合物是目前人类已发现的体积储氢密度最高的储氢材料之一,其晶胞结构如图所示,其中黑球代表E,灰球代表Mg,白球代表A,其中白球除在棱上、面上以外,在晶胞内部还有6个。试写出该化合物的化学式:

(5)B、C、E能形成如图所示三角双锥构型的配合物分子,三种元素的原子分别用大白球、小白球和黑球代表。

该配合物形成配位键时提供空轨道的原子是
①在水溶液中,水以多种微粒的形式与其他化合物形成水合物。试画出如下微粒的结构图式。H5O2+:
②如图为冰的一种骨架形式,依此为单位向空间延伸该冰中的每个水分子有

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
【推荐3】下图为元素周期表的一部分,字母下方数值为该元素电负性,根据信息回答下列问题(用相应元素符号进行答题):

(1)b、h两元素可形成化合物bh2,写出其电子式:_______ 。
(2)e、b分别和g元素形成两种化合物eg3、bg2,eg3的分子构型为_______ ,eg3、bg2中心原子的杂化方式分别为_______ 。
(3)d元素形成的单质可与g的氢化物浓溶液在加热条件下反应生成一种以二价d离子为内界中心原子(配位数为4)的配位化合物与一种可燃性气体,写出反应的化学方程式:_______ 。
(4)f、g、h、i四种元素对应单质分子的键能如下表:
试从原子半径角度阐述f—f键键能反常的原因:_______ 。
(5)c元素的元素符号是_______ ,价电子排布式为_______ 。

(1)b、h两元素可形成化合物bh2,写出其电子式:
(2)e、b分别和g元素形成两种化合物eg3、bg2,eg3的分子构型为
(3)d元素形成的单质可与g的氢化物浓溶液在加热条件下反应生成一种以二价d离子为内界中心原子(配位数为4)的配位化合物与一种可燃性气体,写出反应的化学方程式:
(4)f、g、h、i四种元素对应单质分子的键能如下表:
| 共价键 | f-f | g-g | h-h | i-i |
| 键能(kJ/mol) | 157 | 242.7 | 193.7 | 152.7 |
(5)c元素的元素符号是
您最近一年使用:0次



