有pH=1的①盐酸②硫酸③醋酸
(1)设三种溶液的物质的量浓度分别为a、b、c,则其大小关系为_______________ 。
(2)同体积的三种溶液与足量的NaOH溶液反应生成盐的物质的量分别为a、b、c,则其大小关系为______________ 。
(3)完全中和物质的量浓度和体积都相同的NaOH溶液时,需三种酸溶液的体积分别为a、b、c,则其大小关系为_______________ 。
(1)设三种溶液的物质的量浓度分别为a、b、c,则其大小关系为
(2)同体积的三种溶液与足量的NaOH溶液反应生成盐的物质的量分别为a、b、c,则其大小关系为
(3)完全中和物质的量浓度和体积都相同的NaOH溶液时,需三种酸溶液的体积分别为a、b、c,则其大小关系为
11-12高二·河北石家庄·期中 查看更多[2]
更新时间:2016-12-09 01:58:34
|
【知识点】 弱电解质的电离
相似题推荐
填空题
|
适中
(0.65)
名校
【推荐1】氢氟酸能腐蚀玻璃。25℃下,向20mL0.2mol•L-1的氢氟酸中滴加0.2mol•L-1的NaOH溶液时,溶液的pH变化如图所示。
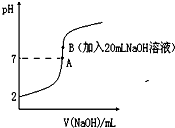
已知:电离度(α)和电离平衡常数(K)一样,可以用来衡量弱电解质在稀溶液中的电离能力。
请回答下列问题:
(1)在氢氟酸的稀溶液中,通过改变以下条件能使氢氟酸的电离度[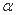 (HF)]增大的是
(HF)]增大的是_______ ,可使氢氟酸的电离平衡常数[Ka(HF)] 增大的是_____________ 。
a.升高温度 b.向溶液中滴入2滴浓盐酸 c.加入少量NaF固体 d.加水
(2)在此温度下,氢氟酸的电离平衡常数Ka(HF)为:_____ ,电离度α(HF)为______ %。
(3)下列有关图中各点微粒浓度关系正确的是________ 。
a.在A处溶液中:c(F—)+c(HF)=0.2 mol•L-1
b.在B处溶液中:c(H+)+c(HF)= c(OH—)
c.在B处溶液中:c(Na+)>c(F—)>c(H+)>c(OH—)
d.在A和B处溶液中都符合: = Ka(HF)
= Ka(HF)
(4)向此氢氟酸溶液中滴加10mlNaOH溶液后,请将HF分子与溶液中的离子浓度一起从大到小排序___________________________________________

已知:电离度(α)和电离平衡常数(K)一样,可以用来衡量弱电解质在稀溶液中的电离能力。

请回答下列问题:
(1)在氢氟酸的稀溶液中,通过改变以下条件能使氢氟酸的电离度[
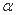 (HF)]增大的是
(HF)]增大的是a.升高温度 b.向溶液中滴入2滴浓盐酸 c.加入少量NaF固体 d.加水
(2)在此温度下,氢氟酸的电离平衡常数Ka(HF)为:
(3)下列有关图中各点微粒浓度关系正确的是
a.在A处溶液中:c(F—)+c(HF)=0.2 mol•L-1
b.在B处溶液中:c(H+)+c(HF)= c(OH—)
c.在B处溶液中:c(Na+)>c(F—)>c(H+)>c(OH—)
d.在A和B处溶液中都符合:
 = Ka(HF)
= Ka(HF)(4)向此氢氟酸溶液中滴加10mlNaOH溶液后,请将HF分子与溶液中的离子浓度一起从大到小排序
您最近半年使用:0次
填空题
|
适中
(0.65)
【推荐2】25℃时,几种弱电解质的电离平衡常数如表:
(1)下列3种酸溶液的物质的量浓度均为0.1mol·L-1,其中酸性最强的是___ (填标号)。
A.CH3COOH B.H2CO3 C.HClO
(2)NaHCO3溶液显___ 性(填“酸”、“碱”、“中”),用离子方程式解释其原因___ 。
(3)向盛有1mol·L-1MgCl2溶液的试管中滴加1~2滴2mol·L-1NaOH溶液,有白色沉淀生成。
①往沉淀中滴加少量NH4Cl溶液,沉淀溶解。
猜想一:氯化铵溶液完全电离出NH 与OH-结合,促进Mg(OH)2溶解;
与OH-结合,促进Mg(OH)2溶解;
猜想二:___ ;
②设计实验验证猜想一,实验方案为:往沉淀中滴加下列试剂___ (填标号),白色沉淀溶解,说明猜想一成立。
A.NH4NO3 B.CH3COONH4 C.NH4HCO3
(4)根据电离平衡常数数据,写出NaClO溶液中通入少量CO2的离子方程式:___ 。
(5)25℃时,若初始时醋酸中CH3COOH的物质的量浓度为0.01mol/L,达到电离平衡时溶液中c(H+)=___ mol/L。(已知: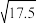 =4.2)
=4.2)
| 化学式 | CH3COOH | H2CO3 | HClO | NH3·H2O |
| 电离平衡常数 | 1.75×10-5 | K1=4.4×10-7 K2=4.7×10-11 | 3.0×10-8 | 1.8×10-5 |
(1)下列3种酸溶液的物质的量浓度均为0.1mol·L-1,其中酸性最强的是
A.CH3COOH B.H2CO3 C.HClO
(2)NaHCO3溶液显
(3)向盛有1mol·L-1MgCl2溶液的试管中滴加1~2滴2mol·L-1NaOH溶液,有白色沉淀生成。
①往沉淀中滴加少量NH4Cl溶液,沉淀溶解。
猜想一:氯化铵溶液完全电离出NH
 与OH-结合,促进Mg(OH)2溶解;
与OH-结合,促进Mg(OH)2溶解;猜想二:
②设计实验验证猜想一,实验方案为:往沉淀中滴加下列试剂
A.NH4NO3 B.CH3COONH4 C.NH4HCO3
(4)根据电离平衡常数数据,写出NaClO溶液中通入少量CO2的离子方程式:
(5)25℃时,若初始时醋酸中CH3COOH的物质的量浓度为0.01mol/L,达到电离平衡时溶液中c(H+)=
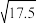 =4.2)
=4.2)
您最近半年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐3】常温下,向一定量的 (
( 为三元弱酸)溶液中逐滴加入NaOH溶液,含砷元素的各种微粒物质的量分数与溶液pH的关系如图所示。
为三元弱酸)溶液中逐滴加入NaOH溶液,含砷元素的各种微粒物质的量分数与溶液pH的关系如图所示。
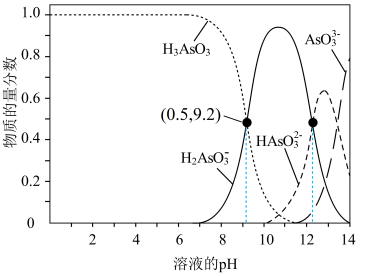
(1)人体血液的pH在7.35~7.45之间。服用含 的药物后,由上图可知,人体中含砷元素的微粒主要是
的药物后,由上图可知,人体中含砷元素的微粒主要是_______ (写化学式)。
(2) 第一步电离的电离方程式为
第一步电离的电离方程式为_______ ,结合图示,计算电离平衡常数
_______ 。
(3)请写出 溶液中各种离子浓度之间电荷守恒的关系式
溶液中各种离子浓度之间电荷守恒的关系式_______ 。
(4)0.10mol/L的 溶液中,
溶液中,
_______ mol/L。
(5)写出 溶液中发生水解的离子方程式
溶液中发生水解的离子方程式_______ 。
(6)向含 的废水中加入适量氧化剂,再加入生石灰将砷元素转化为
的废水中加入适量氧化剂,再加入生石灰将砷元素转化为 沉淀。若要除去
沉淀。若要除去 ,则溶液中的
,则溶液中的 至少为
至少为_______ mol/L。(已知:①当溶液中离子浓度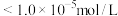 时,则该离子被除尽;②
时,则该离子被除尽;②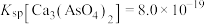 )
)
 (
( 为三元弱酸)溶液中逐滴加入NaOH溶液,含砷元素的各种微粒物质的量分数与溶液pH的关系如图所示。
为三元弱酸)溶液中逐滴加入NaOH溶液,含砷元素的各种微粒物质的量分数与溶液pH的关系如图所示。
(1)人体血液的pH在7.35~7.45之间。服用含
 的药物后,由上图可知,人体中含砷元素的微粒主要是
的药物后,由上图可知,人体中含砷元素的微粒主要是(2)
 第一步电离的电离方程式为
第一步电离的电离方程式为
(3)请写出
 溶液中各种离子浓度之间电荷守恒的关系式
溶液中各种离子浓度之间电荷守恒的关系式(4)0.10mol/L的
 溶液中,
溶液中,
(5)写出
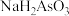 溶液中发生水解的离子方程式
溶液中发生水解的离子方程式(6)向含
 的废水中加入适量氧化剂,再加入生石灰将砷元素转化为
的废水中加入适量氧化剂,再加入生石灰将砷元素转化为 沉淀。若要除去
沉淀。若要除去 ,则溶液中的
,则溶液中的 至少为
至少为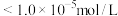 时,则该离子被除尽;②
时,则该离子被除尽;②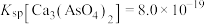 )
)
您最近半年使用:0次



