氢氟酸能腐蚀玻璃。25℃下,向20mL0.2mol•L-1的氢氟酸中滴加0.2mol•L-1的NaOH溶液时,溶液的pH变化如图所示。
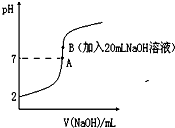
已知:电离度(α)和电离平衡常数(K)一样,可以用来衡量弱电解质在稀溶液中的电离能力。
请回答下列问题:
(1)在氢氟酸的稀溶液中,通过改变以下条件能使氢氟酸的电离度[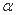 (HF)]增大的是
(HF)]增大的是_______ ,可使氢氟酸的电离平衡常数[Ka(HF)] 增大的是_____________ 。
a.升高温度 b.向溶液中滴入2滴浓盐酸 c.加入少量NaF固体 d.加水
(2)在此温度下,氢氟酸的电离平衡常数Ka(HF)为:_____ ,电离度α(HF)为______ %。
(3)下列有关图中各点微粒浓度关系正确的是________ 。
a.在A处溶液中:c(F—)+c(HF)=0.2 mol•L-1
b.在B处溶液中:c(H+)+c(HF)= c(OH—)
c.在B处溶液中:c(Na+)>c(F—)>c(H+)>c(OH—)
d.在A和B处溶液中都符合: = Ka(HF)
= Ka(HF)
(4)向此氢氟酸溶液中滴加10mlNaOH溶液后,请将HF分子与溶液中的离子浓度一起从大到小排序___________________________________________

已知:电离度(α)和电离平衡常数(K)一样,可以用来衡量弱电解质在稀溶液中的电离能力。

请回答下列问题:
(1)在氢氟酸的稀溶液中,通过改变以下条件能使氢氟酸的电离度[
 (HF)]增大的是
(HF)]增大的是a.升高温度 b.向溶液中滴入2滴浓盐酸 c.加入少量NaF固体 d.加水
(2)在此温度下,氢氟酸的电离平衡常数Ka(HF)为:
(3)下列有关图中各点微粒浓度关系正确的是
a.在A处溶液中:c(F—)+c(HF)=0.2 mol•L-1
b.在B处溶液中:c(H+)+c(HF)= c(OH—)
c.在B处溶液中:c(Na+)>c(F—)>c(H+)>c(OH—)
d.在A和B处溶液中都符合:
 = Ka(HF)
= Ka(HF)(4)向此氢氟酸溶液中滴加10mlNaOH溶液后,请将HF分子与溶液中的离子浓度一起从大到小排序
更新时间:2017-12-12 14:10:54
|
相似题推荐
填空题
|
适中
(0.65)
【推荐1】下表是几种常见弱酸的电离常数(25 ℃)。
回答下列问题:
(1)当温度升高时,K值________ (填“增大”“减小”或“不变”)。
(2)在相同温度时,各弱酸K值不同,那么K值的大小与酸性的相对强弱有何关系?________________ 。
(3)若把CH3COOH、H2CO3、HCO3-、H2S、HS-、H3PO4、H2PO4-、HPO42-都看作酸,其中酸性最强的是________ ,最弱的是________ 。
(4)多元弱酸是分步电离的,每一步都有相应的电离常数。对于同一种多元弱酸的K1、K2、K3之间存在着数量上的规律,此规律是_____________ ,产生此规律的原因是___________ 。
| 酸 | 电离常数K |
| CH3COOH | 1.75×10-5 |
| H2CO3 | K1=4.4×10-7 K2=4.7×10-11 |
| H2S | K1=1.3×10-7 K2=7.1×10-15 |
| H3PO4 | K1=7.1×10-3 K2=6.3×10-8 K3=4.2×10-13 |
回答下列问题:
(1)当温度升高时,K值
(2)在相同温度时,各弱酸K值不同,那么K值的大小与酸性的相对强弱有何关系?
(3)若把CH3COOH、H2CO3、HCO3-、H2S、HS-、H3PO4、H2PO4-、HPO42-都看作酸,其中酸性最强的是
(4)多元弱酸是分步电离的,每一步都有相应的电离常数。对于同一种多元弱酸的K1、K2、K3之间存在着数量上的规律,此规律是
您最近半年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐2】根据所学知识,回答问题。
(1)硫酸的水溶液呈酸性(用电离方程式解析):___________ 。
(2) 水溶液呈碱性(用电离方程式解析):
水溶液呈碱性(用电离方程式解析):___________ 。
(3) 溶液呈碱性的原因(用离子方程式解析):
溶液呈碱性的原因(用离子方程式解析):___________ 。
(4) 溶液呈酸性的原因(用离子方程式解析):
溶液呈酸性的原因(用离子方程式解析):___________ 。
(5)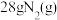 与适量的
与适量的 反应,生成
反应,生成 ,吸收
,吸收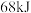 热量,写出其热化学方程式:
热量,写出其热化学方程式:___________ 。
(6)已知反应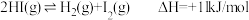 ,
,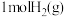 、
、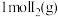 分子中化学键断裂时分别需要吸收
分子中化学键断裂时分别需要吸收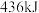 、
、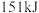 的能量,则
的能量,则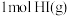 分子中化学键断裂时需吸收的能量为
分子中化学键断裂时需吸收的能量为___________ kJ。
(1)硫酸的水溶液呈酸性(用电离方程式解析):
(2)
 水溶液呈碱性(用电离方程式解析):
水溶液呈碱性(用电离方程式解析):(3)
 溶液呈碱性的原因(用离子方程式解析):
溶液呈碱性的原因(用离子方程式解析):(4)
 溶液呈酸性的原因(用离子方程式解析):
溶液呈酸性的原因(用离子方程式解析):(5)
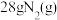 与适量的
与适量的 反应,生成
反应,生成 ,吸收
,吸收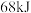 热量,写出其热化学方程式:
热量,写出其热化学方程式:(6)已知反应
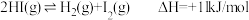 ,
,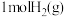 、
、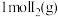 分子中化学键断裂时分别需要吸收
分子中化学键断裂时分别需要吸收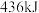 、
、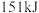 的能量,则
的能量,则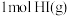 分子中化学键断裂时需吸收的能量为
分子中化学键断裂时需吸收的能量为
您最近半年使用:0次
填空题
|
适中
(0.65)
【推荐3】回答下列问题
(1)写出下列电解质在水溶液中的电离方程式:
NaHCO3_______ ;CH3COOH_______ 。
(2)下列物质中,属于电解质的是_______ ,属于非电解质的是_______ ,属于强电解质的是_______ ,属于弱电解质的是_______ 。
①氨气;②氨水;③盐酸;④氢氧化钾;⑤冰醋酸;⑥氯化钠;⑦醋酸铵;⑧二氧化碳;⑨氯化钠溶液。
(3)稀氨水中存在下述电离平衡:NH3+H2O NH3·H2O
NH3·H2O NH
NH +OH-。试分析向溶液中分别加入下列物质时,平衡如何移动:
+OH-。试分析向溶液中分别加入下列物质时,平衡如何移动:
(4)25℃时,三种酸的电离平衡常数如下:
回答下列问题:
①一般情况下,当温度升高时,
_______ (填“增大”、“减小”或“不变”)。
②下列四种离子结合质子能力由大到小的顺序是_______ (填序号)。
a.CO b.ClO- c.CH3COO- d.HCO
b.ClO- c.CH3COO- d.HCO
③下列反应不能发生的是_______ (填序号)。
a.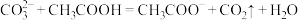
b.
c.
d.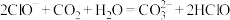
④用蒸馏水稀释 的醋酸,下列各式表示的数值随水量的增加而增大的是
的醋酸,下列各式表示的数值随水量的增加而增大的是_______ (填序号)。
a. b.
b.  c.
c. d.
d.
(1)写出下列电解质在水溶液中的电离方程式:
NaHCO3
(2)下列物质中,属于电解质的是
①氨气;②氨水;③盐酸;④氢氧化钾;⑤冰醋酸;⑥氯化钠;⑦醋酸铵;⑧二氧化碳;⑨氯化钠溶液。
(3)稀氨水中存在下述电离平衡:NH3+H2O
 NH3·H2O
NH3·H2O NH
NH +OH-。试分析向溶液中分别加入下列物质时,平衡如何移动:
+OH-。试分析向溶液中分别加入下列物质时,平衡如何移动:| 加入的物质 | 氯化铵固体 |
| 平衡移动方向 |
(4)25℃时,三种酸的电离平衡常数如下:
| 化学式 |  |  | HClO |
| 电离平衡常数 |  |  , , |  |
回答下列问题:
①一般情况下,当温度升高时,

②下列四种离子结合质子能力由大到小的顺序是
a.CO
 b.ClO- c.CH3COO- d.HCO
b.ClO- c.CH3COO- d.HCO
③下列反应不能发生的是
a.
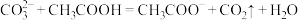
b.

c.

d.
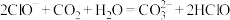
④用蒸馏水稀释
 的醋酸,下列各式表示的数值随水量的增加而增大的是
的醋酸,下列各式表示的数值随水量的增加而增大的是a.
 b.
b.  c.
c. d.
d.
您最近半年使用:0次
填空题
|
适中
(0.65)
名校
【推荐1】在25℃时对氨水进行如下操作。回答下列问题:
(1)向0.1mol/L 20mL氨水中逐滴加入0.1mol/L VmL盐酸。
①若使氨水恰好被中和,则所得溶液的pH_______ 7(填“>”、“<”或“=”),用离子方程式表示其原因:_______ 。
②若所得溶液pH=7,则此时加入盐酸的体积V_______ 20mL(填“>”、“<”或“=”),溶液中 、
、 、
、 、
、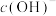 的大小关系为
的大小关系为_______ 。
③若加入盐酸的体积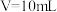 ,则此时溶液中
,则此时溶液中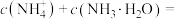
_______ mol/L。
(2)铜元素的价电子轨道表示式为_______ ,向 溶液中滴加氨水产生蓝色沉淀,若所得溶液
溶液中滴加氨水产生蓝色沉淀,若所得溶液 ,已知
,已知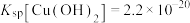 ,则溶液中
,则溶液中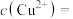
_______ mol/L。
(1)向0.1mol/L 20mL氨水中逐滴加入0.1mol/L VmL盐酸。
①若使氨水恰好被中和,则所得溶液的pH
②若所得溶液pH=7,则此时加入盐酸的体积V
 、
、 、
、 、
、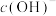 的大小关系为
的大小关系为③若加入盐酸的体积
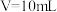 ,则此时溶液中
,则此时溶液中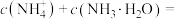
(2)铜元素的价电子轨道表示式为
 溶液中滴加氨水产生蓝色沉淀,若所得溶液
溶液中滴加氨水产生蓝色沉淀,若所得溶液 ,已知
,已知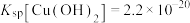 ,则溶液中
,则溶液中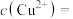
您最近半年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐2】在菠菜等植物中含有丰富的草酸,草酸对生命活动有重要影响。草酸的学名叫乙二酸,是一种二元弱酸(结构简式为HOOC-COOH,可简写为H2C2O4),它是一种重要的化工原料。常温下0.01mL的H2C2O4、KHC2O4、K2C2O4溶液的pH如表所示:
(1)草酸(H2C2O4)是一种二元弱酸。写出它在水中的电离方程式:_____ 。
(2)将0.1mol/L草酸溶液中[H2C2O4]、[HC2O ]、[C2O
]、[C2O ]按照由大到小的顺序排列:
]按照由大到小的顺序排列:_____ 。
(3)在H2C2O4溶液稀释过程中,下列物理量始终增大的是_____ 。
(4)KHC2O4溶液中c(H2C2O4)_____ c(C2O )(填>、<、=,下同),若0.1mol/LH2C2O4溶液中第二步电离产生的c(H+)=amol/L,则同浓度的KHC2O4溶液中HC2O
)(填>、<、=,下同),若0.1mol/LH2C2O4溶液中第二步电离产生的c(H+)=amol/L,则同浓度的KHC2O4溶液中HC2O 电离出来的c(H+)
电离出来的c(H+)_____ amol/L
(5)写出草酸钾(K2C2O4)溶液中的电荷守恒关系式_____ ,及物料守恒关系式_____ 。
| 物质 | H2C2O4 | KHC2O4 | K2C2O4 |
| pH | 2.1 | 3.1 | 8.1 |
(2)将0.1mol/L草酸溶液中[H2C2O4]、[HC2O
 ]、[C2O
]、[C2O ]按照由大到小的顺序排列:
]按照由大到小的顺序排列:(3)在H2C2O4溶液稀释过程中,下列物理量始终增大的是
A. | B.c(H+)•c(C2O ) ) |
C.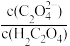 | D.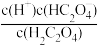 |
 )(填>、<、=,下同),若0.1mol/LH2C2O4溶液中第二步电离产生的c(H+)=amol/L,则同浓度的KHC2O4溶液中HC2O
)(填>、<、=,下同),若0.1mol/LH2C2O4溶液中第二步电离产生的c(H+)=amol/L,则同浓度的KHC2O4溶液中HC2O 电离出来的c(H+)
电离出来的c(H+)(5)写出草酸钾(K2C2O4)溶液中的电荷守恒关系式
您最近半年使用:0次
填空题
|
适中
(0.65)
名校
【推荐1】(1)在空气中直接加热CuCl2·2H2O晶体得不到纯的无水CuCl2,原因是___________ (用化学方程式表示)。由CuCl2·2H2O晶体得到纯的无水CuCl2的合理方法是_______________ 。
(2)在25 ℃时,下图为向25mL 0.1 mol·L-1 NaOH溶液中逐滴加0.2 mol·L-1 CH3COOH溶液过程中溶液pH的变化曲线。请回答:
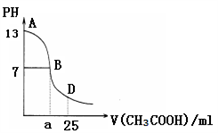
①当25mL 0.1 mol·L-1 NaOH溶液和0.2 mol·L-1 CH3COOH溶液恰好完全反应时所得溶液显_______ (选填“酸性”“碱性”或“中性”),其原因为__________________________ (用离子方程式表示)。
②B点时溶液中c(Na+)、c(CH3COO-)、c(H+)、c(OH-)的大小关系为__________ 。
③AB区间,c(OH-)>c(H+),则c(OH-)与c(CH3COO-)大小关系是______ 。
A.c(OH-)一定大于c(CH3COO-)
B.c(OH-)一定小于c(CH3COO-)
C.c(OH-)一定等于c(CH3COO-)
D.c(OH-)大于、小于或等于c(CH3COO-)
④在D点时,溶液中c(CH3COO-)+c(CH3COOH)_____ 2c(Na+)(选填“>”、“<”或“=”)。
(2)在25 ℃时,下图为向25mL 0.1 mol·L-1 NaOH溶液中逐滴加0.2 mol·L-1 CH3COOH溶液过程中溶液pH的变化曲线。请回答:

①当25mL 0.1 mol·L-1 NaOH溶液和0.2 mol·L-1 CH3COOH溶液恰好完全反应时所得溶液显
②B点时溶液中c(Na+)、c(CH3COO-)、c(H+)、c(OH-)的大小关系为
③AB区间,c(OH-)>c(H+),则c(OH-)与c(CH3COO-)大小关系是
A.c(OH-)一定大于c(CH3COO-)
B.c(OH-)一定小于c(CH3COO-)
C.c(OH-)一定等于c(CH3COO-)
D.c(OH-)大于、小于或等于c(CH3COO-)
④在D点时,溶液中c(CH3COO-)+c(CH3COOH)
您最近半年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】在含有弱电解质的溶液中,往往有多个化学平衡共存。
(1)一定温度下,向1 L 0.1 mol·L-1CH3COOH溶液中加入0.1 mol CH3COONa固体,则溶液中
________ (填“增大”“不变”或“减小”),写出表示该混合溶液中所有离子浓度之间的一个等式_________________________________ ;
(2)常温下向20 mL 0.1 mol·L-1Na2CO3溶液中逐滴加入0.1 mol·L-1HCl溶液40 mL,溶液中含碳元素的各种微粒(CO2因逸出未画出)物质的量分数(纵轴)随溶液pH变化的部分情况如图所示。
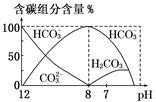
回答下列问题:
①在同一溶液中,H2CO3、HCO3-、CO32-________ (填“能”或“不能”)大量共存;
②当pH=7时,溶液中含碳元素的主要微粒为____________ ,溶液中各种离子(CO32-除外)的物质的量浓度的大小关系为________________ ;
③已知在25℃时,CO32-水解反应的平衡常数即水解常数Kh=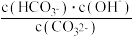 =2×10-4mol·L-1,当溶液中c(HCO3-)∶c(CO32-)=2∶1时,溶液的pH=
=2×10-4mol·L-1,当溶液中c(HCO3-)∶c(CO32-)=2∶1时,溶液的pH=________ 。
(1)一定温度下,向1 L 0.1 mol·L-1CH3COOH溶液中加入0.1 mol CH3COONa固体,则溶液中

(2)常温下向20 mL 0.1 mol·L-1Na2CO3溶液中逐滴加入0.1 mol·L-1HCl溶液40 mL,溶液中含碳元素的各种微粒(CO2因逸出未画出)物质的量分数(纵轴)随溶液pH变化的部分情况如图所示。

回答下列问题:
①在同一溶液中,H2CO3、HCO3-、CO32-
②当pH=7时,溶液中含碳元素的主要微粒为
③已知在25℃时,CO32-水解反应的平衡常数即水解常数Kh=
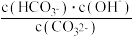 =2×10-4mol·L-1,当溶液中c(HCO3-)∶c(CO32-)=2∶1时,溶液的pH=
=2×10-4mol·L-1,当溶液中c(HCO3-)∶c(CO32-)=2∶1时,溶液的pH=
您最近半年使用:0次
填空题
|
适中
(0.65)
名校
【推荐3】请回答下列问题:
(1)pH=12相等体积相等的NaOH和NH3·H2O分别加水稀释m倍、n倍,稀释后两种溶液的pH都变成9,则m___________ n (填“>”、“<”或“=”)。
(2)常温下,pH=11的CH3COONa溶液中,水电离出来的c(OH-)=___________ ;在pH=3的CH3COOH溶液中,水电离出来的c(H+)=___________ 。
(3)物质的量浓度相同的①NH4Cl,②CH3COONH4,③NH4HSO4,④NH3·H2O四种稀溶液中,NH4+浓度由大到小的顺序是(填序号)___________ 。
(4)已知t℃时,Kw=1×10-12,在该温度时将pH=9的NaOH溶液a L与pH=2的H2SO4溶液bL混和(忽略混合后溶液体积的变化),若所得混合溶液的pH=3,则出a∶b=___________ 。
(1)pH=12相等体积相等的NaOH和NH3·H2O分别加水稀释m倍、n倍,稀释后两种溶液的pH都变成9,则m
(2)常温下,pH=11的CH3COONa溶液中,水电离出来的c(OH-)=
(3)物质的量浓度相同的①NH4Cl,②CH3COONH4,③NH4HSO4,④NH3·H2O四种稀溶液中,NH4+浓度由大到小的顺序是(填序号)
(4)已知t℃时,Kw=1×10-12,在该温度时将pH=9的NaOH溶液a L与pH=2的H2SO4溶液bL混和(忽略混合后溶液体积的变化),若所得混合溶液的pH=3,则出a∶b=
您最近半年使用:0次
填空题
|
适中
(0.65)
名校
【推荐1】现有常温下的4种溶液:①0.01mol/LCH3COOH溶液,②0.01mol/LHCl溶液,③pH=12的氨水,④pH=12的NaOH溶液。回答下列问题:
(1)4种溶液中水的电离程度最大的是________ (填序号)。
(2)将4种溶液同等程度稀释10倍后,溶液pH由大到小的顺序是________ 。
(3)若将①④混合后所得溶液中的c(CH3COO-)>c(H+),则下列说法正确的是________ 。
(4)若将②③混合后所得溶液的pH=7,则消耗溶液的体积:②________ ③(填">"“<"或"=")。
(5)若将②④混合后所得溶液的pH=10,则消耗②和④溶液的体积比: =
=_______ 。
(6)室温下pH=9的NaOH溶液和pH=9的CH3COONa溶液,设由水电离产生的OH-的物质的量浓度分别为c(A)和c(B),则c(A):c(B)=_________ 。
(7)若氨水与SO2恰好生成正盐,则此时溶液呈________ (填"酸性"或“碱性"),向上述溶液中通入________ (填"NH3"或"SO2")可使溶液呈中性,此时溶液中
________ 2(填“>”“<”或“=“)。
(已知常温下NH3·H2O的Kb=1.8×10-5mol/L,H2SO3的Ka1=1.5×10-2mol/L,Ka2=6.3×10-8mol/L)
(1)4种溶液中水的电离程度最大的是
(2)将4种溶液同等程度稀释10倍后,溶液pH由大到小的顺序是
(3)若将①④混合后所得溶液中的c(CH3COO-)>c(H+),则下列说法正确的是
| A.溶液一定呈酸性 | B.溶液一定呈碱性。 |
| C.溶液一定呈中性 | D.溶液可能呈酸性、中性或碱性 |
(5)若将②④混合后所得溶液的pH=10,则消耗②和④溶液的体积比:
 =
=(6)室温下pH=9的NaOH溶液和pH=9的CH3COONa溶液,设由水电离产生的OH-的物质的量浓度分别为c(A)和c(B),则c(A):c(B)=
(7)若氨水与SO2恰好生成正盐,则此时溶液呈

(已知常温下NH3·H2O的Kb=1.8×10-5mol/L,H2SO3的Ka1=1.5×10-2mol/L,Ka2=6.3×10-8mol/L)
您最近半年使用:0次
填空题
|
适中
(0.65)
【推荐2】25℃时,草酸( )的
)的 ,
,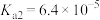 ;
; 的
的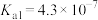 ,
, 。回答下列问题:
。回答下列问题:
(1)写出 的第二步电离方程式
的第二步电离方程式___________ 。
(2)相同浓度的 、
、 、
、 、
、 四种溶液中碱性最弱的物质是
四种溶液中碱性最弱的物质是________ 溶液。用 的NaOH溶液滴定
的NaOH溶液滴定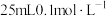 草酸溶液的滴定曲线如图所示。
草酸溶液的滴定曲线如图所示。
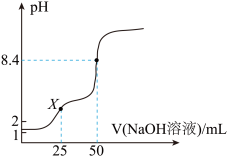
①X点溶液显___________ (填“酸性”“中性”或“碱性”),若向该溶液中滴加少量 ,反应的离子方程式为
,反应的离子方程式为___________ , 值
值___________ (填“增大”或“减小”)。
②滴定过程中所得混合溶液中 时,
时,
___________ 。
(3)反应 的平衡常数K的数量级为
的平衡常数K的数量级为___________ 。
 )的
)的 ,
,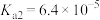 ;
; 的
的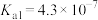 ,
, 。回答下列问题:
。回答下列问题:(1)写出
 的第二步电离方程式
的第二步电离方程式(2)相同浓度的
 、
、 、
、 、
、 四种溶液中碱性最弱的物质是
四种溶液中碱性最弱的物质是 的NaOH溶液滴定
的NaOH溶液滴定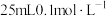 草酸溶液的滴定曲线如图所示。
草酸溶液的滴定曲线如图所示。
①X点溶液显
 ,反应的离子方程式为
,反应的离子方程式为 值
值②滴定过程中所得混合溶液中
 时,
时,
(3)反应
 的平衡常数K的数量级为
的平衡常数K的数量级为
您最近半年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐3】常温下,有浓度均为0.1mol∙L﹣1的下列4种溶液:①NaCN溶液②NaOH溶液③CH3COONa溶液④NaHCO3溶液
(1)这4种溶液pH由大到小的顺序是_______ (填序号)。
(2)①中各离子浓度由大到小的顺序是_______ 。
(3)④的水解平衡常数Kh=_______ mol/L。
(4)若向等体积的③和④中滴加盐酸至呈中性,则消耗盐酸的体积③_______ ④(填“>”、“<”、“=”)。
(5)25℃时,测得HCN和NaCN的混合溶液的pH=11,则 约为
约为_______ 。向NaCN溶液中通入少量CO2,则发生反应的离子方程式为:_______ 。
| HCN | H2CO3 | CH3COOH |
| Ka=4.9×10﹣10 | Ka1=4×10﹣7 Ka2=5.6×10﹣11 | Ka=1.7×10﹣5 |
(1)这4种溶液pH由大到小的顺序是
(2)①中各离子浓度由大到小的顺序是
(3)④的水解平衡常数Kh=
(4)若向等体积的③和④中滴加盐酸至呈中性,则消耗盐酸的体积③
(5)25℃时,测得HCN和NaCN的混合溶液的pH=11,则
 约为
约为
您最近半年使用:0次



