(1)在空气中直接加热CuCl2·2H2O晶体得不到纯的无水CuCl2,原因是___________ (用化学方程式表示)。由CuCl2·2H2O晶体得到纯的无水CuCl2的合理方法是_______________ 。
(2)在25 ℃时,下图为向25mL 0.1 mol·L-1 NaOH溶液中逐滴加0.2 mol·L-1 CH3COOH溶液过程中溶液pH的变化曲线。请回答:
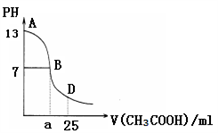
①当25mL 0.1 mol·L-1 NaOH溶液和0.2 mol·L-1 CH3COOH溶液恰好完全反应时所得溶液显_______ (选填“酸性”“碱性”或“中性”),其原因为__________________________ (用离子方程式表示)。
②B点时溶液中c(Na+)、c(CH3COO-)、c(H+)、c(OH-)的大小关系为__________ 。
③AB区间,c(OH-)>c(H+),则c(OH-)与c(CH3COO-)大小关系是______ 。
A.c(OH-)一定大于c(CH3COO-)
B.c(OH-)一定小于c(CH3COO-)
C.c(OH-)一定等于c(CH3COO-)
D.c(OH-)大于、小于或等于c(CH3COO-)
④在D点时,溶液中c(CH3COO-)+c(CH3COOH)_____ 2c(Na+)(选填“>”、“<”或“=”)。
(2)在25 ℃时,下图为向25mL 0.1 mol·L-1 NaOH溶液中逐滴加0.2 mol·L-1 CH3COOH溶液过程中溶液pH的变化曲线。请回答:

①当25mL 0.1 mol·L-1 NaOH溶液和0.2 mol·L-1 CH3COOH溶液恰好完全反应时所得溶液显
②B点时溶液中c(Na+)、c(CH3COO-)、c(H+)、c(OH-)的大小关系为
③AB区间,c(OH-)>c(H+),则c(OH-)与c(CH3COO-)大小关系是
A.c(OH-)一定大于c(CH3COO-)
B.c(OH-)一定小于c(CH3COO-)
C.c(OH-)一定等于c(CH3COO-)
D.c(OH-)大于、小于或等于c(CH3COO-)
④在D点时,溶液中c(CH3COO-)+c(CH3COOH)
更新时间:2017-12-12 18:52:54
|
相似题推荐
填空题
|
适中
(0.65)
解题方法
【推荐1】表中所列盐溶液的浓度均为0.10mol·L,用pH试纸测定它们的pH。
(1)小组交流完成表格有关内容。
【思考】
(2)从这个实验中你能得出什么结论_______ ?
(1)小组交流完成表格有关内容。
| 盐 | CH3COONa | Na2CO3 | NaCl | NH4Cl | Al2(SO4)3 | KNO3 |
| 溶液的pH | ||||||
| 溶液中存在的微粒 | ||||||
| 哪些微粒可以发生相互作用 | ||||||
| 溶液呈中性、酸性或碱性的原因 | ||||||
【思考】
(2)从这个实验中你能得出什么结论
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐2】铁、铜及其化合物在日常生活生产中的用途相当广泛。
Ⅰ. 具有净水作用,但腐蚀设备,而聚合氯化铁是一种新型的絮凝剂,处理污水比
具有净水作用,但腐蚀设备,而聚合氯化铁是一种新型的絮凝剂,处理污水比 高效,且腐蚀性小。请回答下列问题:
高效,且腐蚀性小。请回答下列问题:
(1) 净水的原理是
净水的原理是_______ 。 溶液腐蚀钢铁设备,除
溶液腐蚀钢铁设备,除 作用外,另一主要原因是
作用外,另一主要原因是_______ 。(用离子方程式表示)
(2)为节约成本,工业上用 氧化酸性
氧化酸性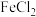 废液得到
废液得到 。若酸性
。若酸性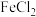 废液中
废液中 ,
, ,
, ,则该溶液的pH约为
,则该溶液的pH约为_______ 。
Ⅱ.铜的化学性质通常比较稳定,不溶于稀硫酸,但在一定条件下能和很多物质反应。
(3)将少量铜丝放入适量的稀硫酸中,温度控制在50~60℃,加入 ,反应一段时间后可制得硫酸铜,发生反应的离子方程式为
,反应一段时间后可制得硫酸铜,发生反应的离子方程式为_______ 。
(4)某小组同学在做铜与浓硫酸反应的实验时,发现铜片表面有黑色固体生成。
①甲同学猜想:黑色固体是未来得及溶解于酸的CuO,其猜想可用化学方程式表示为_______ 。
②乙同学认为:黑色固体除CuO外,还可能含有 和CuS,其理由可能是
和CuS,其理由可能是_______ (填字母)。
a. 和CuS都是黑色的
和CuS都是黑色的
b.铜与浓硫酸在加热条件下反应,还可能放出
c.浓硫酸是氧化剂,铜是还原剂,Cu的化合价升高与S的化合价降低有多种可能
Ⅰ.
 具有净水作用,但腐蚀设备,而聚合氯化铁是一种新型的絮凝剂,处理污水比
具有净水作用,但腐蚀设备,而聚合氯化铁是一种新型的絮凝剂,处理污水比 高效,且腐蚀性小。请回答下列问题:
高效,且腐蚀性小。请回答下列问题:(1)
 净水的原理是
净水的原理是 溶液腐蚀钢铁设备,除
溶液腐蚀钢铁设备,除 作用外,另一主要原因是
作用外,另一主要原因是(2)为节约成本,工业上用
 氧化酸性
氧化酸性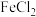 废液得到
废液得到 。若酸性
。若酸性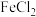 废液中
废液中 ,
, ,
, ,则该溶液的pH约为
,则该溶液的pH约为Ⅱ.铜的化学性质通常比较稳定,不溶于稀硫酸,但在一定条件下能和很多物质反应。
(3)将少量铜丝放入适量的稀硫酸中,温度控制在50~60℃,加入
 ,反应一段时间后可制得硫酸铜,发生反应的离子方程式为
,反应一段时间后可制得硫酸铜,发生反应的离子方程式为(4)某小组同学在做铜与浓硫酸反应的实验时,发现铜片表面有黑色固体生成。
①甲同学猜想:黑色固体是未来得及溶解于酸的CuO,其猜想可用化学方程式表示为
②乙同学认为:黑色固体除CuO外,还可能含有
 和CuS,其理由可能是
和CuS,其理由可能是a.
 和CuS都是黑色的
和CuS都是黑色的b.铜与浓硫酸在加热条件下反应,还可能放出

c.浓硫酸是氧化剂,铜是还原剂,Cu的化合价升高与S的化合价降低有多种可能
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐3】(1)在一定条件下,可逆反应:aA(g)+bB(g) cC(g)+dD(g)达到平衡。
cC(g)+dD(g)达到平衡。
若其它条件不变,升高温度,则正反应速率________ (填“加快”或“减慢”,下同),逆反应速率________ ,重新达到平衡后c的质量增加,则正反应为_________ (填“放热”或“吸热”)反应。
(2)把AlCl3溶液蒸干,灼烧,最后得到的主要固体产物是_______ (填化学式)。
(3)pH = 3的醋酸和pH = 11的氢氧化钠溶液等体积混合后溶液呈________ (填“酸”、“中”、“碱”)性,溶液中c(Na+) ______ c(CH3COO-) (填“>”、“=”、“<”)。
 cC(g)+dD(g)达到平衡。
cC(g)+dD(g)达到平衡。若其它条件不变,升高温度,则正反应速率
(2)把AlCl3溶液蒸干,灼烧,最后得到的主要固体产物是
(3)pH = 3的醋酸和pH = 11的氢氧化钠溶液等体积混合后溶液呈
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐1】 和
和 都是重要的化工产品,均可应用于造纸业。
都是重要的化工产品,均可应用于造纸业。
(1) 溶液的
溶液的 ,用离子方程式表示原因
,用离子方程式表示原因___________ 。
(2)某小组同学用如图所示装置探究饱和 和
和 溶液混合反应的实验。打开分液漏斗活塞向烧瓶中加入饱和
溶液混合反应的实验。打开分液漏斗活塞向烧瓶中加入饱和 溶液,产生大量的白色胶状沉淀。反应的离子方程式是
溶液,产生大量的白色胶状沉淀。反应的离子方程式是___________ 。

(3)已知在常温下测得浓度均为 的下列5种溶液的
的下列5种溶液的 :
:
判断下列反应不能成立的是___________ (填编号)。
A.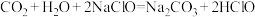
B.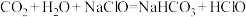
C.
D.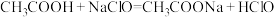
(4)亚磷酸( )是中强酸,它与足量的
)是中强酸,它与足量的 溶液反应生成
溶液反应生成 。试回答下列问题:
。试回答下列问题:
① 中
中 元素在周期表中的位置为
元素在周期表中的位置为___________ 。
② 是
是___________ (填“正盐”或者“酸式盐”)。
 和
和 都是重要的化工产品,均可应用于造纸业。
都是重要的化工产品,均可应用于造纸业。(1)
 溶液的
溶液的 ,用离子方程式表示原因
,用离子方程式表示原因(2)某小组同学用如图所示装置探究饱和
 和
和 溶液混合反应的实验。打开分液漏斗活塞向烧瓶中加入饱和
溶液混合反应的实验。打开分液漏斗活塞向烧瓶中加入饱和 溶液,产生大量的白色胶状沉淀。反应的离子方程式是
溶液,产生大量的白色胶状沉淀。反应的离子方程式是
(3)已知在常温下测得浓度均为
 的下列5种溶液的
的下列5种溶液的 :
:| 溶质 |  |  |  |  |  |
 | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
判断下列反应不能成立的是
A.
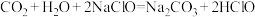
B.
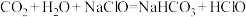
C.

D.
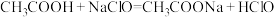
(4)亚磷酸(
 )是中强酸,它与足量的
)是中强酸,它与足量的 溶液反应生成
溶液反应生成 。试回答下列问题:
。试回答下列问题:①
 中
中 元素在周期表中的位置为
元素在周期表中的位置为②
 是
是
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】磷酸(H3PO4)在溶液中能够以H3PO4、H2PO4-、HPO42-、和PO43-四种粒子形式存在,当溶液的pH发生变化时,其中任一种粒子的物质的量占四种粒子总物质的量的分数δ也可能发生变化。下图是H3PO4溶液中,各种粒子的物质的量分数δ随pH的变化曲线:

(1)向Na3PO4溶液中逐滴滴入稀盐酸,当pH从9降到6的过程中发生的主要反应的离子方程式为________ 。当pH=7时,溶液中主要存在的阴离子(OH-离子除外)是__________ 。
(2)从图中推断NaH2PO4溶液呈______ 性(填“酸”“碱”或“中”),其原因是_________ 。
(3)在Na3PO4溶液中,c(Na+)/c(PO43-)______ 3(填“>”“=”或“<”);向该溶液中滴入几滴浓KOH溶液后,c(Na+)/c(PO43-)的值减小,原因是____ 。

(1)向Na3PO4溶液中逐滴滴入稀盐酸,当pH从9降到6的过程中发生的主要反应的离子方程式为
(2)从图中推断NaH2PO4溶液呈
(3)在Na3PO4溶液中,c(Na+)/c(PO43-)
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐3】已知在25℃时,醋酸、氢氰酸和氢硫酸的电离平衡常数如表:
请回答下列问题:
(1)写出H2S的第二步电离平衡常数表达式Ka2=___ 。
(2)相同条件下,CH3COO-、CN-、HS-中结合H+能力最强的是__ 。
(3)如图表示25℃时稀释CH3COOH、HCN的稀溶液,溶液pH随溶液体积的变化图象:

①曲线Ⅰ表示的酸是__ (填化学式)。
②A、B、C三点中,溶液的导电能力最强的是__ (填字母)。
(4)25℃时,pH相同的CH3COONa溶液和NaCN溶液,其物质的量浓度的关系是:c(CH3COONa)__ c(NaCN)(填“>”“<”或“=”)。
(5)25℃时,下列关于NaHS和Na2S的说法正确的是__ (填序号)。
A.NaHS溶液呈碱性
B.NaHS溶液中存在:c(HS-)+c(OH-)=c((Na+)+c(H+)
C.Na2S溶液中加入少量NaOH固体,Na2S的水解程度增大
D.Na2S溶液与AlCl3溶液混合,有气体和沉淀生成
(6)在工业废水处理中可以用Na2S作沉淀剂,将Cu2+转化为CuS除去。常温下,Ksp(CuS)=6.3×10-36,向c(Cu2+)=0.030mol/L的废水中加入Na2S固体(溶液体积无变化),当Cu2+刚开始沉淀时,废水中的c(S2-)=__ mol/L。
| CH3COOH | HCN | H2S |
| Ka=1.75×10-5 | Ka=6.2×10-10 | Ka1=1.1×10-7 Ka2=1.3×10-13 |
请回答下列问题:
(1)写出H2S的第二步电离平衡常数表达式Ka2=
(2)相同条件下,CH3COO-、CN-、HS-中结合H+能力最强的是
(3)如图表示25℃时稀释CH3COOH、HCN的稀溶液,溶液pH随溶液体积的变化图象:

①曲线Ⅰ表示的酸是
②A、B、C三点中,溶液的导电能力最强的是
(4)25℃时,pH相同的CH3COONa溶液和NaCN溶液,其物质的量浓度的关系是:c(CH3COONa)
(5)25℃时,下列关于NaHS和Na2S的说法正确的是
A.NaHS溶液呈碱性
B.NaHS溶液中存在:c(HS-)+c(OH-)=c((Na+)+c(H+)
C.Na2S溶液中加入少量NaOH固体,Na2S的水解程度增大
D.Na2S溶液与AlCl3溶液混合,有气体和沉淀生成
(6)在工业废水处理中可以用Na2S作沉淀剂,将Cu2+转化为CuS除去。常温下,Ksp(CuS)=6.3×10-36,向c(Cu2+)=0.030mol/L的废水中加入Na2S固体(溶液体积无变化),当Cu2+刚开始沉淀时,废水中的c(S2-)=
您最近一年使用:0次



