常温下,向一定量的 (
( 为三元弱酸)溶液中逐滴加入NaOH溶液,含砷元素的各种微粒物质的量分数与溶液pH的关系如图所示。
为三元弱酸)溶液中逐滴加入NaOH溶液,含砷元素的各种微粒物质的量分数与溶液pH的关系如图所示。
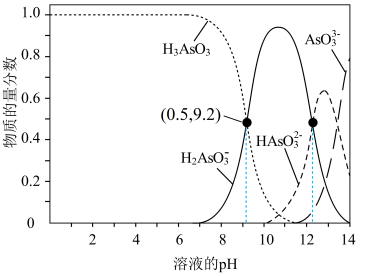
(1)人体血液的pH在7.35~7.45之间。服用含 的药物后,由上图可知,人体中含砷元素的微粒主要是
的药物后,由上图可知,人体中含砷元素的微粒主要是_______ (写化学式)。
(2) 第一步电离的电离方程式为
第一步电离的电离方程式为_______ ,结合图示,计算电离平衡常数
_______ 。
(3)请写出 溶液中各种离子浓度之间电荷守恒的关系式
溶液中各种离子浓度之间电荷守恒的关系式_______ 。
(4)0.10mol/L的 溶液中,
溶液中,
_______ mol/L。
(5)写出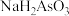 溶液中发生水解的离子方程式
溶液中发生水解的离子方程式_______ 。
(6)向含 的废水中加入适量氧化剂,再加入生石灰将砷元素转化为
的废水中加入适量氧化剂,再加入生石灰将砷元素转化为 沉淀。若要除去
沉淀。若要除去 ,则溶液中的
,则溶液中的 至少为
至少为_______ mol/L。(已知:①当溶液中离子浓度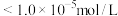 时,则该离子被除尽;②
时,则该离子被除尽;②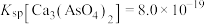 )
)
 (
( 为三元弱酸)溶液中逐滴加入NaOH溶液,含砷元素的各种微粒物质的量分数与溶液pH的关系如图所示。
为三元弱酸)溶液中逐滴加入NaOH溶液,含砷元素的各种微粒物质的量分数与溶液pH的关系如图所示。
(1)人体血液的pH在7.35~7.45之间。服用含
 的药物后,由上图可知,人体中含砷元素的微粒主要是
的药物后,由上图可知,人体中含砷元素的微粒主要是(2)
 第一步电离的电离方程式为
第一步电离的电离方程式为
(3)请写出
 溶液中各种离子浓度之间电荷守恒的关系式
溶液中各种离子浓度之间电荷守恒的关系式(4)0.10mol/L的
 溶液中,
溶液中,
(5)写出
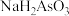 溶液中发生水解的离子方程式
溶液中发生水解的离子方程式(6)向含
 的废水中加入适量氧化剂,再加入生石灰将砷元素转化为
的废水中加入适量氧化剂,再加入生石灰将砷元素转化为 沉淀。若要除去
沉淀。若要除去 ,则溶液中的
,则溶液中的 至少为
至少为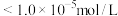 时,则该离子被除尽;②
时,则该离子被除尽;②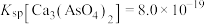 )
)
更新时间:2023-02-24 19:51:18
|
相似题推荐
填空题
|
适中
(0.65)
名校
解题方法
【推荐1】Ⅰ.甲酸(HCOOH)是一种弱酸,在水溶液中电离成氢离子和甲酸根离子( )。
)。
(1)请写出甲酸的电离方程式_______ 。
(2)某甲酸溶液中,HCOOH的初始浓度是 ,当其电离达到平衡时,溶液中的
,当其电离达到平衡时,溶液中的 浓度c的取值范围是_______。
浓度c的取值范围是_______。
Ⅱ.完成下列问题
(3)某种酱油的pH为5,则该酱油中的c(H+)=_______ 。
(4)在常温下,柠檬水的pH为3,其中的c(OH-)为_______ (填字母)。
a.0.1 mol∙L−1 b.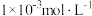 c.
c.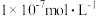 d.
d.
Ⅲ.在25℃时对氨水进行如下操作。请填写下列空白。
(5)若向氨水中加入少量硫酸铵固体,则溶液中 将
将_______ (填“增大”“减小”或“不变”)。
(6)若向氨水中加入稀硫酸,使氨水恰好被中和,写出反应的离子方程式:_______ ;所得溶液的pH_______ 7(填“>”“<”或“=”),用离子方程式表示其原因:_______ 。
(7)若向氨水中加入稀硫酸至溶液的pH=7,此时溶液中 ,则
,则
_______ 。
(8)用硫酸标准溶液滴定氨水,达滴定终点的标志是_______ 。
 )。
)。(1)请写出甲酸的电离方程式
(2)某甲酸溶液中,HCOOH的初始浓度是
 ,当其电离达到平衡时,溶液中的
,当其电离达到平衡时,溶液中的 浓度c的取值范围是_______。
浓度c的取值范围是_______。A. | B. |
C.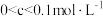 | D. 0 0 |
Ⅱ.完成下列问题
(3)某种酱油的pH为5,则该酱油中的c(H+)=
(4)在常温下,柠檬水的pH为3,其中的c(OH-)为
a.0.1 mol∙L−1 b.
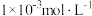 c.
c.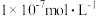 d.
d.
Ⅲ.在25℃时对氨水进行如下操作。请填写下列空白。
(5)若向氨水中加入少量硫酸铵固体,则溶液中
 将
将(6)若向氨水中加入稀硫酸,使氨水恰好被中和,写出反应的离子方程式:
(7)若向氨水中加入稀硫酸至溶液的pH=7,此时溶液中
 ,则
,则
(8)用硫酸标准溶液滴定氨水,达滴定终点的标志是
您最近半年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐2】现有常温下A、B、C、D四种溶液,它们分别是CH3COOH溶液、 HCl溶液、氨水、NaOH溶液中的一种,其相关数据如下:
(1)其中水的电离程度最大的是________ (填字母,下同)。
(2)将四份溶液同等稀释10倍后,溶液的pH最大的是________ 。
(3)某同学用B溶液分别滴定20.00 mL A溶液和20.00 mL C溶液,得到如图所示两条滴定曲线。
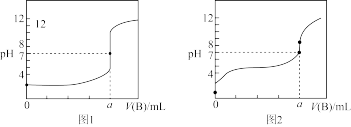
①a=________ mL,B溶液滴定C溶液的曲线是________ (填“图1”或“图2”)。
②图2中,当加入的B溶液为a mL时,溶液中离子浓度的大小关系为________ 。
| 溶液 | 物质的量浓度 | pH | 电离常数 |
| A | 0.01 mol·L-1 | 1.8×10-5 | |
| B | 12 | ||
| C | 0.01 mol·L-1 | ||
| D | 12 | 1.8×10-5 |
(2)将四份溶液同等稀释10倍后,溶液的pH最大的是
(3)某同学用B溶液分别滴定20.00 mL A溶液和20.00 mL C溶液,得到如图所示两条滴定曲线。

①a=
②图2中,当加入的B溶液为a mL时,溶液中离子浓度的大小关系为
您最近半年使用:0次
填空题
|
适中
(0.65)
名校
【推荐3】实验室用硫酸亚铁铵[(NH4)2Fe(SO4)2·6H2O]滴定法测定铬铁矿中铬含量的过程如下:
酸溶:准确称取0.1950 g铬铁矿试样放入锥形瓶中,加入适量磷酸和硫酸的混合酸,加热使试样完全溶解,冷却。
氧化:向上述溶液中滴加5滴1%的MnSO4溶液,再加入一定量的过硫酸铵[(NH4)2S2O8]溶液,摇匀,加热煮沸至出现紫红色,继续加热煮沸至紫红色褪去,冷却。[已知:①2Mn2+ + 5S2O82- + 8H2O = 10SO42- + 2MnO4- + 16H+;②继续加热煮沸后,溶液中过量(NH4)2S2O8和生成的HMnO4已分解除去]
滴定:用0.2050mol·L-1(NH4)2Fe(SO4)2标准溶液滴定上述溶液至终点,消耗19.50 mL标准溶液。(已知:Cr2O72-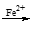 Cr3+)
Cr3+)
(1)过硫酸铵保存在棕色试剂瓶中的原因是___________ 。
(2)①“氧化”的目的是将试样溶液中的Cr3+氧化成Cr2O72-,加入5滴MnSO4溶液的目的是________________ (已知该条件下还原性:Cr3+ > Mn2+)。
②“氧化”过程中,如果继续加热煮沸时间不充足,会使铬含量的测定结果______ (填“偏大”“不变”或“偏小”)。
(3)计算铬铁矿中铬的质量分数(写出计算过程)。___________
酸溶:准确称取0.1950 g铬铁矿试样放入锥形瓶中,加入适量磷酸和硫酸的混合酸,加热使试样完全溶解,冷却。
氧化:向上述溶液中滴加5滴1%的MnSO4溶液,再加入一定量的过硫酸铵[(NH4)2S2O8]溶液,摇匀,加热煮沸至出现紫红色,继续加热煮沸至紫红色褪去,冷却。[已知:①2Mn2+ + 5S2O82- + 8H2O = 10SO42- + 2MnO4- + 16H+;②继续加热煮沸后,溶液中过量(NH4)2S2O8和生成的HMnO4已分解除去]
滴定:用0.2050mol·L-1(NH4)2Fe(SO4)2标准溶液滴定上述溶液至终点,消耗19.50 mL标准溶液。(已知:Cr2O72-
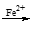 Cr3+)
Cr3+)(1)过硫酸铵保存在棕色试剂瓶中的原因是
(2)①“氧化”的目的是将试样溶液中的Cr3+氧化成Cr2O72-,加入5滴MnSO4溶液的目的是
②“氧化”过程中,如果继续加热煮沸时间不充足,会使铬含量的测定结果
(3)计算铬铁矿中铬的质量分数(写出计算过程)。
您最近半年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐1】Ⅰ在一定温度下,冰醋酸加水稀释过程中,溶液的导电能力I随加入水的体积V变化的曲线如图所示。请回答:
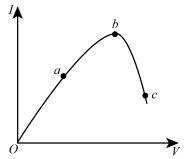
(1)“O”点导电能力为0,原因是_________________________________________________ 。
(2)a、b、c三点处,溶液的c(H+)由小到大的顺序为_____________________ 。
(3)a、b、c三点处,电离程度最大的是_______ 。
Ⅱ如图所示是在一定温度下向不同电解质溶液中加入新物质时其电流强度(I)随新物质加入量(m)的变化曲线。以下三个导电性实验,其中与A图变化趋势一致的是________ ,与B图变化趋势一致的是______ ,与C图变化趋势一致的是______ 。
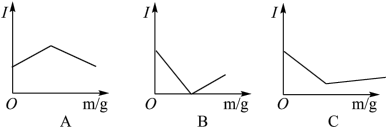
a.向Ba(OH)2溶液中逐滴加入等浓度的H2SO4至过量
b.向醋酸溶液中逐滴加入等浓度的氨水至过量
c.向盐酸溶液中逐滴加入等浓度的NaOH溶液至过量

(1)“O”点导电能力为0,原因是
(2)a、b、c三点处,溶液的c(H+)由小到大的顺序为
(3)a、b、c三点处,电离程度最大的是
Ⅱ如图所示是在一定温度下向不同电解质溶液中加入新物质时其电流强度(I)随新物质加入量(m)的变化曲线。以下三个导电性实验,其中与A图变化趋势一致的是

a.向Ba(OH)2溶液中逐滴加入等浓度的H2SO4至过量
b.向醋酸溶液中逐滴加入等浓度的氨水至过量
c.向盐酸溶液中逐滴加入等浓度的NaOH溶液至过量
您最近半年使用:0次
填空题
|
适中
(0.65)
【推荐2】已知室温时,0.1mol/L的某一元酸HA在水中有0.1%发生电离,回答下列各问题:
(1)该溶液的pH=___________ 。
(2)HA的电离平衡常数K=___________ 。
(3)升高温度时,K将___________ (填“增大”“减小”或“不变”),pH将___________ (填“增大”“减小”或“不变”)。
(1)该溶液的pH=
(2)HA的电离平衡常数K=
(3)升高温度时,K将
您最近半年使用:0次
填空题
|
适中
(0.65)
名校
【推荐3】25℃时,三种酸的电离平衡常数如表:
试回答下列问题:
(1)一般情况下,当温度升高时,
_______ (填“增大”、“减小”或“不变”)。
(2)下列四种离子结合质子能力由大到小的顺序是_______ (填序号);
a. b.
b. c.
c. d.
d.
(3)下列反应不能发生的是_______(填序号)
(4)体积均为10mL、pH均为2的醋酸溶液与 溶液分别加水稀释至
溶液分别加水稀释至 ,稀释过程中
,稀释过程中 变化如图所示。
变化如图所示。
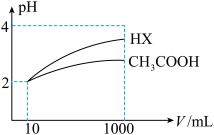
则 的电离平衡常数
的电离平衡常数_______ (填“>”、“=”或“<”,下同)醋酸的电离平衡常数;稀释后,HX溶液中水电离出来的
_______ 醋酸溶液中水电离出来的
(5)25℃时,若测得 与
与 的混合溶液的
的混合溶液的 ,则溶液中
,则溶液中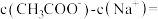
_______  (填精确数值)。
(填精确数值)。
| 化学式 |  |  |  |
| 电离平衡常数 |  | 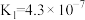 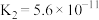 |  |
(1)一般情况下,当温度升高时,

(2)下列四种离子结合质子能力由大到小的顺序是
a.
 b.
b. c.
c. d.
d.
(3)下列反应不能发生的是_______(填序号)
A. |
B.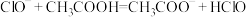 |
C. |
D.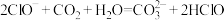 |
(4)体积均为10mL、pH均为2的醋酸溶液与
 溶液分别加水稀释至
溶液分别加水稀释至 ,稀释过程中
,稀释过程中 变化如图所示。
变化如图所示。
则
 的电离平衡常数
的电离平衡常数

(5)25℃时,若测得
 与
与 的混合溶液的
的混合溶液的 ,则溶液中
,则溶液中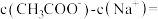
 (填精确数值)。
(填精确数值)。
您最近半年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐1】完成下列问题。
(1)已知常温下CN-的水解常数Kh=1.61×10-5,常温下,含等物质的量浓度的HCN与NaCN的混合溶液显___________ (填“酸”“碱”或“中”)性,c平(CN-)___________ (填“>”“<”或“=”)c平(HCN) 。
(2)取5 mL pH=5的NH4Cl溶液,加水稀释至50 mL,则c平(H+)________ (填“>”“<”或“=”)10-6 mol·L-1, 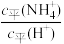
___________ (填“增大”“减小”或“不变”)。
(3)已知在室温条件下,pH均为5的H2SO4溶液和NH4Cl溶液,回答下列问题:各取5 mL上述溶液,分别加水稀释至50 mL,pH较大的是___________ 溶液。
(1)已知常温下CN-的水解常数Kh=1.61×10-5,常温下,含等物质的量浓度的HCN与NaCN的混合溶液显
(2)取5 mL pH=5的NH4Cl溶液,加水稀释至50 mL,则c平(H+)
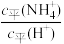
(3)已知在室温条件下,pH均为5的H2SO4溶液和NH4Cl溶液,回答下列问题:各取5 mL上述溶液,分别加水稀释至50 mL,pH较大的是
您最近半年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐2】乙二酸俗称草酸(结构简式为HOOC—COOH,可简写为H2C2O4),它是一种重要的化工原料。(常温下0.01 mol/L的H2C2O4、KHC2O4、K2C2O4溶液的pH如表所示。)填空:
(1)写出H2C2O4的电离方程式________________ 。
(2)KHC2O4溶液显酸性的原因是_________________ ;向0.1 mol/L的草酸氢钾溶液里滴加NaOH溶液至中性,此时溶液里各粒子浓度关系正确的是______ 。
a.c(K+)=c(HC2O4-)+c(H2C2O4)+c(C2O42-) b.c(Na+)=c(H2C2O4)+c(C2O42-)
c.c(K+)+c(Na+)=c(HC2O4-)+c(C2O42-) d.c(K+)>c(Na+)
(3)H2C2O4与酸性高锰酸钾溶液反应,现象是有气泡(CO2)产生,紫色消失。写出反应的离子方程式____________________ ;又知该反应开始时速率较慢,随后大大加快,可能的原因是______________________ 。
| H2C2O4 | KHC2O4 | K2C2O4 | |
| pH | 2.1 | 3.1 | 8.1 |
(1)写出H2C2O4的电离方程式
(2)KHC2O4溶液显酸性的原因是
a.c(K+)=c(HC2O4-)+c(H2C2O4)+c(C2O42-) b.c(Na+)=c(H2C2O4)+c(C2O42-)
c.c(K+)+c(Na+)=c(HC2O4-)+c(C2O42-) d.c(K+)>c(Na+)
(3)H2C2O4与酸性高锰酸钾溶液反应,现象是有气泡(CO2)产生,紫色消失。写出反应的离子方程式
您最近半年使用:0次
填空题
|
适中
(0.65)
【推荐1】亚硫酸盐与硫酸盐在工农业生产、生活中具有广泛应用。
(1) 溶液呈酸性,在
溶液呈酸性,在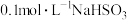 溶液中,下列关系不正确的
溶液中,下列关系不正确的_______ (填字母)。
a.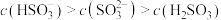
b.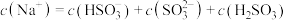
c.
d.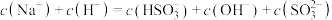
(2)已知: ,
,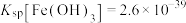 ,
, 时
时 开始沉淀,室温下,除去
开始沉淀,室温下,除去 溶液中的
溶液中的 ,
, (使其浓度均小于
(使其浓度均小于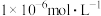 ),需调节溶液pH的范围为
),需调节溶液pH的范围为_______ 。
(3)如图是某温度下,将足量的 固体溶于一定量水中达到溶解平衡后,假定溶液体积不变的情况下,加入
固体溶于一定量水中达到溶解平衡后,假定溶液体积不变的情况下,加入 使
使 增大过程中,溶液中
增大过程中,溶液中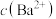 和
和 的变化曲线,根据图中的数据分析、计算。
的变化曲线,根据图中的数据分析、计算。
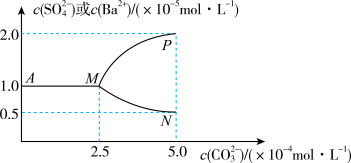
①该温度下, 的
的
_______ 。
②当 大于
大于_______  时开始有
时开始有 沉淀生成。
沉淀生成。
③图像中代表沉淀转化过程中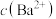 随
随 变化的曲线是
变化的曲线是_______ (填“MP”或“MN”);沉淀转化的离子方程式为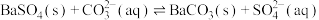 ,该反应的平衡常数
,该反应的平衡常数
_______ 。
(1)
 溶液呈酸性,在
溶液呈酸性,在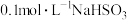 溶液中,下列关系不正确的
溶液中,下列关系不正确的a.
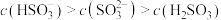
b.
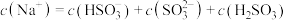
c.

d.
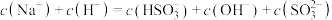
(2)已知:
 ,
,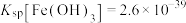 ,
, 时
时 开始沉淀,室温下,除去
开始沉淀,室温下,除去 溶液中的
溶液中的 ,
, (使其浓度均小于
(使其浓度均小于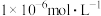 ),需调节溶液pH的范围为
),需调节溶液pH的范围为(3)如图是某温度下,将足量的
 固体溶于一定量水中达到溶解平衡后,假定溶液体积不变的情况下,加入
固体溶于一定量水中达到溶解平衡后,假定溶液体积不变的情况下,加入 使
使 增大过程中,溶液中
增大过程中,溶液中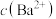 和
和 的变化曲线,根据图中的数据分析、计算。
的变化曲线,根据图中的数据分析、计算。
①该温度下,
 的
的
②当
 大于
大于 时开始有
时开始有 沉淀生成。
沉淀生成。③图像中代表沉淀转化过程中
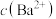 随
随 变化的曲线是
变化的曲线是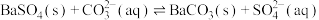 ,该反应的平衡常数
,该反应的平衡常数
您最近半年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】(1)泡沫灭火器内装有NaHCO3饱和溶液,该溶液呈_________ (填酸性、碱性、中性),原因(用离子方程式解释)_________________________________________ ;灭火器中另一容器装有Al2(SO4)3溶液,该溶液呈__________ (填酸性、碱性、中性),原因(用离子方程式释)______________________________________ 当意外失火时,使泡沫灭火器倒过来即可使药液混合,喷出CO2和Al(OH) 3,阻止火势蔓延。原因(用离子方程式解释)__________________________________________
(2)已知25℃,AgI的饱和溶液中,c(Ag+)=1.22×10-8mol/L,AgCl的饱和溶液中,c(Ag+)=1.25×10-5mol/L。若在5ml含有KCl和KI各为0.01mol/L的溶液中,加入8ml 0.01mol/L AgNO3溶液,这时溶液中所含溶质的离子浓度由大到小的次序是_________________________________________
(3)在某温度下,将H2和I2各0.10mol的气态混合物充入10L的密闭容器中充分反应,达到平衡后,测得c(H2)=0.0080mol/L。该反应的平衡常数 K=_________ ;在上述温度下,该容器中若通入H2和I2蒸气各0.20mol,求达到化学平衡状态时c(H2)=___________ ,c(I2)=___________ ,c(HI)=____________
(2)已知25℃,AgI的饱和溶液中,c(Ag+)=1.22×10-8mol/L,AgCl的饱和溶液中,c(Ag+)=1.25×10-5mol/L。若在5ml含有KCl和KI各为0.01mol/L的溶液中,加入8ml 0.01mol/L AgNO3溶液,这时溶液中所含溶质的离子浓度由大到小的次序是
(3)在某温度下,将H2和I2各0.10mol的气态混合物充入10L的密闭容器中充分反应,达到平衡后,测得c(H2)=0.0080mol/L。该反应的平衡常数 K=
您最近半年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐3】工业上利用β-锂辉矿(LiAlSi2O6和少量MgO、CaCO3杂质) 制备金属锂,工艺流程如下:
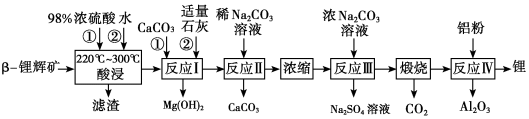
一定温度下,Ksp(CaCO3)=2.5×10-9,Ksp(Li2CO3)=1.6×10-3,若反应Ⅱ的溶液中c(Ca2+)和c(Li+)均为1.0 mol·L-1,则开始滴加稀Na2CO3溶液时,理论上c(CO )应控制的范围为
)应控制的范围为___________ ;实际操作中CaCO3和Li2CO3可能同时析出,从而造成Li+损失,一种改进的工艺是利用草酸钠代替Na2CO3作为沉淀剂,分析使用草酸钠的原因为___________ 。

一定温度下,Ksp(CaCO3)=2.5×10-9,Ksp(Li2CO3)=1.6×10-3,若反应Ⅱ的溶液中c(Ca2+)和c(Li+)均为1.0 mol·L-1,则开始滴加稀Na2CO3溶液时,理论上c(CO
 )应控制的范围为
)应控制的范围为
您最近半年使用:0次



