完成下列问题。
(1)已知常温下CN-的水解常数Kh=1.61×10-5,常温下,含等物质的量浓度的HCN与NaCN的混合溶液显___________ (填“酸”“碱”或“中”)性,c平(CN-)___________ (填“>”“<”或“=”)c平(HCN) 。
(2)取5 mL pH=5的NH4Cl溶液,加水稀释至50 mL,则c平(H+)________ (填“>”“<”或“=”)10-6 mol·L-1, 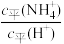
___________ (填“增大”“减小”或“不变”)。
(3)已知在室温条件下,pH均为5的H2SO4溶液和NH4Cl溶液,回答下列问题:各取5 mL上述溶液,分别加水稀释至50 mL,pH较大的是___________ 溶液。
(1)已知常温下CN-的水解常数Kh=1.61×10-5,常温下,含等物质的量浓度的HCN与NaCN的混合溶液显
(2)取5 mL pH=5的NH4Cl溶液,加水稀释至50 mL,则c平(H+)
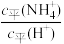
(3)已知在室温条件下,pH均为5的H2SO4溶液和NH4Cl溶液,回答下列问题:各取5 mL上述溶液,分别加水稀释至50 mL,pH较大的是
更新时间:2023-08-27 07:39:13
|
相似题推荐
填空题
|
适中
(0.65)
名校
【推荐1】已知25℃时电离常数:
(1)H2CO3、CH3COOH、HCN三种酸中酸性最弱的是_______ 。常温下,pH均为10的Na2CO3、CH3COONa、NaCN、NaHCO3四种溶液中,物质的量浓度最大的是_______ 。
(2)常温下,向20mL0.01mol·L-1CH3COOH溶液中逐滴加入0.01mol·L-1KOH溶液,其pH变化曲线如图所示(忽略温度变化)。请回答下列有关问题:
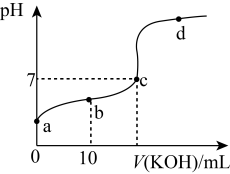
①若想观察滴定终点,滴定过程中宜选用_______ 作指示剂(填“酚酞”、“石蕊”或“甲基橙”)。
②b点时,溶液中离子浓度由大到小的顺序是_______ 。
(3)常温下,向NaCN溶液中通入少量 CO2发生反应的化学方程式为:_______ 。
(4)在一定条件下,Na2CO3溶液中存在CO +H2O
+H2O HCO
HCO +OH-平衡,下列说法不正确的是_______。
+OH-平衡,下列说法不正确的是_______。
| 酸 | H2CO3 | CH3COOH | HCN |
| Ka | Ka1=4.5×10-7Ka2=5.6×10-11 | 1.75×10-5 | 6.2×10-10 |
(2)常温下,向20mL0.01mol·L-1CH3COOH溶液中逐滴加入0.01mol·L-1KOH溶液,其pH变化曲线如图所示(忽略温度变化)。请回答下列有关问题:

①若想观察滴定终点,滴定过程中宜选用
②b点时,溶液中离子浓度由大到小的顺序是
(3)常温下,向NaCN溶液中通入
(4)在一定条件下,Na2CO3溶液中存在CO
 +H2O
+H2O HCO
HCO +OH-平衡,下列说法不正确的是_______。
+OH-平衡,下列说法不正确的是_______。A.稀释溶液,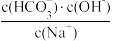 增大 增大 | B.通入CO2,溶液pH减小 |
| C.升高温度,水解平衡常数增大 | D.加入Na2O固体,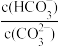 减小 减小 |
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐2】电离平衡常数是衡量弱电解质电离程度强弱的量。已知如表数据。
(1)25 ℃时,有等浓度的NaCN溶液、Na2CO3溶液、CH3COONa溶液,三种溶液的pH由大到小的顺序为__________________ 。
(2)25 ℃时,pH=3的CH3COOH溶液和pH=11的NaOH溶液混合,若所得溶液显酸性,则c(Na+)__________ c(CH3COO-)(填“>”、“<”或“=”)。
(3)NaCN溶液中通入少量CO2,所发生反应的化学方程式为___________ 。
(4)25 ℃时, pH=8的CH3COONa溶液中,c(Na+)-c(CH3COO-)=___________ 。
| 化学式 | 电离平衡常数(25℃) |
| HCN | K=4.9×10-10 |
| CH3COOH | K=1.8×10-5 |
| H2CO3 | K1=4.3×10-7、K2=5.6×10-11 |
(1)25 ℃时,有等浓度的NaCN溶液、Na2CO3溶液、CH3COONa溶液,三种溶液的pH由大到小的顺序为
(2)25 ℃时,pH=3的CH3COOH溶液和pH=11的NaOH溶液混合,若所得溶液显酸性,则c(Na+)
(3)NaCN溶液中通入少量CO2,所发生反应的化学方程式为
(4)25 ℃时, pH=8的CH3COONa溶液中,c(Na+)-c(CH3COO-)=
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐3】(1)请用离子方程式解释泡沫灭火器的原理:_______ 。
(2)在NaHCO3的溶液中,各离子的物质的量浓度由大到小的顺序是_______ 。
(3)硫酸铜溶液显酸性的原因_______ (用离子方程式表示)。
(4)物质的量浓度相同的醋酸和氢氧化钠溶液混合溶液中c(CH3COO﹣)=c(Na+),则混合后溶液显_______ 性。
(5)浓度均为0.1mol/L①NH4Cl ②CH3COONH4 ③NH4HSO4 ④氨水四种溶液中,c( )由大到小的顺序
)由大到小的顺序_______ (填序号)。
(6)常温下,将pH=11的氨水和pH=3的HCl溶液等体积混合,所得溶液呈_______ 性。
(7) 某温度时,0.1 mol·L-1的醋酸溶液中的c(H+)与0.01 mol·L-1的醋酸溶液中的c(H+)的比值_______ (填“大于”“小于”或“等于”)10。
(2)在NaHCO3的溶液中,各离子的物质的量浓度由大到小的顺序是
(3)硫酸铜溶液显酸性的原因
(4)物质的量浓度相同的醋酸和氢氧化钠溶液混合溶液中c(CH3COO﹣)=c(Na+),则混合后溶液显
(5)浓度均为0.1mol/L①NH4Cl ②CH3COONH4 ③NH4HSO4 ④氨水四种溶液中,c(
 )由大到小的顺序
)由大到小的顺序(6)常温下,将pH=11的氨水和pH=3的HCl溶液等体积混合,所得溶液呈
(7) 某温度时,0.1 mol·L-1的醋酸溶液中的c(H+)与0.01 mol·L-1的醋酸溶液中的c(H+)的比值
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐1】亚砷酸(H3AsO3)可用于治疗急性早幼粒细胞白血病,可通过注射至血液的方式直接给药。医用的亚砷酸溶液可通过将As2O3溶于过量NaOH溶液后加稀硫酸配置。一般情况下,亚砷酸溶液中各种微粒的物质的量分数与pH的关系如图所示。
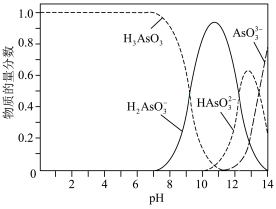
(1)写出As2O3溶于过量NaOH溶液的离子方程式:___________ 。
(2)将亚砷酸溶液注入一般情况下的血液后,砷元素的主要存在形式为___________ (填微粒化学符号)。
(3)该条件下,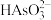 的电离平衡常数Ka3与
的电离平衡常数Ka3与 的水解平衡常数Kh1的大小关系为Ka3
的水解平衡常数Kh1的大小关系为Ka3 ____ Kh1(填“>”、“<”或“=”,下同)。对于0.1 mol/L Na2HAsO3溶液而言,c(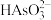 )
)______ c( )。
)。

(1)写出As2O3溶于过量NaOH溶液的离子方程式:
(2)将亚砷酸溶液注入一般情况下的血液后,砷元素的主要存在形式为
(3)该条件下,
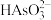 的电离平衡常数Ka3与
的电离平衡常数Ka3与 的水解平衡常数Kh1的大小关系为Ka3
的水解平衡常数Kh1的大小关系为Ka3 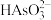 )
) )。
)。
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
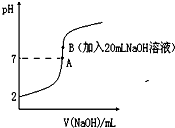
【推荐2】氢氟酸能腐蚀玻璃。25℃下,向20mL0.2mol•L-1的氢氟酸中滴加0.2mol•L-1的NaOH溶液时,溶液的pH变化如图所示。
已知:电离度(α)和电离平衡常数(K)一样,可以用来衡量弱电解质在稀溶液中的电离能力。
请回答下列问题:
(1)在氢氟酸的稀溶液中,通过改变以下条件能使氢氟酸的电离度[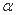 (HF)]增大的是
(HF)]增大的是_______ ,可使氢氟酸的电离平衡常数[Ka(HF)] 增大的是_____________ 。
a.升高温度 b.向溶液中滴入2滴浓盐酸 c.加入少量NaF固体 d.加水
(2)在此温度下,氢氟酸的电离平衡常数Ka(HF)为:_____ ,电离度α(HF)为______ %。
(3)下列有关图中各点微粒浓度关系正确的是________ 。
a.在A处溶液中:c(F—)+c(HF)=0.2 mol•L-1
b.在B处溶液中:c(H+)+c(HF)= c(OH—)
c.在B处溶液中:c(Na+)>c(F—)>c(H+)>c(OH—)
d.在A和B处溶液中都符合: = Ka(HF)
= Ka(HF)
(4)向此氢氟酸溶液中滴加10mlNaOH溶液后,请将HF分子与溶液中的离子浓度一起从大到小排序___________________________________________

已知:电离度(α)和电离平衡常数(K)一样,可以用来衡量弱电解质在稀溶液中的电离能力。

请回答下列问题:
(1)在氢氟酸的稀溶液中,通过改变以下条件能使氢氟酸的电离度[
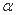 (HF)]增大的是
(HF)]增大的是a.升高温度 b.向溶液中滴入2滴浓盐酸 c.加入少量NaF固体 d.加水
(2)在此温度下,氢氟酸的电离平衡常数Ka(HF)为:
(3)下列有关图中各点微粒浓度关系正确的是
a.在A处溶液中:c(F—)+c(HF)=0.2 mol•L-1
b.在B处溶液中:c(H+)+c(HF)= c(OH—)
c.在B处溶液中:c(Na+)>c(F—)>c(H+)>c(OH—)
d.在A和B处溶液中都符合:
 = Ka(HF)
= Ka(HF)(4)向此氢氟酸溶液中滴加10mlNaOH溶液后,请将HF分子与溶液中的离子浓度一起从大到小排序
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐3】已知25℃时部分弱电解质的电离平衡常数数据如表所示,回答下列问题:
(1)同物质的量浓度的下列四种溶液:结合H+能力由大到小排列的顺序是___ (用编号填写)。
a.CH3COONa b.NaHCO3 c.NaClO d.Na2CO3
(2)常温下,0.2mol·L-1CH3COOH溶液加等体积的0.1mol·L-1NaOH溶液充分反应后,c(CH3COOH)___ c(CH3COO-)(填<、>或=)作出上述判断的依据是__ (用文字解释)。
(3)写出向次氯酸钠溶液中通入少量二氧化碳的离子方程式:___ 。
(4)25℃时,将amol·L-1的醋酸与bmol·L-1氢氧化钠等体积混合,反应后溶液恰好显中性,用a、b表示醋酸的电离平衡常数为___ 。
(5)标准状况下,将2.24LCO2通入100mL2mol·L-1的NaOH溶液中,用溶液中微粒的浓度符号完成下列等式:c(OH-)=2c(H2CO3)+___ 。
(6)若用标准NaOH溶液滴定某醋酸溶液,应选用___ 作指示剂。
| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离平衡常数 | Ka=1.8×10-5 | Ka1=4.3×10-7 Ka2=5.6×10-11 | Ka=3.0×10-8 |
(1)同物质的量浓度的下列四种溶液:结合H+能力由大到小排列的顺序是
a.CH3COONa b.NaHCO3 c.NaClO d.Na2CO3
(2)常温下,0.2mol·L-1CH3COOH溶液加等体积的0.1mol·L-1NaOH溶液充分反应后,c(CH3COOH)
(3)写出向次氯酸钠溶液中通入少量二氧化碳的离子方程式:
(4)25℃时,将amol·L-1的醋酸与bmol·L-1氢氧化钠等体积混合,反应后溶液恰好显中性,用a、b表示醋酸的电离平衡常数为
(5)标准状况下,将2.24LCO2通入100mL2mol·L-1的NaOH溶液中,用溶液中微粒的浓度符号完成下列等式:c(OH-)=2c(H2CO3)+
(6)若用标准NaOH溶液滴定某醋酸溶液,应选用
您最近一年使用:0次



