已知两种相邻周期、相邻主族的短周期非金属元素X、Y,其最高价氧化物对应的水化物均为强酸。根据下图转化关系(反应条件及部分产物已略去),回答下列问题:
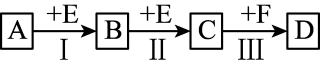
(1)若A、B、C、D均为含X元素的化合物,且A和F的分子均为10电子微粒,则:
①F属于________ (填“离子化合物”或“共价化合物”)。
②反应Ⅰ的化学方程式为______________________________ 。
③将1.92 g铜粉与一定量的D的浓溶液反应,当铜完全反应时收集到气体1.12 L(标准状况),则反应耗的D的物质的量为________ mol。
(2)若A、B、C、D均为含Y元素的化合物,其中A由两种元素组成,且A的摩尔质量为34 g·mol-1,则:①将铜粉与D的浓溶液反应所得溶液加热蒸干,得的白色固体物质为________ (填化学式)。
②将少量Na2Y溶液滴加到次氯酸钠溶液中发生应,无沉淀生成,请写出该反应的离子方程式__________________ 。在该反中若有74.5 g NaClO被还原,则转移电子的物质量为________ mol。
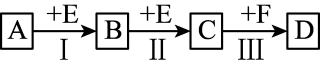
(1)若A、B、C、D均为含X元素的化合物,且A和F的分子均为10电子微粒,则:
①F属于
②反应Ⅰ的化学方程式为
③将1.92 g铜粉与一定量的D的浓溶液反应,当铜完全反应时收集到气体1.12 L(标准状况),则反应耗的D的物质的量为
(2)若A、B、C、D均为含Y元素的化合物,其中A由两种元素组成,且A的摩尔质量为34 g·mol-1,则:①将铜粉与D的浓溶液反应所得溶液加热蒸干,得的白色固体物质为
②将少量Na2Y溶液滴加到次氯酸钠溶液中发生应,无沉淀生成,请写出该反应的离子方程式
更新时间:2016-12-09 14:46:59
|
相似题推荐
解答题-原理综合题
|
较难
(0.4)
【推荐1】(1) MnSO4有多种制备方法。
①方法1:将锌精矿(主要成分为ZnS)和软锰矿(主要成分为MnO2)混合后用硫酸溶液浸出,反应的离子方程式为ZnS+MnO2+4H+=Zn2++Mn2++S+2H2O。溶液中加入Fe3+可以促进反应的发生,反应原理如图所示,其中________ (填 “A”或“B”)表示Fe3+。
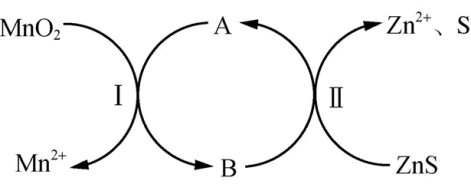
②方法2:在硫酸溶液中用铁屑还原MnO2,铁屑被氧化为Fe3+,该反应的离子方程式为________ 。为除去MnSO4溶液中的Cd2+,向溶液中通入H2S气体至饱和(H2S饱和溶液的浓度为0.1 mol·L-1,H2S的电离常数Ka1=1.5×10-7、Ka2=6×10-15),c(H+)=0.3 mol·L-1时,溶液中c(Cd2+)=________ mol·L-1。[Ksp(CdS)=8×10-27]
(2) MnSO4和(NH4)2SO4可制取硫酸铵锰晶体[(NH4)aMnb(SO4)c·xH2O],为测定该晶体的组成,进行如下实验:①称取一定质量的硫酸铵锰晶体,在空气中加热至脱去全部结晶水,质量减少30.8%;②将残留固体配成250 mL溶液A,取出25.00 mL,加入足量NaOH溶液充分加热,生成22.40 mL(标准状况)NH3;③另取25.00 mL溶液A,加入足量的BaCl2溶液得到0.233g BaSO4。通过计算确定该晶体的化学式________ 。(写出计算过程)
①方法1:将锌精矿(主要成分为ZnS)和软锰矿(主要成分为MnO2)混合后用硫酸溶液浸出,反应的离子方程式为ZnS+MnO2+4H+=Zn2++Mn2++S+2H2O。溶液中加入Fe3+可以促进反应的发生,反应原理如图所示,其中

②方法2:在硫酸溶液中用铁屑还原MnO2,铁屑被氧化为Fe3+,该反应的离子方程式为
(2) MnSO4和(NH4)2SO4可制取硫酸铵锰晶体[(NH4)aMnb(SO4)c·xH2O],为测定该晶体的组成,进行如下实验:①称取一定质量的硫酸铵锰晶体,在空气中加热至脱去全部结晶水,质量减少30.8%;②将残留固体配成250 mL溶液A,取出25.00 mL,加入足量NaOH溶液充分加热,生成22.40 mL(标准状况)NH3;③另取25.00 mL溶液A,加入足量的BaCl2溶液得到0.233g BaSO4。通过计算确定该晶体的化学式
您最近一年使用:0次
【推荐2】硫酸铁铵[(NH4)xFey(SO4)z∙nH2O]是一种重要铁盐,实验室采用废铁屑来制备硫酸铁铵的流程如下:
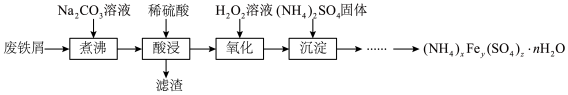
(1)将废铁屑和Na2CO3溶液混合煮沸可除去铁屑表面的油脂,原理是_____________ 。
(2)“氧化”过程需使用足量的H2O2,同时溶液要保持pH小于0.5,目的是__________ 。
(3)化学兴趣小组用如下方法测定硫酸铁铵晶体的化学式:
步骤1:准确称取样品28.92 g,溶于水配成100 mL溶液。
步骤2:准确量取25.00 mL步骤1所得溶液于锥形瓶中,加入适量稀硫酸,滴加过量的SnCl2溶液(Sn2+与Fe3+反应生成Sn4+和Fe2+),充分反应后除去过量的Sn2+。用0.1000mol∙L-1的K2Cr2O7溶液滴定Fe2+,滴定至终点时消耗K2Cr2O7溶液25.00 mL。(滴定过程中Cr2O72-转化成Cr3+)
步骤3:准确量取25.00 mL步骤1所得溶液于锥形瓶中,加入过量的BaCl2溶液,将所得白色沉淀过滤、洗涤、干燥后称量,所得固体质量为6.99 g。
①排除装有K2Cr2O7溶液的滴定管尖嘴处气泡的方法是_________ 。
②通过计算确定该硫酸铁铵的化学式____________ (写出计算过程)。

(1)将废铁屑和Na2CO3溶液混合煮沸可除去铁屑表面的油脂,原理是
(2)“氧化”过程需使用足量的H2O2,同时溶液要保持pH小于0.5,目的是
(3)化学兴趣小组用如下方法测定硫酸铁铵晶体的化学式:
步骤1:准确称取样品28.92 g,溶于水配成100 mL溶液。
步骤2:准确量取25.00 mL步骤1所得溶液于锥形瓶中,加入适量稀硫酸,滴加过量的SnCl2溶液(Sn2+与Fe3+反应生成Sn4+和Fe2+),充分反应后除去过量的Sn2+。用0.1000mol∙L-1的K2Cr2O7溶液滴定Fe2+,滴定至终点时消耗K2Cr2O7溶液25.00 mL。(滴定过程中Cr2O72-转化成Cr3+)
步骤3:准确量取25.00 mL步骤1所得溶液于锥形瓶中,加入过量的BaCl2溶液,将所得白色沉淀过滤、洗涤、干燥后称量,所得固体质量为6.99 g。
①排除装有K2Cr2O7溶液的滴定管尖嘴处气泡的方法是
②通过计算确定该硫酸铁铵的化学式
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
名校
解题方法
【推荐3】二氯亚砜(SOCl2)是一种无色易挥发液体,与水剧烈水解生成两种气体,常用作脱水剂,其熔点—105℃,沸点79℃,140℃以上时易分解。
(1)用硫黄(用S表示)、液氯和三氧化硫为原料在一定条件合成氯化亚砜,原子利用率达100%,则三者的物质的量比为_______________ 。写出SOCl2吸收水蒸气的化学方程式:_______________________________ 。
(2)甲同学设计下图装置用ZnCl2·xH2O晶体制取无水ZnCl2,回收剩余的SOCl2并验证生成物中含有SO2(夹持及加热装置略)。
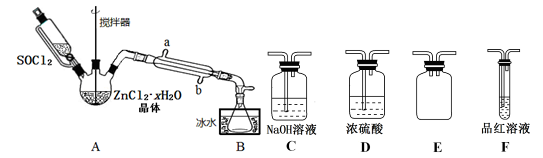
①装置的连接顺序为A→B→____ →___ →___ →____ 。
②冷凝管的进水口是_______________ 。(填“a”或“b”)
③实验结束,为检测ZnCl2·xH2O晶体是否完全脱水,称取蒸干后的固体ag溶于水,加入足量稀硝酸和硝酸银溶液,过滤洗涤干燥,称得固体为bg。若 =
=___ (保留一位小数),即可证明ZnCl2·xH2O晶体已完全脱水。
④乙同学认为直接将ZnCl2·xH2O晶体置于坩埚中加热灼烧即可得到无水ZnCl2,但大家说此方法不行,请解释原因______________________ 。
(3)丙同学认为SOCl2还可用作由FeCl3·6H2O制取无水FeCl3的脱水剂,但丁同学认为该实验会发生氧化还原反应。戊同学设计了如下实验方案判断丁同学的观点:取少量FeCl3 •6H2O于试管中,加入SOCl2,振荡使两种物质充分反应;再往试管中加水溶解,滴加KSCN溶液,若没有明显现象,则证明脱水过程中发生了氧化还原反应。按照戊同学的思路方法,还可以选择证明__________ 或______________ (填离子符号)是否存在证明该过程是否发生了氧化还原反应。
(1)用硫黄(用S表示)、液氯和三氧化硫为原料在一定条件合成氯化亚砜,原子利用率达100%,则三者的物质的量比为
(2)甲同学设计下图装置用ZnCl2·xH2O晶体制取无水ZnCl2,回收剩余的SOCl2并验证生成物中含有SO2(夹持及加热装置略)。

①装置的连接顺序为A→B→
②冷凝管的进水口是
③实验结束,为检测ZnCl2·xH2O晶体是否完全脱水,称取蒸干后的固体ag溶于水,加入足量稀硝酸和硝酸银溶液,过滤洗涤干燥,称得固体为bg。若
 =
=④乙同学认为直接将ZnCl2·xH2O晶体置于坩埚中加热灼烧即可得到无水ZnCl2,但大家说此方法不行,请解释原因
(3)丙同学认为SOCl2还可用作由FeCl3·6H2O制取无水FeCl3的脱水剂,但丁同学认为该实验会发生氧化还原反应。戊同学设计了如下实验方案判断丁同学的观点:取少量FeCl3 •6H2O于试管中,加入SOCl2,振荡使两种物质充分反应;再往试管中加水溶解,滴加KSCN溶液,若没有明显现象,则证明脱水过程中发生了氧化还原反应。按照戊同学的思路方法,还可以选择证明
您最近一年使用:0次
解答题-无机推断题
|
较难
(0.4)
名校
【推荐1】1869年,俄国化学家门捷列夫提出了元素周期律,并在此基础上发表了第一张元素周期表。为了纪念元素周期表诞生150年,联合国将2019年定为“国际化学元素周期表年”,并认为元素周期表是“科学共同的语言”。
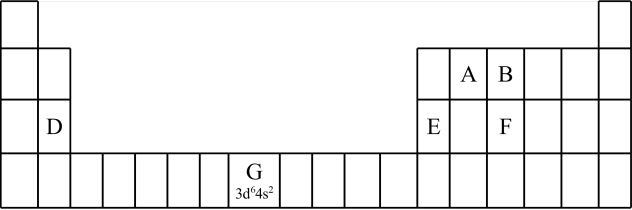
(1)认识元素周期表的结构:___________ 区。
②2017年5月9日我国发布了113号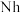 、115号
、115号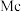 、117号
、117号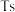 、118号
、118号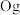 四种元素,则下列说法正确的是
四种元素,则下列说法正确的是___________ (填字母序号)。
a.113号元素在周期表中的位置是第七周期 族
族
b.117号元素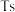 位于金属与非金属分界线上,属于准金属,可能是半导体
位于金属与非金属分界线上,属于准金属,可能是半导体
c.这四种元素都是主族元素
d.最高价氧化物的水化物的碱性:
(2)认识原子结构与元素周期表的关系:见表中元素 的信息,其中 “
的信息,其中 “ ”称为该元素原子的
”称为该元素原子的___________ ,该元素 能层上具有
能层上具有___________ 种不同运动状态的电子。
(3)认识元素周期律及其应用:
①第三周期元素的第一电离能:D_______ E(填“>” “<”或“=”)。
②气态氢化物的沸点:B_____ F (填“>”“<”或“=”),理由是___________ 。B的另一种氢化物可以作为火箭推进剂的燃料之一,其电子式为___________ 。
(1)认识元素周期表的结构:
②2017年5月9日我国发布了113号
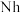 、115号
、115号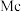 、117号
、117号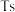 、118号
、118号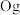 四种元素,则下列说法正确的是
四种元素,则下列说法正确的是a.113号元素在周期表中的位置是第七周期
 族
族b.117号元素
 位于金属与非金属分界线上,属于准金属,可能是半导体
位于金属与非金属分界线上,属于准金属,可能是半导体c.这四种元素都是主族元素
d.最高价氧化物的水化物的碱性:

(2)认识原子结构与元素周期表的关系:见表中元素
 的信息,其中 “
的信息,其中 “ ”称为该元素原子的
”称为该元素原子的 能层上具有
能层上具有(3)认识元素周期律及其应用:
①第三周期元素的第一电离能:D
②气态氢化物的沸点:B
您最近一年使用:0次
解答题-无机推断题
|
较难
(0.4)
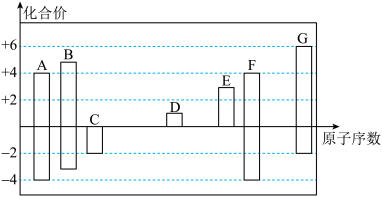
【推荐2】如图是部分短周期元素化合价与原子序数的关系图
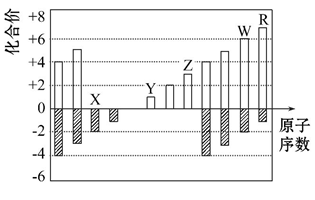
请回答下列问题(用元素符号表达):
(1) X、Y、Z 三种元素的原子半径大小顺序是____________
(2)X 与 Y 形成化合物Y2X2,写出该化合物的电子式____________
(3)RX2是一种强氧化性气体,可用于污水处理,能将 CN-氧化,生成两种无毒气体,该反应离子方程式为____________
(4)某阴离子 Wa2-(a 为2 − 6之间的数字)在碱性溶液中被 BrO3‾离子氧化为 WO42-,而BrO3-离子被还原为Br-,反应中消耗的 BrO3-离子和 OH ‾离子的物质的量之比为 2:3,则 a =____________ 。

请回答下列问题(用元素符号表达):
(1) X、Y、Z 三种元素的原子半径大小顺序是
(2)X 与 Y 形成化合物Y2X2,写出该化合物的电子式
(3)RX2是一种强氧化性气体,可用于污水处理,能将 CN-氧化,生成两种无毒气体,该反应离子方程式为
(4)某阴离子 Wa2-(a 为2 − 6之间的数字)在碱性溶液中被 BrO3‾离子氧化为 WO42-,而BrO3-离子被还原为Br-,反应中消耗的 BrO3-离子和 OH ‾离子的物质的量之比为 2:3,则 a =
您最近一年使用:0次