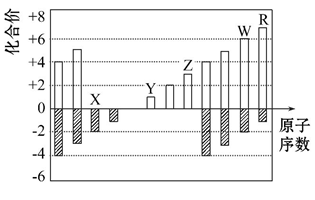
如图是部分短周期元素化合价与原子序数的关系图
请回答下列问题(用元素符号表达):
(1) X、Y、Z 三种元素的原子半径大小顺序是____________
(2)X 与 Y 形成化合物Y2X2,写出该化合物的电子式____________
(3)RX2是一种强氧化性气体,可用于污水处理,能将 CN-氧化,生成两种无毒气体,该反应离子方程式为____________
(4)某阴离子 Wa2-(a 为2 − 6之间的数字)在碱性溶液中被 BrO3‾离子氧化为 WO42-,而BrO3-离子被还原为Br-,反应中消耗的 BrO3-离子和 OH ‾离子的物质的量之比为 2:3,则 a =____________ 。

请回答下列问题(用元素符号表达):
(1) X、Y、Z 三种元素的原子半径大小顺序是
(2)X 与 Y 形成化合物Y2X2,写出该化合物的电子式
(3)RX2是一种强氧化性气体,可用于污水处理,能将 CN-氧化,生成两种无毒气体,该反应离子方程式为
(4)某阴离子 Wa2-(a 为2 − 6之间的数字)在碱性溶液中被 BrO3‾离子氧化为 WO42-,而BrO3-离子被还原为Br-,反应中消耗的 BrO3-离子和 OH ‾离子的物质的量之比为 2:3,则 a =
更新时间:2020-01-17 17:28:04
|
相似题推荐
解答题-原理综合题
|
较难
(0.4)
【推荐1】磷是重要的元素,能形成多种含氧酸和含氧酸盐。请回答下列问题:
(1)已知 (次磷酸)是一元中强酸,写出
(次磷酸)是一元中强酸,写出 溶液与足量
溶液与足量 溶液反应的离子方程式:
溶液反应的离子方程式:_______ 。
(2) 时,向一定体积的亚磷酸
时,向一定体积的亚磷酸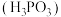 溶液中滴加等物质的量浓度的
溶液中滴加等物质的量浓度的 溶液,混合液中含磷粒子的物质的量分数
溶液,混合液中含磷粒子的物质的量分数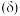 与溶液
与溶液 的关系如图所示。
的关系如图所示。

① 代表含磷粒子为
代表含磷粒子为_______ 。
②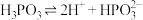 的K为
的K为_______ 。
(3)过量含磷物质的排放会致使水体富营养化,因此发展水体除磷技术非常重要。磷酸铵镁结晶法回收废水中的磷是近几年的研究热点。其原理为: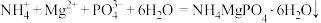 。
。

① 时,磷去除率与初始溶液中
时,磷去除率与初始溶液中 的关系如题图1所示。为达到最佳除磷效果,并节约试剂,
的关系如题图1所示。为达到最佳除磷效果,并节约试剂,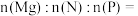
_______ 。
② 一定,磷去除率随溶液初始
一定,磷去除率随溶液初始 变化如图2所示。则最佳除磷效果的
变化如图2所示。则最佳除磷效果的 范围是
范围是_______ ,并说明原因_______ 。
(1)已知
 (次磷酸)是一元中强酸,写出
(次磷酸)是一元中强酸,写出 溶液与足量
溶液与足量 溶液反应的离子方程式:
溶液反应的离子方程式:(2)
 时,向一定体积的亚磷酸
时,向一定体积的亚磷酸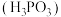 溶液中滴加等物质的量浓度的
溶液中滴加等物质的量浓度的 溶液,混合液中含磷粒子的物质的量分数
溶液,混合液中含磷粒子的物质的量分数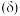 与溶液
与溶液 的关系如图所示。
的关系如图所示。
①
 代表含磷粒子为
代表含磷粒子为②
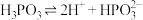 的K为
的K为(3)过量含磷物质的排放会致使水体富营养化,因此发展水体除磷技术非常重要。磷酸铵镁结晶法回收废水中的磷是近几年的研究热点。其原理为:
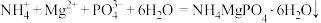 。
。
①
 时,磷去除率与初始溶液中
时,磷去除率与初始溶液中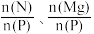 的关系如题图1所示。为达到最佳除磷效果,并节约试剂,
的关系如题图1所示。为达到最佳除磷效果,并节约试剂,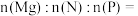
②
 一定,磷去除率随溶液初始
一定,磷去除率随溶液初始 变化如图2所示。则最佳除磷效果的
变化如图2所示。则最佳除磷效果的 范围是
范围是
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
名校
解题方法
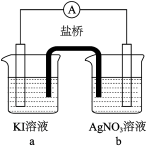
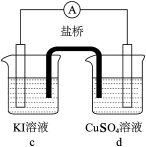
【推荐2】某小组设计不同实验方案比较Cu2+、Ag+ 的氧化性。
(1)方案1:通过置换反应比较
向酸化的AgNO3溶液插入铜丝,析出黑色固体,溶液变蓝。反应的离子方程式是_______ ,说明氧化性Ag+>Cu2+。
(2)方案2:通过Cu2+、Ag+ 分别与同一物质反应进行比较
①经检验,Ⅰ中溶液不含I2,黄色沉淀是________ 。
②经检验,Ⅱ中溶液含I2。推测Cu2+做氧化剂,白色沉淀A是CuI。确认A的实验如下:________ (填离子符号)。
b.白色沉淀B是________ 。
c.白色沉淀A与AgNO3溶液反应的离子方程式是____ ,说明氧化性Ag+>Cu2+。
(3)分析方案2中Ag+ 未能氧化I- ,但Cu2+氧化了I-的原因,设计实验如下:
(电极均为石墨,溶液浓度均为 1 mol/L,b、d中溶液pH≈4)
① a中溶液呈棕黄色的原因是_______ (用电极反应式表示)。
② “实验3”不能说明Cu2+氧化了I-。依据是空气中的氧气也有氧化作用,设计实验证实了该依据,实验方案及现象是_______ 。
③ 方案2中,Cu2+能氧化I-,而Ag+未能氧化I-的原因:_______ 。(资料:Ag+ + I- = AgI↓ K1 =1.2×1016;2Ag+ + 2I- = 2Ag↓+ I2 K2 = 8.7×108)
(1)方案1:通过置换反应比较
向酸化的AgNO3溶液插入铜丝,析出黑色固体,溶液变蓝。反应的离子方程式是
(2)方案2:通过Cu2+、Ag+ 分别与同一物质反应进行比较
| 实验 | 试剂 | 编号及现象 | |
| 试管 | 滴管 | ||
| 1.0 mol/L KI溶液 | 1.0mol/L AgNO3溶液 | Ⅰ.产生黄色沉淀,溶液无色 |
| 1.0mol/L CuSO4溶液 | Ⅱ.产生白色沉淀A,溶液变黄 | ||
②经检验,Ⅱ中溶液含I2。推测Cu2+做氧化剂,白色沉淀A是CuI。确认A的实验如下:

b.白色沉淀B是
c.白色沉淀A与AgNO3溶液反应的离子方程式是
(3)分析方案2中Ag+ 未能氧化I- ,但Cu2+氧化了I-的原因,设计实验如下:
| 编号 | 实验1 | 实验2 | 实验3 |
| 实验 |
|
|
|
| 现象 | 无明显变化 | a中溶液较快变棕黄色,b中电极 上析出银;电流计指针偏转 | c中溶液较慢变浅黄色; 电流计指针偏转 |
① a中溶液呈棕黄色的原因是
② “实验3”不能说明Cu2+氧化了I-。依据是空气中的氧气也有氧化作用,设计实验证实了该依据,实验方案及现象是
③ 方案2中,Cu2+能氧化I-,而Ag+未能氧化I-的原因:
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
解题方法
【推荐3】高纯二氧化锗主要用于生产光学及半导体用的锗材料。实验室通过下列装置(加热及夹持装置已略去)以二氧化锗粗品(含少量As2O3)为原料制备GeCl4,进一步制得GeO2•2H2O晶体,再加热干燥制得纯度较高的GeO2。实验开始时,仪器a加入NaOH溶液,与粗品充分反应后,通入氯气,再通过仪器a滴加浓盐酸。已知:①GeCl4熔点为-51.5℃,沸点为86.6℃,易水解。
②GeO2、As2O3与NaOH溶液反应生成Na2GeO3、NaAsO2,NaAsO2与盐酸反应生成有毒的AsCl3(沸点130.2℃),H3AsO4(沸点160℃)。回答下列问题:
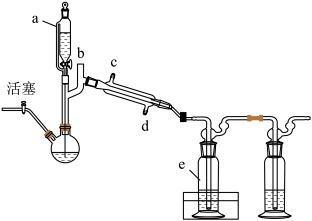
(1)仪器a的名称为______ ,接口b须连接仪器______ (填仪器名称)。
(2)向二颈烧瓶中加入NaOH溶液,当观察到______ 时,停止滴加。
(3)通入适量氯气的目的是______ (用离子方程式表示)。
(4)实验过程中必须防止烧瓶中盐酸浓度过低,其目的是______ 。
(5)将e中的液体与蒸馏水按一定比例进行混合,密封静置12小时,可得到GeO2•2H2O晶体,此过程中的化学方程式为______ ,该操作时保持较低温度有利于提高产率,其可能的原因是______ (答一条即可)。
(6)二氧化锗(M=105)的纯度采用碘酸钾滴定法进行测定。称取0.5000g二氧化锗样品,加入氢氧化钠溶液在电炉上溶解,用次磷酸钠还原为Ge2+,选用适当指示剂,用酸化的0.1000mol•L-1的碘酸钾标准溶液滴定,消耗碘酸钾的体积为15.80mL。判断滴定达到终点时的现象是______ ,此样品中二氧化锗的质量分数是______ (保留2位小数)。
已知:①该实验条件下亚磷酸钠不会被碘酸钾氧化;
②Ge2++IO +H+→Ge4++I-+H2O(未配平)。
+H+→Ge4++I-+H2O(未配平)。
②GeO2、As2O3与NaOH溶液反应生成Na2GeO3、NaAsO2,NaAsO2与盐酸反应生成有毒的AsCl3(沸点130.2℃),H3AsO4(沸点160℃)。回答下列问题:

(1)仪器a的名称为
(2)向二颈烧瓶中加入NaOH溶液,当观察到
(3)通入适量氯气的目的是
(4)实验过程中必须防止烧瓶中盐酸浓度过低,其目的是
(5)将e中的液体与蒸馏水按一定比例进行混合,密封静置12小时,可得到GeO2•2H2O晶体,此过程中的化学方程式为
(6)二氧化锗(M=105)的纯度采用碘酸钾滴定法进行测定。称取0.5000g二氧化锗样品,加入氢氧化钠溶液在电炉上溶解,用次磷酸钠还原为Ge2+,选用适当指示剂,用酸化的0.1000mol•L-1的碘酸钾标准溶液滴定,消耗碘酸钾的体积为15.80mL。判断滴定达到终点时的现象是
已知:①该实验条件下亚磷酸钠不会被碘酸钾氧化;
②Ge2++IO
 +H+→Ge4++I-+H2O(未配平)。
+H+→Ge4++I-+H2O(未配平)。
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
解题方法
【推荐1】钼酸钠晶体(Na2MoO4·2H2O)是无公害型冷却水系统的金属缓蚀剂,由钼精矿(主要成分是MoS2,含少量PbS 等)制备钼酸钠晶体的部分流程如下:

(1)Na2MoO4·2H2O 中钼元素的化合价为____________ ;焙烧时为了使钼精矿充分反应,可采取的措施是______________ (答出一条即可)。
(2)写出焙烧附生成MoO3 的化学方程式为:_________________ 。
(3)写出“碱浸”反应的离子方程式:____________________ 。
(4)下图是碳钢在3 种不同介质中的腐蚀速率实验结果:

①当硫酸的浓度大于90%时,腐蚀速率几率为零,原因是__________________ 。
②空气中钼酸盐对碳钢的缓蚀原理是在钢铁表面形成FeMoO4-Fe2O3 保护膜。密闭式循环冷却水系统中的碳钢管道缓蚀,除需加入钼酸盐外还需加入NaNO2。则NaNO2的作用是_________________ 。
③要使碳素钢的缓蚀效果最优,钼酸钠和月桂酰肌氨酸的浓度比应为_______________ 。
(5)锂和二硫化钼形成的二次电池的总反应为:xLi+nMoS2 Lix(MoS2)n。则电池放电时的正极反应式是:
Lix(MoS2)n。则电池放电时的正极反应式是:______________________ 。
(6)碱浸液结晶前需加入Ba(OH)2固体以除去SO42-,当BaMoO4开始沉淀时,SO42-的去除率是__________ 。[已知:碱浸液中c(MoO42-)=0.40mol·L-1,c(SO42-)=0.04mol·L-1,Ksp(BaSO4)=1.0×10-10,Ksp(BaMoO4)=40×10-8加入Ba(OH)2固体引起的溶液体积变化可忽略。]

(1)Na2MoO4·2H2O 中钼元素的化合价为
(2)写出焙烧附生成MoO3 的化学方程式为:
(3)写出“碱浸”反应的离子方程式:
(4)下图是碳钢在3 种不同介质中的腐蚀速率实验结果:

①当硫酸的浓度大于90%时,腐蚀速率几率为零,原因是
②空气中钼酸盐对碳钢的缓蚀原理是在钢铁表面形成FeMoO4-Fe2O3 保护膜。密闭式循环冷却水系统中的碳钢管道缓蚀,除需加入钼酸盐外还需加入NaNO2。则NaNO2的作用是
③要使碳素钢的缓蚀效果最优,钼酸钠和月桂酰肌氨酸的浓度比应为
(5)锂和二硫化钼形成的二次电池的总反应为:xLi+nMoS2
 Lix(MoS2)n。则电池放电时的正极反应式是:
Lix(MoS2)n。则电池放电时的正极反应式是:(6)碱浸液结晶前需加入Ba(OH)2固体以除去SO42-,当BaMoO4开始沉淀时,SO42-的去除率是
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
【推荐2】 是有机合成的重要催化剂,并可用于颜料、防腐等工业。工业上由废铜料(含
是有机合成的重要催化剂,并可用于颜料、防腐等工业。工业上由废铜料(含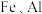 及其化合物、
及其化合物、 等杂质),生产
等杂质),生产 的工艺流程如下:
的工艺流程如下: )时的
)时的 如下表:
如下表:
② 溶液用水稀释后可生成
溶液用水稀释后可生成 沉淀。
沉淀。
(1)“酸浸”时提高浸取率的措施有___________ (写出两条)。
(2)滤渣I的主要成分是___________ (填化学式)。
(3)操作 为调节溶液的
为调节溶液的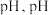 的最佳范围是
的最佳范围是___________ ,加入的物质X可以是___________ ( (填字母标号)。
A. B.
B.  C.
C.  D.
D.  溶液
溶液
(4)往滤液 中加入食盐并通入
中加入食盐并通入 可生成
可生成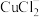 ,反应I的离子方程式为
,反应I的离子方程式为___________ ;在反应I中加入食盐并加热的目的是___________ 。
(5)实验室可以使用铜电极电解饱和食盐水得到 ,阳极的电极反应式为
,阳极的电极反应式为___________ 。
 是有机合成的重要催化剂,并可用于颜料、防腐等工业。工业上由废铜料(含
是有机合成的重要催化剂,并可用于颜料、防腐等工业。工业上由废铜料(含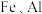 及其化合物、
及其化合物、 等杂质),生产
等杂质),生产 的工艺流程如下:
的工艺流程如下:
 )时的
)时的 如下表:
如下表:| 物质 |  |  |  |
开始沉淀时的 | 1.6 | 3.2 | 5.2 |
完全沉淀时的 | 3.1 | 4.7 | 6.7 |
 溶液用水稀释后可生成
溶液用水稀释后可生成 沉淀。
沉淀。(1)“酸浸”时提高浸取率的措施有
(2)滤渣I的主要成分是
(3)操作
 为调节溶液的
为调节溶液的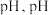 的最佳范围是
的最佳范围是A.
 B.
B.  C.
C.  D.
D.  溶液
溶液(4)往滤液
 中加入食盐并通入
中加入食盐并通入 可生成
可生成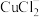 ,反应I的离子方程式为
,反应I的离子方程式为(5)实验室可以使用铜电极电解饱和食盐水得到
 ,阳极的电极反应式为
,阳极的电极反应式为
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
解题方法
【推荐3】嫦娥五号从月球带回的“土壤”中含有辉钼矿,其主要成分为 (S为
(S为 价),含少量
价),含少量 、
、 、
、 (铼)等元素。其中钼
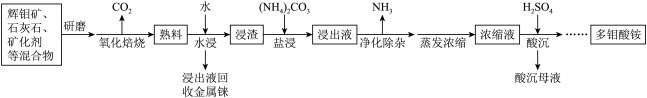
(铼)等元素。其中钼 是大脑必需的七种微量元素之一,以辉钼矿为原料生产多钼酸盐的工艺流程如下。
是大脑必需的七种微量元素之一,以辉钼矿为原料生产多钼酸盐的工艺流程如下。
已知:25℃时
回答下列问题:
(1)“研磨”的目的是_______ 。
(2)“氧化焙烧”中发生反应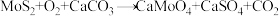 ,该反应中氧化剂与还原剂的物质的量之比为
,该反应中氧化剂与还原剂的物质的量之比为_______ ,其中加入石灰石的主要作用是_______ 。
(3)加入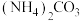 后的“浸出液”中含有
后的“浸出液”中含有 (钼酸根),以及少量
(钼酸根),以及少量 等离子,生成
等离子,生成 的离子方程式为
的离子方程式为_______ ,该反应的
_______ 。
(4)根据已知数据,“净化除杂”过程中,可加入最适宜的试剂是_______ (填标号)。
A.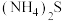 B.
B. C.
C.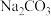 D.
D.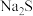
该试剂主要是将 离子转化为
离子转化为_______ (填化学式)。
(5)“酸沉”过程,调节 至6以下,将溶液中的钼酸根离子转化为仲钼酸根离子
至6以下,将溶液中的钼酸根离子转化为仲钼酸根离子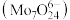 ,该反应的离子方程式为
,该反应的离子方程式为_______ 。
(6)工艺流程中可循环利用的物质是_______ 、_______ 。
 (S为
(S为 价),含少量
价),含少量 、
、 、
、 (铼)等元素。其中钼
(铼)等元素。其中钼 是大脑必需的七种微量元素之一,以辉钼矿为原料生产多钼酸盐的工艺流程如下。
是大脑必需的七种微量元素之一,以辉钼矿为原料生产多钼酸盐的工艺流程如下。
已知:25℃时
| 难溶物 |  | 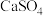 |  |  |  |
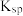 | 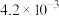 |  |  | 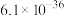 | 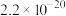 |
(1)“研磨”的目的是
(2)“氧化焙烧”中发生反应
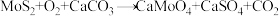 ,该反应中氧化剂与还原剂的物质的量之比为
,该反应中氧化剂与还原剂的物质的量之比为(3)加入
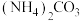 后的“浸出液”中含有
后的“浸出液”中含有 (钼酸根),以及少量
(钼酸根),以及少量 等离子,生成
等离子,生成 的离子方程式为
的离子方程式为
(4)根据已知数据,“净化除杂”过程中,可加入最适宜的试剂是
A.
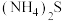 B.
B. C.
C.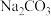 D.
D.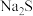
该试剂主要是将
 离子转化为
离子转化为(5)“酸沉”过程,调节
 至6以下,将溶液中的钼酸根离子转化为仲钼酸根离子
至6以下,将溶液中的钼酸根离子转化为仲钼酸根离子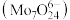 ,该反应的离子方程式为
,该反应的离子方程式为(6)工艺流程中可循环利用的物质是
您最近一年使用:0次
解答题-无机推断题
|
较难
(0.4)
名校
解题方法
【推荐1】(1)写出下列具有10个电子的粒子的化学式:原子的原子结构示意图_____________ ,由2个原子组成的分子是_____________ 、阴离子是_____________ 。
(2)X、Y、Z、W为短周期的四种元素,其最高正价依次为+1、+4、+5、+7,核电荷数按照Y、Z、X、W的顺序增大。已知Y与Z的原子次外层的电子数均为2,W、X的原子次外层的电子数均为8。
①写出Y元素的名称_____________________ 。
②写出W元素在周期表中的位置__________________ 。
③写出X的最高价氧化物与Z的最高价氧化物对应水化物反应的化学方程式________________________ 。
④按碱性减弱、酸性增强的顺序写出各元素最高价氧化物对应水化物的分子式:_____________ ,_____________ ,_____________ ,_____________ 。
(2)X、Y、Z、W为短周期的四种元素,其最高正价依次为+1、+4、+5、+7,核电荷数按照Y、Z、X、W的顺序增大。已知Y与Z的原子次外层的电子数均为2,W、X的原子次外层的电子数均为8。
①写出Y元素的名称
②写出W元素在周期表中的位置
③写出X的最高价氧化物与Z的最高价氧化物对应水化物反应的化学方程式
④按碱性减弱、酸性增强的顺序写出各元素最高价氧化物对应水化物的分子式:
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
解题方法
【推荐2】回答以下关于元素及其化合物的问题。
(1)Na原子核外有________ 种不同能量的电子,其离子最外层电子的轨道表示式________ 。
(2)相同压强下,部分元素氟化物的熔点见下表:
①试解释上表中氟化物熔点差异的原因:___________ 。
② 分子的空间构型为
分子的空间构型为___________ , 中Si—F键间的键角是
中Si—F键间的键角是___________ 。
(3)元素周期表有多种形式。下图分别是三种不同形式元素周期表的局部区域。

①图A中,数值越大,则该元素的___________ (填“金属性”或“非金属性”)越强。写出能说明O、F两元素该性质强弱的化学方程式___________ 。
②根据图B预测,整个周期表中位置最低的元素应位于___________ (放射性元素除外)。图B所示第二周期主族元素中,某元素该性质反常偏高,则该元素原子核外电子排布式为___________ 。
③图C表示的意义是___________ 。
(4)元素周期表中,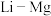 、
、 、
、 处于对角线关系,其单质与化合物的性质相似。下列说法正确的是___________(选填序号)。
处于对角线关系,其单质与化合物的性质相似。下列说法正确的是___________(选填序号)。
(1)Na原子核外有
(2)相同压强下,部分元素氟化物的熔点见下表:
| 氟化物 |  |  |  |
| 熔点/℃ | 1266 | 1534 | 183 |
②
 分子的空间构型为
分子的空间构型为 中Si—F键间的键角是
中Si—F键间的键角是(3)元素周期表有多种形式。下图分别是三种不同形式元素周期表的局部区域。

①图A中,数值越大,则该元素的
②根据图B预测,整个周期表中位置最低的元素应位于
③图C表示的意义是
(4)元素周期表中,
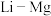 、
、 、
、 处于对角线关系,其单质与化合物的性质相似。下列说法正确的是___________(选填序号)。
处于对角线关系,其单质与化合物的性质相似。下列说法正确的是___________(选填序号)。A. 易溶于水 易溶于水 | B. |
C. 熔点高 熔点高 | D.晶体硼为分子晶体 |
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
解题方法
【推荐3】饮用水中含有砷会导致砷中毒,金属冶炼过程产生的含砷有毒废弃物需处理与检测。冶炼废水中砷元素主要以亚砷酸(H3AsO3)形式存在,可用化学沉降法处理酸性高浓度含砷废水,其工艺流程如下:
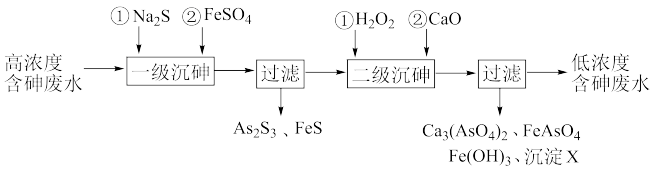
已知:①As2S3与过量的S2-存在以下反应:As2S3(s)+3S2-(aq) 2
2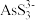 (aq);
(aq);
②亚砷酸盐的溶解性大于相应砷酸盐。
(1)砷是第四周期VA族元素,则砷的原子序数为________ ;AsH3的电子式为____________ ;
(2)根据元素周期律,下列说法正确的是_________ 。
a.酸性: H2SO4>H3PO4>H3AsO4 b.原子半径:S>P>As c.非金属性:S>P>As
(3)砷酸的第一步电离方程式为________________ 。
(4)沉淀X为_________________ (填化学式)。
(5)“一级沉砷”中FeSO4的作用是____________________________________________ ;“二级沉砷”中H2O2与含砷物质反应的化学方程式为_____________________________ 。
(6)关于地下水中砷的来源有多种假设,其中一种认为是富含砷的黄铁矿(FeS2)被氧化为Fe(OH)3,同时生成 ,导致砷脱离矿体进入地下水。FeS2被O2氧化的离子方程式为
,导致砷脱离矿体进入地下水。FeS2被O2氧化的离子方程式为______________________

已知:①As2S3与过量的S2-存在以下反应:As2S3(s)+3S2-(aq)
 2
2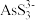 (aq);
(aq);②亚砷酸盐的溶解性大于相应砷酸盐。
(1)砷是第四周期VA族元素,则砷的原子序数为
(2)根据元素周期律,下列说法正确的是
a.酸性: H2SO4>H3PO4>H3AsO4 b.原子半径:S>P>As c.非金属性:S>P>As
(3)砷酸的第一步电离方程式为
(4)沉淀X为
(5)“一级沉砷”中FeSO4的作用是
(6)关于地下水中砷的来源有多种假设,其中一种认为是富含砷的黄铁矿(FeS2)被氧化为Fe(OH)3,同时生成
 ,导致砷脱离矿体进入地下水。FeS2被O2氧化的离子方程式为
,导致砷脱离矿体进入地下水。FeS2被O2氧化的离子方程式为
您最近一年使用:0次
解答题-无机推断题
|
较难
(0.4)
解题方法
【推荐1】下图是元素周期表的一部分,针对表中的①—⑧八种元素,用元素符号或化学式回答相关问题:
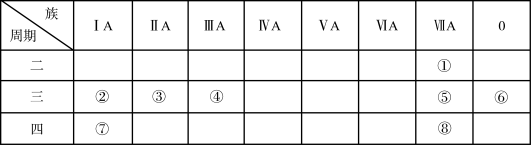
(1)在这些元素中,化学性质最不活泼的原子的原子结构示意图为___________ 。
(2)地壳中含量最多的金属元素是___________ 。
(3)用电子式表示①与③形成化合物的过程:__________________ 。
(4)这些元素的氧化物对应的水化物中,酸性最强的是________ ,碱性最强的是__________ ,显两性的是___________ ,该两性物质与②的最高价氧化物对应水化物的溶液反应的离子方程式为: _______________________ 。
(5)①②③④四种元素的简单离子核外电子排布相同,都有__________ 个电子,它们的离子半径由大到小的顺序是__________________ (用“>”表示)。
(6)①⑤⑧三种元素的单质沸点由高到低的顺序是_________________ (用“>”表示)。

(1)在这些元素中,化学性质最不活泼的原子的原子结构示意图为
(2)地壳中含量最多的金属元素是
(3)用电子式表示①与③形成化合物的过程:
(4)这些元素的氧化物对应的水化物中,酸性最强的是
(5)①②③④四种元素的简单离子核外电子排布相同,都有
(6)①⑤⑧三种元素的单质沸点由高到低的顺序是
您最近一年使用:0次
解答题-无机推断题
|
较难
(0.4)
【推荐2】A、B、D、E、F为原子序数依次增大的五种短周期主族元素,非金属元素A最外层电子数与其周期数相同,B的最外层电子数是其所在周期数的2倍。B单质在D单质中充分燃烧能生成其最高价化合物BD2。E+与D2-具有相同的电子数。A单质在F单质中燃烧,产物溶于水得到一种强酸。用相应的化学用语回答下列问题:
(1)F在周期表中的位置是____ ,E2D2的电子式为_____ 。
(2)AFD的结构式为_____ ,BD2形成晶体的类型为____ 。
(3)元素D、E、F形成的简单离子的半径由大到小为_____ (用离子符号表示)
(4)写出E与D形成的既含离子键又含共价键的化合物与水反应的化学方程式____ 。
(1)F在周期表中的位置是
(2)AFD的结构式为
(3)元素D、E、F形成的简单离子的半径由大到小为
(4)写出E与D形成的既含离子键又含共价键的化合物与水反应的化学方程式
您最近一年使用:0次
解答题-无机推断题
|
较难
(0.4)
解题方法
【推荐3】A、B、C、D、E、F、G七种短周期主族元素的原子序数依次增大。A和E最外层电子数相同,短周期主族元素的原子中,E原子的半径最大;B、C和F在周期表中相邻,B、C同周期,C、F同主族,F原子的质子数是C原子质子数的2倍;A和C可形成两种常见的液态化合物X和Y(相对分子质量X<Y );D形成的分子为双原子分子。回答问题:
(1)D元素的名称为______ , F形成的离子的结构示意图为______ 。
(2)写出液态化合物Y的一种用途______ 。
(3)用某种金属易拉罐与A、C、E组成的化合物的水溶液反应,产生的气体可充填气球,请写出该反应的离子方程式______ ,使用这种气球存在的隐患是______ 。
(4)P和Q两种物质都是由A、C、E、F四种元素组成的盐,其水溶液都显酸性,等物质的量的P和Q恰好完全反应。写出该反应的离子方程式:______ 。
(5)A、B、G三种元素两两组合形成的化合物在空气中相遇形成白烟,反应的化学方程式为______ 。
(1)D元素的名称为
(2)写出液态化合物Y的一种用途
(3)用某种金属易拉罐与A、C、E组成的化合物的水溶液反应,产生的气体可充填气球,请写出该反应的离子方程式
(4)P和Q两种物质都是由A、C、E、F四种元素组成的盐,其水溶液都显酸性,等物质的量的P和Q恰好完全反应。写出该反应的离子方程式:
(5)A、B、G三种元素两两组合形成的化合物在空气中相遇形成白烟,反应的化学方程式为
您最近一年使用:0次