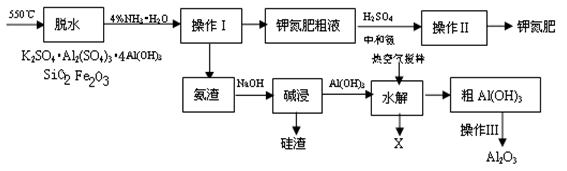
K2SO4是制备K2CO3、KAl(SO4)2等钾盐的原料,可用于玻璃、染料、香料等工业,在医药上可用作缓泻剂,在农业上是主要的无氯钾肥。以下是用氨碱法从明矾石提取硫酸钾工艺流程图。明矾石主要成分为K2SO4•Al2(SO4)3•4Al(OH)3 ,通常含有少量SiO2、Fe2O3等。
回答题:
(1)用28%氨水(密度为0.898g/L)配制4%氨水(密度为0.981g/L)500mL,需28%氨水______ mL,配制溶液时,应选用的仪器是______ (选填序号)。
(a)20mL量筒 (b)100 mL量筒 (c)500 mL量筒 (d) 500 mL容量瓶
(2)填写下列操作名称:操作Ⅰ_________ 、操作Ⅱ_________ 、操作Ⅲ_________ 。
(3)硅渣主要成分是___________ ,(写化学式),脱硅后的固体为红泥,可用于_________ 。
(4)上述流程中可以循环使用的物质X是__________________ 。
(5)钾氮肥的主要成分是__________ ,请设计实验检验钾氮肥中(除K+以外)的阳离子:(写出所需试剂、实验步骤和结论)_________________ ;
(6)为了测定钾氮肥中钾的含量,在试样完全溶于水后,加入足量氯化钡溶液,得到白色沉淀a克,若要计算K2SO4的物质的量,还需要_____________ 数据,列出计算式:_____________________ 。
回答题:
(1)用28%氨水(密度为0.898g/L)配制4%氨水(密度为0.981g/L)500mL,需28%氨水
(a)20mL量筒 (b)100 mL量筒 (c)500 mL量筒 (d) 500 mL容量瓶
(2)填写下列操作名称:操作Ⅰ
(3)硅渣主要成分是
(4)上述流程中可以循环使用的物质X是
(5)钾氮肥的主要成分是
(6)为了测定钾氮肥中钾的含量,在试样完全溶于水后,加入足量氯化钡溶液,得到白色沉淀a克,若要计算K2SO4的物质的量,还需要
17-18高三上·上海·阶段练习 查看更多[3]
更新时间:2017-04-06 10:16:54
|
【知识点】 物质分离、提纯综合应用解读
相似题推荐
填空题
|
较难
(0.4)
名校
解题方法
【推荐1】工业上两次转化法从天青石矿(主要成分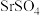 ,含有
,含有 等杂质)制备高纯碳酸锶。
等杂质)制备高纯碳酸锶。
(1)一次转化
①浸泡:用饱和碳酸钠溶液浸泡天青石矿粉,过滤得到粗品 。滤液中
。滤液中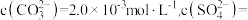
_________  。[已知:
。[已知: ]
]
②酸化:用稀盐酸浸泡粗品 ,加入一定量的催化剂氯化铵,得到含有杂质(
,加入一定量的催化剂氯化铵,得到含有杂质( )的
)的 粗溶液。该酸化过程可描述为
粗溶液。该酸化过程可描述为_________ (催化剂氯化铵参与了 与盐酸生成
与盐酸生成 的反应)。
的反应)。
③除杂。
ⅰ)除铁、铝:向 粗溶液中加入少量的
粗溶液中加入少量的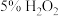 溶液,在
溶液,在 条件下加入少量的稀氨水,控制溶液
条件下加入少量的稀氨水,控制溶液 在
在_________ 范围内,充分搅拌,过滤。
已知:相关金属离子生成氢氧化物沉淀的 如下表所示,
如下表所示, 为7.8时
为7.8时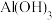 沉淀开始溶解。
沉淀开始溶解。
ⅱ)除钙:取ⅰ中滤液,逐滴加入适量稀 溶液。
溶液。
请补充完整去除 的后续实验操作:
的后续实验操作:_________ ,得到较纯净的 溶液。已知:
溶液。已知: 的溶解度随温度的升高而降低;
的溶解度随温度的升高而降低; 时,
时,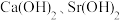 的溶解度分别为
的溶解度分别为 、
、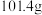 。
。
(2)二次转化。向 溶液中加入适量碳酸氢铵溶液,微热、过滤、洗涤得到高纯度
溶液中加入适量碳酸氢铵溶液,微热、过滤、洗涤得到高纯度 。
。
①写出沉淀过程中发生反应的化学方程式:_________ 。
②锶转化率随温度的变化如图所示。当反应温度大于 时,锶转化率急剧下降的原因是
时,锶转化率急剧下降的原因是_________ 。

 ,含有
,含有 等杂质)制备高纯碳酸锶。
等杂质)制备高纯碳酸锶。(1)一次转化
①浸泡:用饱和碳酸钠溶液浸泡天青石矿粉,过滤得到粗品
 。滤液中
。滤液中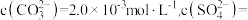
 。[已知:
。[已知: ]
]②酸化:用稀盐酸浸泡粗品
 ,加入一定量的催化剂氯化铵,得到含有杂质(
,加入一定量的催化剂氯化铵,得到含有杂质( )的
)的 粗溶液。该酸化过程可描述为
粗溶液。该酸化过程可描述为 与盐酸生成
与盐酸生成 的反应)。
的反应)。③除杂。
ⅰ)除铁、铝:向
 粗溶液中加入少量的
粗溶液中加入少量的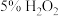 溶液,在
溶液,在 条件下加入少量的稀氨水,控制溶液
条件下加入少量的稀氨水,控制溶液 在
在已知:相关金属离子生成氢氧化物沉淀的
 如下表所示,
如下表所示, 为7.8时
为7.8时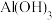 沉淀开始溶解。
沉淀开始溶解。| 物质 |  |  | 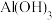 |  | 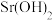 |
开始沉淀 | 1.9 | 7.0 | 3.4 | - | - |
完全沉淀 | 3.2 | 9.0 | 4.7 | 12 | - |
 溶液。
溶液。请补充完整去除
 的后续实验操作:
的后续实验操作: 溶液。已知:
溶液。已知: 的溶解度随温度的升高而降低;
的溶解度随温度的升高而降低; 时,
时,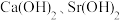 的溶解度分别为
的溶解度分别为 、
、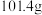 。
。(2)二次转化。向
 溶液中加入适量碳酸氢铵溶液,微热、过滤、洗涤得到高纯度
溶液中加入适量碳酸氢铵溶液,微热、过滤、洗涤得到高纯度 。
。①写出沉淀过程中发生反应的化学方程式:
②锶转化率随温度的变化如图所示。当反应温度大于
 时,锶转化率急剧下降的原因是
时,锶转化率急剧下降的原因是
您最近半年使用:0次
填空题
|
较难
(0.4)
解题方法
【推荐2】钛白粉(纳米级TiO2)广泛用作功能陶瓷、催化剂、化妆品和光敏材料等白色无机颜料,是白色颜料中着色力最强的一种,具有优良的遮盖力和着色牢度,适用于不透明的白色制品。以钛铁矿(主要成分为FeTiO3、MgO)为原料制备高纯度钛白粉,同时得到绿矾的工艺流程如图1。
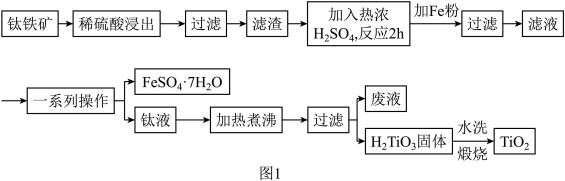
已知:常温下,稀硫酸几乎与FeTiO3不反应。
(1)稀硫酸浸出的目的是___________ 。
(2)图2、图3分别为不同固液比、温度下滤渣与热浓硫酸反应时的Ti浸出率,据图分析,最适合的固液比和温度分别是___________ 和___________ ,原因为___________ 。

(3)若用浓硫酸浸出后Ti元素的存在形式为 ,则浓硫酸与FeTiO3反应的化学方程式为
,则浓硫酸与FeTiO3反应的化学方程式为___________ 。
(4)“一系列操作”得到的绿矾先用稀钛液洗涤,再用冰水洗涤的目的是___________ ,过滤时用到的玻璃仪器有玻璃棒、___________ 。
(5)将钛液加热煮沸的目的是___________ 。
(6)若取10kg钛铁矿(FeTiO3的质量分数为95%,)经过上述流程(钛元素在整个流程中损失率为5%),则可制得钛白粉固体的质量为___________ kg。

已知:常温下,稀硫酸几乎与FeTiO3不反应。
(1)稀硫酸浸出的目的是
(2)图2、图3分别为不同固液比、温度下滤渣与热浓硫酸反应时的Ti浸出率,据图分析,最适合的固液比和温度分别是

(3)若用浓硫酸浸出后Ti元素的存在形式为
 ,则浓硫酸与FeTiO3反应的化学方程式为
,则浓硫酸与FeTiO3反应的化学方程式为(4)“一系列操作”得到的绿矾先用稀钛液洗涤,再用冰水洗涤的目的是
(5)将钛液加热煮沸的目的是
(6)若取10kg钛铁矿(FeTiO3的质量分数为95%,)经过上述流程(钛元素在整个流程中损失率为5%),则可制得钛白粉固体的质量为
您最近半年使用:0次
填空题
|
较难
(0.4)
【推荐3】氯化铁是常见的水处理剂,工业上制备无水FeCl3的一种工艺如下:
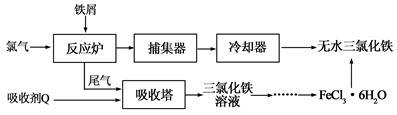
(1)试写出吸收塔中吸收剂Q(FeCl2)反应的离子方程式:________________________________ 。
(2)六水合氯化铁在水中的溶解度如下:
从FeCl3溶液制得FeCl3·6H2O晶体的操作步骤是:加入少量盐酸、___________ 、___________ 、过滤、洗涤、干燥。
(3)常温下,若溶液的pH控制不当会使Fe3+沉淀,pH=4时,溶液中c(Fe3+)=____________ mol·L-1。(常温下Ksp[Fe(OH)3]=2.6×10-39)。
(4)FeCl3的质量分数通常可用碘量法测定:称取mg无水氯化铁样品,溶于稀盐酸,再转移到100mL容量瓶,用蒸馏水定容;取出10.00mL,加入稍过量的KI溶液,充分反应后,滴入淀粉指示剂并用c mol·L―1 Na2S2O3溶液滴定用去V mL。
(已知:I2+2S2O32-=2I-+S4O62-)
①滴定终点的现象是:________________________________________________ 。
②样品中氯化铁的质量分数为___________________________________ (用字母m、C、V来表示)。

(1)试写出吸收塔中吸收剂Q(FeCl2)反应的离子方程式:
(2)六水合氯化铁在水中的溶解度如下:
| 温度/℃ | 0 | 10 | 20 | 30 | 50 | 80 | 100 |
| 溶解度(g/100gH2O) | 74.4 | 81.9 | 91.8 | 106.8 | 315.1 | 525.8 | 535.7 |
(3)常温下,若溶液的pH控制不当会使Fe3+沉淀,pH=4时,溶液中c(Fe3+)=
(4)FeCl3的质量分数通常可用碘量法测定:称取mg无水氯化铁样品,溶于稀盐酸,再转移到100mL容量瓶,用蒸馏水定容;取出10.00mL,加入稍过量的KI溶液,充分反应后,滴入淀粉指示剂并用c mol·L―1 Na2S2O3溶液滴定用去V mL。
(已知:I2+2S2O32-=2I-+S4O62-)
①滴定终点的现象是:
②样品中氯化铁的质量分数为
您最近半年使用:0次



